据联合国粮食及农业组织(FAO)统计,我国是马铃薯种植面积最大的国家,种植面积稳定在8000万亩以上,全国马铃薯鲜薯产量达一亿吨。在马铃薯贮藏过程中为防止其发芽、变绿,常在马铃薯收获的前2~4周内,用 0.2% (质量分数 )马来酰肼(MH)溶液进行叶面喷洒。MH又名抑芽丹,是一种植物生长抑制剂,能有效抑制植株顶端分生组织细胞分裂,破坏植株顶端优势,强烈抑制芽的生长,常被用于抑制马铃薯、洋葱、大蒜等蔬菜贮藏期的发芽。研究发现,MH是一种诱变致癌剂,一定剂量下会导致细胞染色体断裂,从而产生细胞毒性,对人和高等动物有潜在风险。据中国马铃薯协会统计,中国人均食用马铃薯消费量为31.3kg·a-1,日均消费量为85.75g·d-1。因此,建立马铃薯中 MH残留的简便、快速的检测方法已成为保障人民身体健康的迫切需求。
目前,MH残留的检测方法主要有蒸馏-分光光度法、高效液相色谱法(HPLC)、液相色谱-串联质谱法(LC-MS/MS)、气相色谱法、毛细管电泳法、拉曼光谱法、化学发光法、差分脉冲伏安法等。较为常见的是前3种方法,其中蒸馏-分光光度法是美国分析化学家协会(AOAC)最初采用的方法,其依赖MH在浓碱及高温条件下被锌还原成肼,同时用氮气保护,将生成的肼蒸馏出来,在酸性溶液中与对二甲基氨基苯甲醛反应生成黄色化合物,再用分光光度法进行检测。该过程需要浓碱、高温条件,以及蒸馏等步骤,前处理复杂,操作繁琐,导致方法重复性不好。HPLC检测灵敏度较差,若想达到较低的检出限,则需要浓缩、复溶等一系列复杂的前处理手段。LC-MS/MS检测MH虽有较高的灵敏度,但仪器成本高,难以作为常规检测手段。根据MH的化学结构,它在弱酸性、碱性条件下呈阴离子状态,并且具有紫外吸收,因此可采用带有紫外检测器的离子色谱法进行分析检测。
鉴于此,研究人员提出了离子交换色谱-紫外检测器法测定马铃薯中MH残留量的方法。相较于蒸馏-分光光度法、HPLC等传统检测方法,该方法前处理简单,更易于推广为常规检测方法;相较于离子排斥色谱法,该方法更加通用,同时流动相避免了有机溶剂的引入,符合绿色环保的理念,且流动相由KOH淋洗液发生器在线产生,不仅基线噪声更低,还避免了手动配制流动相产生的误差及二氧化碳的影响,有效提高了方法的精密度和稳定性。
1、试验方法
本文分析的市售马铃薯均未检出 MH,因此将马铃薯浸泡在MH标准溶液中可简单模拟MH残留的马铃薯样品。将马铃薯洗净,切成厚片,浸泡于500mg·L-1MH标准溶液中,再置于2~8℃冰箱中放置24h。24h后取出,洗净、去皮、搅碎。称取样品处理后的样品于离心管中,加入甲醇,超声,每隔5min振摇1次,使样品分散均匀,然后于60℃水浴加热,室温下离心,上清液过0.22μm聚醚砜针式滤器和IC-RP反相前处理柱,滤液按照仪器工作条件进行测定。
2、结果与讨论
2.1 提取溶剂的选择
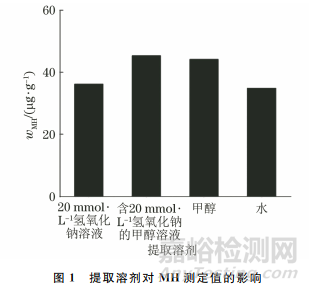
试验采用阴离子交换色谱柱,流动相为碱性溶液,若提取溶剂选择不当,不仅会影响提取效率,还会影响待测物的保留时间和检测结果。试验考察了含20mmol·L-1氢氧化钠的甲醇溶液、20mmol·L-1氢氧化钠溶液、水以及甲醇分别作为提取溶剂时模拟马铃薯样品中MH的测定值,结果如图1所示。
由图1可知,以甲醇和含20 mmol·L-1氢氧化钠的甲醇 溶 液 为 提 取溶剂时,MH测定值分别为44.19μg·g-1和45.37μg·g-1,略高于以20mmol·L-1氢氧化钠溶液和水为提取溶剂时的(MH测定值分别为36.23μg·g-1和34.90μg·g-1)。考虑到加入碱会影响溶液酸度,从而影响待测物的出峰时间,试验选择以甲醇为马铃薯中MH的提取溶剂。
2.2 仪器工作条件的选择
2.2.1 淋洗液发生器的使用
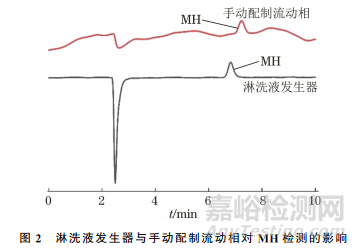
阴离子交换色谱柱的流动相可通过 KOH淋洗液发生器在线产生,也可用手动配制的NaOH溶液。试验考察了这两种方式的流动相对MH检测的影响,淋洗液发生器采用的流动相为3mmol·L-1KOH 溶液,手动配制的流动相为3mmol·L-1NaOH溶液,结果如图2所示。
结果表明,采用KOH淋洗液发生器的基线噪声比采用手动配制NaOH溶液的小。这是由于NaOH溶液在手动配制过程中会吸收空气中二氧化碳,对基线造成一定的影响,而淋洗液发生器可实时制备出较为纯净的KOH溶液,避免了杂质干扰。因此,试验采用KOH淋洗液发生器提供流动相。
2.2.2 色谱柱
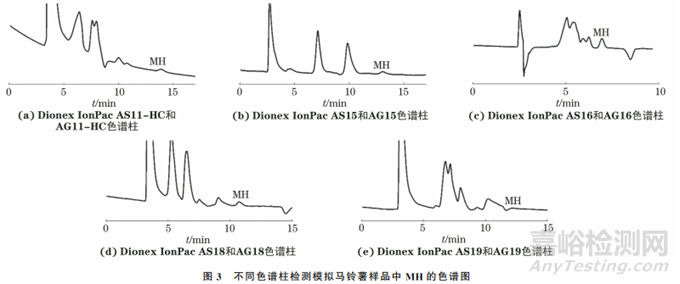
试验考察了Dionex IonPac AS11-HC和AG11-HC、Dionex IonPac AS15和AG15、Dionex IonPac AS16和AG16、Dionex IonPac AS18 和AG18以及 Dionex IonPac AS19和AG19等5种色谱柱(前者为分析柱,后者为保护柱)对模拟马铃薯样品中MH色谱峰的影响,结果见图3。
结果表明:采用Dionex IonPac AS11-HC和AG11-HC 色谱柱分离时(流动相为1mmol·L-1KOH溶液),基线不稳定,且MH出峰前出现保留时间为12.75min的未知峰(由于含量太少,图中未能显示),与MH的分离度为1.22,小于1.5,不适用于MH的分离检测;采 用Dionex IonPac AS19和AG19色谱柱分离时(流动相为5mmol·L-1KOH溶液),MH显示为倒峰,可能是由于模拟样品中有其他物质与MH在同一位置出峰,且在205nm 检测波长下的吸光度比基线小,不宜用于MH的检测;Dionex IonPac AS15 和AG15 (流动相为10mmol·L-1KOH 溶液)、Dionex IonPac AS16和AG16(流动相为3mmol·L-1KOH溶液)、Dionex IonPac AS18和 AG18(流动相为5mmol·L-1KOH溶液)色谱柱均可较好地分离MH,但Dionex IonPac AS16和AG16色谱柱得到的MH色谱峰峰高相对较高,半峰宽相对较小,对称性较好。因此,试验选用Dionex IonPac AS16和AG16 色谱柱进行检测。
2.2.3 洗脱程序
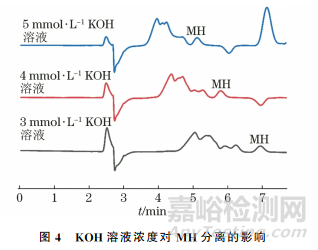
试验考察了KOH溶液浓度分别为3,4,5mmol·L-1时模拟马铃薯样品中MH的分离情况,结果见图4。
结果表明,当KOH溶液浓度由5mmol·L-1降低至3mmol·L-1时,MH 色谱峰与前面未知峰的分离度逐渐增加,其中3,4mmol·L-1KOH溶液得到的MH分离度(1.99,1.68)均满足大于1.5的要求。鉴于3mmol·L-1KOH溶液得到的MH分离度更好,且保留时间也比较合理,试验选择以3mmol·L-1 KOH溶液分离MH。MH洗脱分离后,立即将KOH溶液浓度升至30 mmol·L-1来冲洗杂质,最后再将KOH溶液浓度降至3mmol·L-1平衡系统。
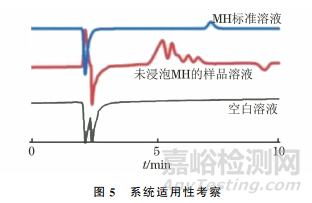
2.3 系统适用性
按照仪器工作条件分别对空白溶液、未浸泡MH的样品溶液以及2.028mg·L-1MH 标准溶液进行测定,考察MH的干扰情况,结果见图5。
由图5可知,空白溶液和未浸泡MH 的样品溶液中均未出现干扰MH的物质,说明该方法对马铃薯中MH的检测不存在干扰。
2.4 方法学验证
2.4.1 标准曲线、检出限和测定下限
取10,20,50,80,100μL1014mg·L-1MH标准储备溶液,用水定容至10mL,摇匀,即得质量浓度分别为1.014,2.028,5.070,8.112,10.14mg·L-1的MH标准溶液系列;分取360μL5.070mg·L-1MH标准溶液,用水定容至10mL,摇匀,即得质量浓度为0.1825mg·L-1的 MH标准溶液。按照仪器工作条件对上述6个浓度水平的MH标准溶液进行测定,以MH质量浓度为横坐标,对应的峰面积为纵坐标进行线性回归。结果表明:MH标准曲线的线性回归方程为y=2.194x-0.06424,相关系数为0.9999,线性范围为0.1825~10.14mg·L-1。
分别以3,10倍信噪比(S/N)确定检出限(3S/N)和测定下限(10S/N),结果分别为0.06mg·L-1和0.18mg·L-1。
2.4.2 仪器精密度和重复性试验
将2.028mg·L-1MH标准溶液按照仪器工作条件测定6次,结果显示,MH的保留时间和峰面积的相对标准偏差(RSD)分别为0.073%,3.7%,表明仪器稳定,精密度较好。
取同一模拟马铃薯样品,按照试验方法平行处理6份并测定,结果显示,MH的保留时间、测定值和峰面积的 RSD分别为0.15%,3.8%,3.4%,表明本方法重复性较好。
2.4.3 稳定性试验
将2.082mg·L-1MH标准溶液及模拟马铃薯样品溶液在室温下放置,于 0,6,12,18,24h分别进行测定。结果显示:标准溶液中MH的保留时间和峰面积的RSD分别为1.6%,2.2%,模拟马铃薯样品溶液中MH的保留时间和峰面积的RSD分别为1.3%,1.8%,说明24h内MH的稳定性良好。
2.4.4 耐用性试验
试验考察了柱温、流量和检测波长这3个参数的耐用性。
改变柱温为28℃和32℃,其他条件不变,对2.082mg·L-1MH标准溶液测定6次,对模拟马铃薯样品溶液测定1次。结果表明:当柱温为28,32℃时,MH色谱峰与未知峰的分离度分别为1.91和2.10,均满足分离度大于1.5的要求;6次测定的MH峰面积的RSD 分别为4.0%和4.4%,精密度较好,说明柱温为(30±2)℃时对MH的检测没有影响。
改变流量为0.9 mL·min-1和1.1mL·min-1,其他条件不变,对2.082mg·L-1MH标准溶液测定6次,对模拟马铃薯样品溶液测定1次。结果表明:当流量为0.9,1.1mL·min-1时,MH色谱峰与未知峰的分离度分别为1.95和2.03,均满足分离度大于1.5的要求;6次测定的MH峰面积的RSD分别为3.1%和4.1%,精密度较好,说明流量为(1.0±0.1)mL·min-1时对MH 的检测没有影响。
改变检测波长为203nm和207nm,其他条件不变,对2.082mg·L-1MH标准溶液测定6次,对模拟马铃薯样品溶液测定1次。结果表明:当检测波长为203,207nm 时,MH色谱峰与未知峰的分离度分别为1.97和2.00,均满足分离度大于1.5的要求;6次测定的MH峰面积的RSD分别为4.1%和2.3%,精密度较好,说明检测波长为(205±2)nm时对MH的检测没有影响。
2.4.5 回收试验
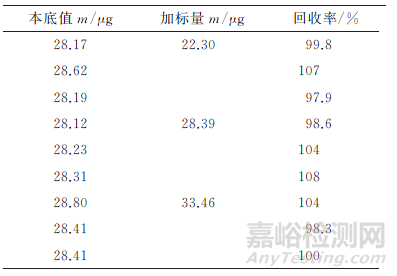
在模拟马铃薯样品中加入MH本底值80%,100%,120% 的 MH 标 准 品,即 分 别 加 入 22,28,33μL1014mg·L-1MH标准储备溶液,每个浓度水平平行加标3次,按照试验方法进行处理和测定,计算回收率,结果如表1所示。
表1 回收试验结果
由表1可知:MH回收率为97.9%~108%,表明本方法的准确度较高。
2.5 样品分析
随机从4个商家购买4 份马铃薯样品,按照试验方法分析其中MH的残留情况。结果显示,马铃薯样品中均未检出MH(残留量均低于检出限),远低于GB 2763-2019《食品安全国家标准 食品中农药最大残留限量》规定的马铃薯中 MH 的最大残留量(50μg·g-1)。
3、试验总结
本文提出了离子交换色谱-紫外检测器法测定马铃薯中MH残留量的方法,该方法分析快速,准确度高,重复性和稳定性均较好,可作为马铃薯中MH残留检测的通用方法,并可推广到其他农产品如大蒜、洋葱中MH的检测和质量控制。
作者:王晓威,孟玲玲,蔡丹旎,于世强,刘鹏宇,栾绍嵘
单位:华东理工大学 化学与分子工程学院
来源:《理化检验-化学分册》2024年第1期