今日头条
康方PD-1/CTLA-4双抗肝癌Ⅱ期临床积极。康方生物PD-1/CTLA-4双抗卡度尼利联合仑伐替尼和经肝动脉化疗栓塞(TACE)用于中晚期不可切除肝细胞癌(uHCC)的Ⅱ期临床AK104-216研究成果发表于ASCO GI 2024会议上。中位随访为5.1个月时,卡度尼利联合治疗的客观缓解率(ORR)和疾病控制(DCR)率分别为85.0%和95.0%;中位无进展生存期(PFS)尚未达到,6个月PFS率和9个月PFS率达到75.6%和60.4%。此外,联合用药安全性良好。
国内药讯
1.映恩HER2-ADC启动乳腺癌国际Ⅲ期临床。映恩生物与BioNTech公司合作开发的HER2 ADC药物DB-1303(BNT323)在治疗转移性激素受体阳性(HR+)、人表皮生长因子受体2(HER2)低表达乳腺癌患者的关键Ⅲ期临床DYNASTY-Breast02完成首例患者给药。该项试验预计在全球超过223个临床研究中心入组532例患者。在Ⅰ/Ⅱ期研究中,DB-1303治疗达到38.5%的客观缓解率,疾病控制率为84.6%。BioNTech拥有该新药在大中华区外的全球权利。
2.辉瑞新型RSV疗法启动国际Ⅱ/Ⅲ期临床。辉瑞靶向RSV的新型抗病毒疗法Sisunatovir在中国登记启动一项国际Ⅱ/Ⅲ期临床,旨在感染呼吸道合胞病毒且伴有进展为重症风险的症状性非住院成人中评估Sisunatovir的疗效和安全性究。该项试验中国部分由中日友好医院医学博士曹彬牵头开展。Sisunatovir旨在通过抑制由F蛋白介导的病毒与宿主细胞的融合,以阻断RSV复制。该产品此前已被FDA授予快速通道资格。
3.拓新天成TX103靶向CAR-T获批胶质瘤临床。福州拓新天成1类生物药“TX103嵌合抗原受体T细胞注射液”获国家药监局临床许可,拟开发用于治疗复发或进展的4级脑胶质瘤。这是一款靶向B7-H3的CAR-T疗法,已在治疗复发恶性脑胶质瘤的早期临床中获得较好的安全性数据和疗效信号。去年6月,FDA已授予该新药治疗恶性脑胶质瘤的孤儿药资格。
4.翰森代谢病小分子新药获批临床。翰森制药代谢性疾病领域1类化药HS-10501片获国家药监局临床试验默示许可,适应症为“成人2型糖尿病和成人肥胖症”。在该领域,翰森制药还拥有多个在研项目,包括1类新药HS-10511片、HS-20094注射液、HS-10384片、HS-10518胶囊等。其中,HS-20094是一款GLP-1R/GIPR双靶点激动剂,已在I期临床中获得安全性数据,并展现出显著降糖减重的信号。
5.辉大DNA编辑疗法获DMD孤儿药资格。FDA授予辉大基因公司CRISPR-Cas12 DNA编辑疗法HG302孤儿药资格,用于治疗杜氏肌营养不良(DMD)。HG302旨在通过单个病毒载体将高保真Cas12(hfCas12Max)和靶向人DMD基因第51号外显子剪接供体(SD)位点的CRISPR RNA递送到肌肉中,以恢复功能性肌营养不良蛋白的表达。此前,该新药已获得FDA授予治疗DMD的儿科罕见病药物资格。
6.苏州般若创新溶瘤病毒疗法报IND。苏州般若生物“POV-601-1A1溶瘤病毒注射液”临床试验申请获CDE受理。这是该公司申报的首款溶瘤病毒疗法,适应症主要针对宫颈癌。POV-601-1A1旨在通过溶瘤病毒选择性地在肿瘤组织内复制,进而裂解癌细胞,引发强烈的免疫反应,增强机体的抗肿瘤能力。与传统的肿瘤治疗方法相比,溶瘤病毒疗法对肿瘤细胞的杀伤作用更为精准和彻底。
国际药讯
1.诺华PI3Kα抑制剂获FDA扩大适应症。诺华乳腺癌靶向药阿吡利塞(alpelisib)获FDA扩大适应症,将绝经前和围绝经期妇女纳入乳腺癌适应症治疗范围。alpelisib是首款针对PIK3CA突变的HR+/HER2-晚期乳腺癌的治疗方法。2019年5月,FDA批准alpelisib上市,联合氟维司群用于治疗接受内分泌疗法后病情进展、PIK3CA突变、HR+/HER2-局部晚期或转移性乳腺癌女性(绝经后)和男性患者。
2.O药联合治疗结直肠癌III期临床积极。百时美施贵宝PD-1抑制剂Opdivo(纳武利尤单抗)联合CTLA-4抑制剂Yervoy(伊匹木单抗)一线治疗MSI-H/dMMR转移性结直肠癌(mCRC)的III期CheckMate-8HW研究积极结果公布于ASCO2024年会上。与化疗相比,Opdivo+Yervoy联合治疗显著改善患者的无进展生存期(PFS),疾病进展或死亡风险降低79%(HR:0.21;95% CI:0.14-0.32;p<0.0001);安全性数据与已知研究一致。目前,该项研究仍在评估第二个双重主要终点。
3.Ionis公司ASO疗法血管水肿Ⅲ期临床积极。Ionis公司反义寡核苷酸(ASO)疗法donidalorsen治疗遗传性血管水肿(HAE)的Ⅲ期OASIS-HAE研究达到主要终点和关键次要终点。与安慰剂相比,donidalorsen(Q4W,Q8W)皮下注射治疗降低了患者的血管性水肿发作率(p<0.001,p=0.004);药物具有良好的安全性。详细数据将公布于医学会议上。Ionis计划尽快向FDA递交其新药申请。
4.Sagimet公司NASH新药II期研究成功。Sagimet公司脂肪酸合成酶(FASN)抑制剂Denifanstat治疗非酒精性脂肪性肝炎(NASH)的IIb期FASCINATE-2研究达到双重主要终点和多个次要终点。52周时,与安慰剂相比,Denifanstat组患者实现NASH消退且纤维化程度不恶化且NAS下降≥2分的患者比例显著更高(36%vs13%,P=0.002),达到纤维化程度不恶化且NAS下降≥2分的患者比例更高(52%vs20%,P=0.0001);临床中未观察到与治疗相关的严重不良事件(SAE)。歌礼拥有该新药的大中华区权益。
5.创新免疫组合疗法结直肠癌Ⅱ期临床积极。Agenus公司CTLA-4抗体botensilimab(BOT)联合PD-1抗体balstilimab(BAL)用于新辅助治疗微卫星稳定(MSS)/微卫星高度不稳定(MSI-H)的结直肠癌(CRC)的Ⅱ期NEST-1临床结果积极。在MSS队列中,有67.5%患者肿瘤缩小≥50%,而在MSI-H队列中,100%患者肿瘤缩小。临床中仅观察到2例3级治疗相关不良事件(TRAE)。
6.吉利德TROP2靶向ADC肺癌III期研究失败。吉利德靶向TROP2的ADC药物戈沙妥珠单抗(Trodelvy)治疗经治转移性或晚期非小细胞肺癌(NSCLC)的III期EVOKE-01研究未达到主要终点。与多西他赛相比,Trodelvy治疗提高患者的总生存期(OS),但不具统计学显著性。吉利德表示继续探索Trodelvy目标人群。目前,Trodelvy联合帕博利珠单抗一线治疗PD-L1 TPS≥50%的转移性NSCLC的Ⅲ期EVOKE-03研究正在进行当中。
医药热点
1.上海市儿童医院亳州医院试运行。为加快提升长三角儿科医疗服务供给水平,增强亳州市儿童疾病诊疗水平和儿童疑难危重复杂疾病救治能力,上海市儿童医院和亳州市人民政府合作共建亳州市儿童医院(上海市儿童医院亳州医院)日前启动试运行。上海市儿童医院将按照“全面帮扶、稳步推进、资源共享、提升服务”的原则,全面负责亳州市儿童医院的医疗业务管理,包括医教、护理、院感等,同时协助开展财务、人事、后勤、信息、运营等方面的管理。
2.全国首个省级咯血中心在渝授牌。1月20日,由重医附一院牵头建设的重庆市咯血联盟正式成立。这是全国首个省级咯血中心,由57家成员单位组成。该联盟的成立,将进一步拓展咯血患者救治绿色通道,全面形成覆盖全市三级、二级医院和基层医疗机构的大咯血救治示范中心与救治网络;促成各医疗单位间咯血患者的互联互通,以达到降低死亡率的目标。
3.浦东允许新药参照国际同类药品定价。1月22日,中共中央办公厅、国务院办公厅印发《浦东新区综合改革试点实施方案(2023-2027年)》发布。《方案》明确,建立生物医药协同创新机制,推动医疗机构、高校、科研院所加强临床科研合作,依照有关规定允许生物医药新产品参照国际同类药品定价,支持创新药和医疗器械产业发展。支持建设符合国际医学伦理和管理运营规则的长三角医用组织库。
评审动态
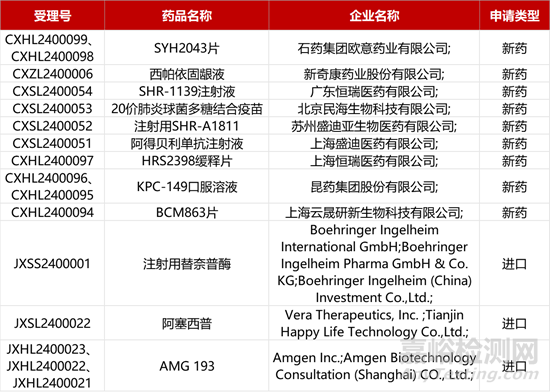
1. CDE新药受理情况(01月23日)
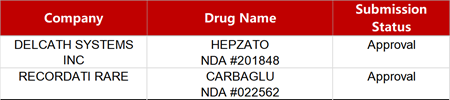
2. FDA新药获批情况(北美01月24日)