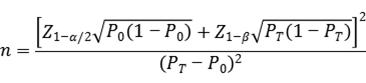PD-L1抗体试剂及检测试剂盒注册审查指导原则
(征求意见稿)
本指导原则旨在指导注册申请人对PD-L1抗体试剂及检测试剂盒注册申报资料的准备及撰写,同时也为技术审评部门提供参考。
本指导原则是对基于免疫组织化学方法的PD-L1抗体试剂及检测试剂盒的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是对注册申请人和技术审评人员的指导性文件,但不包括注册审批所涉及的行政事项,也不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究和验证资料,相关人员应在遵循法规的前提下使用指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围
本指导原则适用于利用免疫组织化学法,对病理组织切片中PD-L1进行检测的试剂。此类试剂为特异性单克隆或多克隆抗体,或抗体与显色系统、对照试剂、质控片(如有)及其它辅助试剂一同包装成试剂盒形式的检测试剂,用于免疫检查点抑制剂的伴随诊断或补充诊断。
对于采用其他方法学的PD-L1检测试剂,可能部分要求不完全适用或本文所述内容不够全面,申请人应参照本指导原则,根据产品特性对适用部分进行评价,并补充其他的评价资料。
本指导原则适用于PD-L1抗体试剂或PD-L1检测试剂盒注册申请和变更注册申请的情形。本指导原则仅针对注册申报资料中的部分内容进行撰写,其他未尽事宜应当符合《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》等相关法规要,同时建议参考《定性检测体外诊断试剂分析性能评估注册审查指导原则》等适用的技术文件。
二、注册审查要点
(一)监管信息
1.产品名称及分类编码
产品名称应符合《体外诊断试剂注册与备案管理办法》及相关法规的要求,如PD-L1抗体试剂(免疫组织化学法)和PD-L1检测试剂盒(免疫组织化学法)。根据《体外诊断试剂分类规则》(国家药品监督管理局公告2021年第129号),该产品按照第三类体外诊断试剂管理,分类编码为6840。
2.其他信息还包括产品列表、关联文件、申报前与监管机构的联系情况和沟通记录以及符合性声明等文件。
(二)综述资料
综述资料主要包括概述、产品描述、预期用途、申报产品上市历史及其他需说明的内容。其中,预期用途中应描述指导用药相关用途和辅助诊断用途(如适用);产品描述中应详述检测原理、产品主要研究结果的总结和评价、与同类和/或前代产品的比较等。
建议以列表的方式进行与同类和/或前代产品的比较分析,比较境内外已批准上市试剂和注册申报产品的克隆号、抗体的性质(如单克隆抗体,IgG1型)、适用的肿瘤组织类型、预期用途、判读方式、产品主要性能等方面的主要区别。
(三)非临床资料
1.产品技术要求
产品技术要求应主要包括以下性能指标:外观、符合性、批内重复性、批间重复性等。其中“符合性”和“重复性”指标,应明确采用包含不同表达水平的适用肿瘤组织类型组织片进行检测。申报试剂如有适用的国家标准、行业标准,则产品技术要求不得低于上述标准要求。另外,产品技术要求中应以附录形式明确主要原材料及生产工艺的要求。
2.分析性能研究
注册申请人应采用在符合质量管理体系的环境下生产的试剂盒进行所有分析性能研究,提交具体研究方法、试验方案、试验数据、统计分析等详细资料。
分析性能评估所用样本的基本信息均需明确,例如样本类型、组织类型、细胞片的制备与稀释方式(如适用)、表达水平及确定方法等。分析性能评估用样本应为组织切片、组织芯片或细胞系切片,应提供商业化组织芯片相关信息。
2.1样本稳定性
应至少包括所有适用的组织类型切片在不同储存条件下的实时稳定性研究,研究样本应包含低、中、高PD-L1表达的样本。研究所用切片的制备应采用与说明书一致的方法,如切片的保存温度范围覆盖冷藏和室温,应分别进行稳定性研究,其中室温研究应在声称的最高温度条件下进行。
申请人可通过提交文献或进行实时稳定性研究的方式,支持说明书中蜡块稳定性的声称。
2.2免疫反应性
2.2.1正常组织:对30种正常人体组织(见表1),每种组织类型不少于3例,进行特异性评价,同时对着色位置及染色特点进行描述。
表1:正常组织列表
|
中枢神经系统
|
脑、大脑(灰质与白质神经元、胶质等)
|
|
脑、小脑
|
|
内分泌系统
|
肾上腺(皮质与髓质)
|
|
卵巢
|
|
胰腺(胰岛与外分泌胰腺)
|
|
甲状旁腺
|
|
垂体(腺垂体与神经垂体)
|
|
睾丸
|
|
甲状腺(滤泡上皮、滤泡旁细胞、胶体等)
|
|
乳 腺
|
乳腺(乳腺小叶、乳腺管、肌上皮细胞等)
|
|
造血组织
|
脾
|
|
扁桃体
|
|
胸腺(幼儿)
|
|
骨髓(淋巴细胞、单核细胞/巨噬细胞、粒细胞、红系祖细胞、巨核细胞、肥大细胞、破骨细胞、成骨细胞)
|
|
呼吸系统
|
肺(支气管、细支气管、肺泡等)
|
|
心 血 管
|
心脏
|
|
消化系统
|
食管
|
|
胃
|
|
小肠(回肠、空肠或十二指肠)
|
|
结直肠
|
|
肝脏(门静脉、肝细胞等)
|
|
唾液腺
|
|
泌尿生殖系统
|
肾
|
|
前列腺
|
|
子宫(宫体、宫颈)
|
|
膀胱
|
|
骨骼肌肉
|
骨骼肌
|
|
皮 肤
|
皮肤 (表皮、 附件、真皮)
|
|
外周神经系统
|
外周神经
|
|
间皮细胞
|
胸壁、腹壁、心包膜或胃肠、心脏与/或肺样本表面内层细胞
|
2.2.2非正常组织:对相关良性、恶性病变组织(示例见表2)进行特异性评价。如有采用申报产品为试验材料进行研究的相关文献资料,也可提交文献资料作为抗体试剂或检测试剂盒与非正常组织的免疫反应性的支持资料。
表2:非正常组织列表
|
脊索瘤
|
|
胚胎瘤
|
|
恶性室管膜瘤
|
|
胶质母细胞瘤
|
|
肝母细胞瘤
|
|
肝细胞癌
|
|
胰岛细胞瘤
|
|
间质瘤
|
|
平滑肌肉瘤
|
|
淋巴瘤
|
|
淋巴瘤(间变性大细胞、弥漫B细胞、霍奇金和非霍奇金)
|
|
髓母细胞瘤
|
|
髓样癌
|
|
黑色素瘤
|
|
脑膜瘤
|
|
间皮瘤
|
|
神经母细胞瘤
|
|
纤维神经瘤
|
|
骨肉瘤
|
|
嗜铬细胞瘤
|
|
原始神经外胚层
|
|
肾肿瘤(乳头状、透明细胞)
|
|
横纹肌肉瘤
|
|
精原细胞瘤
|
|
印戒细胞癌
|
|
鳞状细胞癌(宫颈、头颈、肺等)
|
|
滑膜肉瘤
|
|
胸腺瘤
|
|
过渡细胞癌
|
|
腺癌(乳腺、胃、结直肠等)
|
|
肾上腺皮质癌
|
|
星形细胞癌
|
|
基底细胞癌
|
|
软骨肉瘤
|
2.3特异性
2.3.1交叉反应研究
应进行PD-L1与PD-1、PD-L2的交叉反应研究,可利用免疫组织化学方法对表达不同蛋白的细胞/组织检测,验证抗体的特异性。也可利用其它合理的方法进行交叉反应研究。
2.3.2特异性识别研究
采用免疫印记法或酶联免疫法验证检测试剂可特异性检测PD-L1的性能。通过添加PD-L1抗原进行检测或检测PD-L1基因敲除肿瘤细胞等方法,验证检测试剂的特异性。
2.4精密度
精密度研究应采用随机盲法进行,样本应为消除识别信息的预期样本(未染色样本),包括阴性、阳性及一定数量(应不少于总样本量的20%)阳性判断值附近的阴性和阳性样本,研究数据应包评分结果及着色位置,采用合理的统计方法(如Wilson Score法)计算阴性一致率百分比(Negative Percent Agreement,NPA)、阳性一致率百分比(Positive Percent Agreement,PPA)、总体一致率(overall agreement, OPA)及双侧95%置信区间。研究应制定适当的接受标准,建议一致率95%置信区间下限不低于85%。
2.4.1内部重复性
2.4.1.1检测内精密度:对连续切片的预期组织类型样本,进行检测重复性研究。
2.4.1.2检测间精密度
对可能影响检测精密度的主要变量进行验证,包括不同批次间(不少于3批次)、不同仪器间、日间、操作者间和阅片者间。同一阅片者两次阅片之间应设置合理的遗忘期,如2周清除期。
2.4.2外部重复性
在至少3个外部检测实验室进行研究,研究应包含对非连续日间、不同阅片者间、不同外部实验室间的评价。
2.5灵敏度
研究对不同分期、原发性和转移性肿瘤的预期组织类型样本的检出能力。研究样本应包含不同表达水平%(0-100%)和染色强度,并计算所有样本检测的阳性率和不同染色强度(如适用)的阳性样本比例。
2.6提供企业参考品验证资料:根据主要原材料研究资料中的企业参考品设置情况,采用三批产品对企业参考品进行检验并提供详细的试验数据。
2.7参加国内外质控机构的质控活动情况
建议企业积极参加国内(卫生计生委病理质控评价中心)、国际质控机构(NordiQC、UK NEQUAS、CAP等)的质控活动,并提交质控结果报告。
2.8反应体系
2.8.1样本采集和处理
简述样本的固定、包埋的要求,包括但不限于固定剂的选择、组织块的厚度要求、固定时间和温度要求、包埋条件等。上述条件要求可引用规范性操作手册,也可通过研究确定。
建议申请人对切片厚度、载玻片的要求进行研究,确定适用的切片厚度范围和载玻片类型。
2.8.2抗原修复
详述抗原修复方法和参数条件,包括方法、时间、温度、pH值的确定依据。如抗原修复液可重复使用,应提交重复使用次数限定的研究资料。
2.8.3最适抗体滴度确定的研究。
2.8.4检测体系反应条件确定
申请人应考虑脱蜡水化、酶阻断、抗体孵育、显色、复染等步骤对产品性能的影响,通过试验确定上述条件的最佳组合。常规免疫组织化学检测步骤的确定,可引用行业和企业内部规范性操作手册或文献,但应对确定后的检测步骤进行性能验证。
2.8.5质量控制
申报产品应建立可有效监测染色过程的质量控制方法,明确推荐质控片的组织类型和制备方法,提交染色结果可接受标准确定的研究资料。
3.稳定性研究资料
稳定性研究主要包括实时稳定性(有效期)、运输稳定性、开瓶(开封)稳定性、机载稳定性和稀释稳定性(如适用)研究,注册申请人可根据实际需要选择合理的稳定性研究方案。稳定性研究资料应包括研究方法的确定依据、具体的实施方案、详细的研究数据以及结论。对于实时稳定性研究,应提供至少三批样品在实际储存条件下保存至成品有效期后的研究资料。
4.阳性判断值研究
此类产品的阳性判断值,部分来源于药物临床试验的疗效数据。典型的阳性判断值研究包含建立和验证两部分,两部分研究样本应相互独立。
建立阳性判断值使用的样本应满足药物临床试验设计并考虑到不同的地理区域、民族(种族)、性别、年龄、不同病理分期等因素。可采用基于评价指标如客观缓解率(ORR)的最佳总体反应绘制受试者工作特征曲线(receiver operating characteristic curve, ROC)的分析方式来选择确定合理的阳性判断值。
申请人也可参考既往经验或已上市同类产品,通过ROC等分析方式来拟定申报产品的阳性判断值,该阳性判断值应与参考的同类产品的阳性判断值一致。参考建立的阳性判断值招募受试者直接进入主要疗效临床试验,并对阳性判断值进行验证。
5.其他资料
5.1主要原材料研究资料
此产品的主要原材料包括第一抗体、显色系统、封闭液、同型对照抗体、质控片、企业内部参考品等。应提供主要原材料的选择与来源、制备过程、质量控制标准等相关研究资料。考虑到产品注册单元的不同,申请人应根据产品注册单元的实际情况,递交相应原材料资料。如主要原材料为企业自制,应提供其详细制备过程;如主要原材料源于外购,应提供资料包括:选择该原材料的依据及对比筛选试验资料、供应商提供的质量标准、出厂检验报告,以及该原材料到货后的质量检验资料,供应商应固定,不得随意更换。
5.1.1第一抗体
5.1.1.1克隆选择研究
应提交克隆筛选试验资料,包括试验方法、筛选原则、与公认抗体的比较研究等。应明确抗体所针对的抗原表位、抗体制备所用免疫原。
5.1.1.2抗体性质鉴定
应提交抗体性质鉴定研究资料,包括:抗体的特异性、亲和常数及效价、抗体的类型及亚型、抗体蛋白纯度的验证。提供抗体识别位点的验证。申请人可通过放射性免疫分析法、双向琼脂扩散法、酶联免疫吸附法、免疫印迹法、凝胶电泳等方法进行研究。
5.1.2酶标第二抗体系统的选择及验证
检测试剂盒中的第二抗体系统一般均为外购,应详述酶标第二抗体系统的确定依据,明确外购方名称,提交外购方出具的检验证书,详述申请人对酶标第二抗体系统相关主要原材料的技术指标。
5.1.3质控片(如适用)
建议在试剂盒中设置质控片,质控片可以为已知表达的阴、阳性细胞(系)或组织样本。应提交质控片细胞或组织类型选择的依据、质控片PD-L1表达情况确定的研究资料和质控片染色接受标准确定资料。
5.1.4同型对照抗体
为有效识别检测过程中可能出现的非特异性染色,建议试剂盒(配套)包含同型对照抗体。简述同型抗体的动物源性、亚型、浓度、纯度等基本信息。
5.1.5封闭液
封闭液应能够封闭非特异结合、内源性酶活性或内源性生物素等。
5.1.6其他主要原辅料的选择及验证资料,如牛血清白蛋白、抗原修复液、抗菌剂等。
该类主要原辅料一般均为外购,应说明有生物活性的原辅料的外购方名称,提交外购方出具的检验证书,详述申请人对每一原辅料的质量要求。
5.1.7企业内部参考品
详述内部质控片的组成,包括组织类型、例数和强度。应提供对内部质控片组织类型和强度的确定依据,建议采用临床上普遍认为质量较好的同类试剂进行确认。
(四)临床评价资料
该类试剂应通过临床试验路径进行临床评价,临床试验包括产品临床性能研究和伴随诊断试剂临床意义研究两部分。临床试验应符合《体外诊断试剂注册与备案管理办法》《医疗器械临床试验质量管理规范》和《体外诊断试剂临床试验技术指导原则》的要求,如相关法规、文件有更新,临床试验应符合更新后的要求。下面仅说明该类产品临床试验中应关注的重点问题。
1.临床性能研究
1.1产品临床试验结果重现性研究
基于免疫组化法的PD-L1检测试剂操作程序和结果判读较为复杂,该类检测试剂临床应用的重复性是产品重要的临床性能,产品临床试验应按照《PD-L1检测试剂临床试验—结果重现性研究注册审查指导原则》要求开展结果重现性研究。
1.2与已上市同类产品的对比试验
针对非原研PD-L1检测试剂,应开展试验体外诊断试剂与原研伴随诊断试剂的一致性比对,确认产品临床性能。
1.2.1临床试验机构
应选择具备相应条件且按照规定备案的医疗器械临床试验机构开展临床试验。临床试验机构数量应不少于3家,且具有免疫组织化学相关专业优势,试验操作人员应有足够的时间熟悉检测系统的各环节(仪器、试剂、质控及操作程序等),熟悉评价方案。在整个试验中,试验体外诊断试剂和对比方法均应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
1.2.2临床试验方法
临床试验应选择已上市的原研伴随诊断试剂作为对比试剂,评价申报产品与原研伴随诊断试剂检测结果的一致性。
1.2.3临床试验受试人群的选择
临床试验的受试人群应来自产品的预期适用人群。如待评价产品PD-L1检测试剂盒预期用途为定性检测中性福尔马林固定石蜡包埋(FFPE)的食管鳞状细胞癌(ESCC)组织中的PD-L1蛋白表达,则入组病例应为临床明确诊断为食管鳞状细胞癌的病例。
为了更加科学的评价产品性能,临床试验应入组部分PD-L1表达阳性阈值临近范围内病例(用于指导抗肿瘤药物使用的阈值)。
1.2.4.临床试验样本类型
PD-L1检测试剂临床试验研究的样本类型为中性福尔马林固定石蜡包埋的病理组织样本(FFPE样本)。临床样本的采集建议按照相关实验室检测技术规范要求执行。
1.2.5临床试验样本量
临床试验主要评价指标为试验体外诊断试剂与原研伴随诊断试剂检测结果的一致性。临床试验阳性样本和阴性样本数量应分别满足统计学要求,可采用目标值法公式分别估算最低阳性和阴性样本例数。
样本量估算公式如下:
公式中,n为样本量;Z1-α/2、Z1-β为显著性水平和把握度的标准正态分布的分数位,P0为评价指标的临床可接受标准,PT为申报产品评价指标预期值。
其中阳性符合率和阴性符合率的临床可接受标准(P0)建议不低于85%。临床试验结果中,相关评价指标的95%置信区间下限应不低于预设的临床可接受标准。
1.2.6临床试验结果的统计分析
临床试验结果一般以四格表的形式进行总结,并据此计算试验体外诊断试剂与对比方法的阳性符合率、阴性符合率、总符合率及其95%置信区间。
临床试验建议对不同染色强度或不同评分的样本数量进行统计分析,产品临床试验入组样本应涵盖不同的染色强度或不同评分。
2.临床意义研究
该类产品临床意义包括伴随诊断和补充诊断两种。本文重点介绍伴随诊断临床意义的研究,该部分研究应满足《与抗肿瘤药物同步研发的原研伴随诊断试剂临床试验注册审查指导原则》和《抗肿瘤药物的非原研伴随诊断试剂临床试验注册审查指导原则》要求。原研伴随诊断试剂与非原研伴随诊断试剂临床意义的研究存在差异,以下进行分别介绍。关于补充诊断临床意义的研究建议参照伴随诊断试剂临床意义研究。
2.1原研伴随诊断试剂
原研伴随诊断试剂为参与药物临床试验的伴随诊断试剂,包括直接参与药物临床试验或与药物临床试验中所用CTA(Clinical Trial Assay,以下简称“CTA”)进行桥接试验。针对原研伴随诊断试剂,药物临床试验作为其伴随诊断临床意义的支持性证据,相关临床试验资料应满足《与抗肿瘤药物同步研发的原研伴随诊断试剂临床试验注册审查指导原则》要求。以下仅针对PD-L1检测试剂产品特点,对该类产品临床试验需特别关注的问题进行阐述。
2.1.1关于原研PD-L1检测试剂在药物临床试验中的伴随诊断作用,建议在药物临床试验方案及报告中明确,如作为受试者入选标准,或作为后续病例不同PD-L1表达状态的人群药效学分析。关于PD-L1检测,可根据药物临床试验方案的要求,使用前瞻性收集的样本或使用留存样本进行检测。
2.1.2 支持原研PD-L1检测试剂临床意义的药物临床试验应包括相关抗肿瘤药物疗效的全部关键性临床试验。如支持药物上市的临床试验为境内与境外开展的临床试验,则原研伴随诊断试剂的临床试验应包括境内与境外开展的临床试验,仅境内临床试验不足以支持产品上市。
2.1.3药物临床试验方案或报告中应明确伴随诊断试剂的基本信息及配套使用试剂、适用机型信息,根据方案或报告中提供的伴随诊断试剂信息应能够对应至申报的伴随诊断试剂。临床试验资料应明确申报产品在药物临床试验过程中的判读方法及阳性判断值,上述阳性判断值应与申报产品临床前研究及结果重现性研究所用阳性判断值一致。
2.2非原研伴随诊断试剂
针对非原研伴随诊断试剂,可采用桥接试验或已上市抗肿瘤药物疗效的观察性研究两种临床评价路径确认其伴随诊断临床意义。相关临床试验资料应满足《抗肿瘤药物的非原研伴随诊断试剂临床试验注册审查指导原则》要求。以下仅针对PD-L1检测试剂产品特点,对该类产品临床试验需特别关注的问题进行阐述。
2.2.1桥接试验
若采用桥接试验确认其伴随诊断临床意义,在研究过程中应严格控制偏倚,因该类产品临床试验所用样本为福尔马林固定石蜡包埋样本,临床试验中样本稳定性应满足试验体外诊断试剂要求,应尽量控制试验体外诊断试剂与原研伴随诊断试剂(如涉及)所用样本的差异,应不对临床试验产生显著影响。临床试验应严格按照申报产品及原研伴随诊断试剂(如涉及)说明书进行操作。如纳入了非药物临床试验的病例,则该部分病例的入组标准应与药物临床试验保持一致。申报产品的检测应满足盲法的原则。
2.2.2已上市抗肿瘤药物疗效的观察性研究
针对非原研PD-L1检测试剂,如无法通过桥接试验确认其伴随诊断临床意义,亦可在完成临床性能研究的基础上,在不少于3家临床试验机构进行已上市抗肿瘤药物疗效的观察性研究,证明其临床意义。该临床试验过程中申报产品的检测结果不能影响受试者正常的诊疗流程。
2.2.2.1入组人群
临床试验入组人群应为原研伴随诊断试剂适用人群,应明确病例的入选与排除标准,临床试验入组的人群应尽量接近申报产品临床应用真实情况。临床试验应注意入组病例的用药情况,如单药治疗或与化疗药物联合治疗等,临床试验中入组病例的用药情况应与原研伴随诊断试剂批准的用药情况保持一致。
2.2.2.2临床试验药效学评价
抗肿瘤药物疗效评价有多个评价指标,如客观缓解率(ORR)、无进展生存期(PFS)及总生存期(OS)等。临床试验应选择合理的评价指标,并提供充分的依据。抗肿瘤药物疗效评价指标的选择,可参考相关抗肿瘤药物临床试验主要评价指标。
2.2.2.3样本量估算
已上市抗肿瘤药物疗效的观察性研究临床评价目的包括申报产品与原研伴随诊断试剂筛选人群药效的等效或非劣效分析,基于此目的选择等效性或非劣效性研究模型进行样本量估算。针对不同的适应证,建议设置合理的界值。
2.2.2.4统计分析
临床试验的统计分析主要分为三个方面:病例人口学及临床特征基线分析、申报产品与原研伴随诊断试剂的一致性分析、药物疗效分析。药物疗效分析的结果应表明申报产品所选择人群与原研伴随诊断试剂选择的人群在药物疗效上不存在显著差异。
3.补充诊断产品相关考虑
产品预期用途为补充诊断的PD-L1检测试剂,其临床试验建议参考伴随诊断用途研究的临床试验设计。针对提交药物临床试验资料作为产品补充诊断临床意义的,应在药物临床试验报告或相关文件中针对不同PD-L1的人群进行药效学分层分析,分层分析的结果应支持产品补充诊断的临床意义。
4.接受境外临床试验的考虑
针对产品临床性能研究部分,基于境内外相关产品临床使用环境及人员的差异,不能接受境外临床试验数据。
针对伴随诊断试剂临床意义研究,如相关抗肿瘤药物接受境外临床试验数据,且有证据证明境外人群PD-L1表达及相关人群抗肿瘤药物疗效无显著差异的前提下,原研伴随诊断试剂及非原研伴随诊断试剂的伴随诊断临床意义研究可接受境外临床试验数据。
(五)产品说明书和标签样稿
产品说明书格式应满足《体外诊断试剂说明书编写指导原则》的要求。产品说明书的所有内容均应与注册申请人提交的注册申报资料的相关研究结果保持一致。如某些内容引用自参考文献,则应以规范格式对此内容进行标注,并单独列明参考文献的相关信息。
1.【预期用途】
应至少包括以下内容:
1.1试剂盒用于体外检测中性福尔马林固定石蜡包埋(FFPE)的xxxx组织中的PD-L1蛋白表达。辅助鉴别可使用xxx药物治疗的xxx患者,用作xxx药物的伴随诊断或补充诊断。
1.2PD-L1阳性表达判读规则(TPS、CPS等)。
1.3简单介绍PD-L1的生物学特征,如基本结构和信号转导途径。
1.4简单介绍PD-L1检测的临床用途和药物临床试验相关内容。
1.5明确说明对任何阳性或阴性结果的解读,应由病理科医生结合病理形态学、临床表现及其它检测方法进行,不作为单独的诊断指标。
2.【检测原理】
简述免疫组织化学的基本原理,并对申报试剂的抗原修复方法、第一抗体、放大系统、显色系统及结果观察等进行简要介绍。
3.【主要组成成分】
3.1说明试剂盒包含组分的名称、数量、比例或浓度等信息;质控片(如有)的组织名称。
3.2对检测中使用的抗体信息进行简单介绍,包括抗体的克隆性质(单克隆或多克隆)、抗体的类型(如IgG1)、抗体的种属性、克隆号、抗体制备形式(如细胞培养上清液)、免疫源。
3.3试剂盒中不包含但对该项检测必需的组份,企业应列出相关试剂的名称、货号及其他相关信息。
4.【储存条件及有效期】
对试剂的储存条件、有效期、开封稳定性、机载稳定性、运输稳定性(如适用)和冻融次数限制等信息做详细介绍。
5.【样本要求】
重点明确以下内容:
5.1应明确对适用样本的取材、固定、包埋的具体要求。
5.2明确样本的稳定性。
6.【检测方法】
详细说明操作的各个步骤:
6.1明确检测需要的仪器、设备。如预处理仪、染色仪等。注明注册证/备案证号及生产商。
6.2试剂配制方法、注意事项,试剂开封、配制后使用方法及注意事项等。
6.3手工操作应详述脱蜡和水化、组织抗原修复、第一抗体孵育、显色等各操作步骤。描述应尽量细化,需明确各步骤处理时间及pH值等内容。如第一抗体为浓缩型抗体,还需明确抗体工作液的浓度及稀释液的详细信息。
6.4质量控制:明确每一批次检测样本均应同时进行内、外阳性/阴性质控染色及待测样本的同型对照抗体的染色。质控应包含阳性、阴性不同PD-L1浓度水平的细胞系细胞或不同PD-L1表达水平(染色强度)的组织切片。为用户提供可作为阳性和阴性,内、外对照的组织名称。详述质控片制备的要求及质控结果的要求(试验有效性的判断),以及质控结果不符合要求的处理方式。
7.【检验结果的解释】
7.1配合彩色图片对染色特点进行说明。
7.2对可能出现的异常情况,如非特异染色、染色过浅等,进行说明,并明确提出出现该情况后的处理方法。
7.3评分方法
列明评分标准,包括对观察方法、读取细胞个数的要求、计数细胞性质(如肿瘤细胞、免疫细胞)、染色特点、评分规则等。
8.【检测方法的局限性】
综合产品的预期用途、临床背景、检测方法及适用范围等信息,对可能出现的局限性进行相关说明,主要包括以下描述,请申请人选择适用的条款在产品说明书中予以阐述。
8.1免疫组织化学检测是一种需通过多个检测步骤完成的诊断过程。在试剂的选择、取材、固定、处理、切片的制备和染色结果的解释上需要进行专门的培训。
8.2任何阳性或阴性结果的解读,应由病理科医生结合病理形态学、临床表现及其它检测方法进行,不作为单独的诊断指标。
8.3复染过度或不足都可能影响结果的判读。
8.4不恰当的染色前组织的处理过程直接影响染色效果,造成假阳性、抗体定位不准确或假阴性结果。结果不一致可能是由样本固定和包埋方法不同或组织样本内固有差异造成的。
8.5阴性结果表示未检出抗原,不一定表示样本中无该抗原存在。待测抗原编码基因变异、抗原低表达或抗原修复不当等,都会造成抗原无法检出。
8.6已知可能引起非特异性染色的情形。如感染乙型肝炎病毒并含有乙肝病毒表面抗原的人体组织,可能表现出辣根过氧化酶的非特异性染色;由于蛋白质或底物反应产物的非免疫结合等。
8.7本试剂仅对经10%中性缓冲福尔马林固定石蜡包埋的组织进行了验证(如适用),不得用于其它样本类型或流式细胞检测等其他用途。
9.【产品性能指标】
简述免疫反应性、精密度、特异性、灵敏度等各项性能指标和临床试验数据总结,列明研究方法和研究结果。
10.【注意事项】
应至少包括以下内容:
10.1 有关试剂盒内人源组份(如有)生物安全性的警告。
10.2 有关试验操作中涉及试剂的安全性提示,包括对有毒有害物质的防护及危险物品的处理方法等。
三、参考文献
1.实体肿瘤PD‐L1免疫组织化学检测 专家共识(2021版)中华病理学杂志 2021 年7 月第 50 卷第 7 期,p710-718
2.中国非小细胞肺癌免疫检查点抑制剂治疗 专家共识(2020年版)中国肺癌杂志2021年4月第24卷第4期,篇17-235
3.中华医学会肺癌临床诊疗指南(2023版)中华医学杂志 2023 年7 月18 日第 103 卷第 27 期 p2037-2074
4.《原发性肺癌诊疗指南 (2022 年版)》第2节 肺癌 (nhc.gov.cn)
5.《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家药品监督管理局公告2021年第122号)[Z].
6.定性检测体外诊断试剂分析性能评估注册审查指导原则(国家药品监督管理局医疗器械技术审评中心公告2022年9月28日)[Z]
7.《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号)[Z].
8.《体外诊断试剂分类规则》(国家药品监督管理局公告2021年第122号)[Z].