摘 要 / Abstract
随着现代生物技术的快速发展及其在制药领域的应用,生物制品在药物研发中的地位日益突显。目前,为满足更多的临床需求,除传统的生物制品外,应用新技术的生物制品也在开发和探索阶段。本文综述了生物制品的发展现状,并以抗体类药物、疫苗类产品、血液制品及细胞和基因治疗产品为例,结合我国监管科学的发展,概述了相关类别生物制品的国内外研发现状及发展趋势,并对开发相关产品的优势和挑战进行了剖析。
With the rapid development of modern biotechnology and its increasing application in the pharmaceutical field, the significance of biologics in drug research and development has become more pronounced. At present, in order to meet expanding clinical demands, there is ongoing development and exploration of biologics using new technologies, in addition to traditional biologics. This paper provides an overview of the development status of biologics, focusing on categories such as antibody drugs, vaccine products, blood products, cell and gene therapy products. It combines the progress in regulatory science in China, summarizing the research and development status and trends of related biologics at home and abroad was summarized. The paper also analyzes the advantages and challenges of developing these products.
关 键 词 / Key words
生物制品; 研发现状; 发展趋势;抗体类药物;疫苗
biologics; research and development; status and trend; antibody agents; vaccine
1、生物制品发展现状
(一)全球生物制品市场发展规模
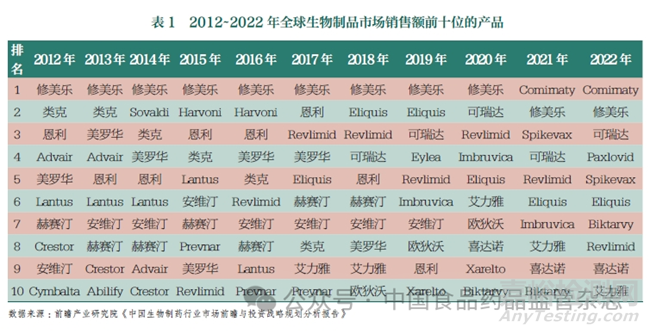
随着生物制药技术尤其是重组技术等新技术的发展,生物制品的市场规模在全球范围内均呈现持续增长的趋势。据统计,2022 年全球医药产品市场规模超过1.4 万亿美元,其中生物制品产业占比逐年增长,从2016年的2202 亿美元上升至2022年的3654 亿美元,在全球医药市场的占比超过20%,复合年增长率达7.3%。据相关医药数据平台整理的2021 年全球药品销售情况, 在排名前100 位的药品中生物制品占55 个,销售额占比高达64%。本文列举了2012~2022 年全球生物制品市场销售额前十位的产品,见表1。
(二)我国生物制品发展现状
1. 国家大力支持鼓励生物制药发展
近年来,我国高度重视生物医药的发展,制定并出台了多项政策予以扶持。2021 年12 月工业和信息化部等九部门联合印发的《“十四五”医药工业发展规划》提出,要重点提升新型生物药生产技术、提高疫苗应急研发生产能力。2022 年5 月,国家发展改革委印发我国首部生物经济五年规划《“十四五”生物经济发展规划》,确立了到2025 年生物经济规模总量迈上新台阶的发展目标。2022 年10 月,党的二十大报告提出了推进健康中国建设,深化医药卫生体制改革的要求。2023年《政府工作报告》中再次提出,要推进疫苗迭代升级和新药研制。各相关部门结合自身职能,制定了鼓励生物制品产业发展的具体政策和措施。在多项利好政策的助力下,我国生物制品发展规模快速增长,2022 年我国生物制品市场规模已经达到4493 亿元,中商产业研究院预计到2023 年将达到5347 亿元。
2015 年《国务院关于改革药品医疗器械审评审批制度的意见》发布,其鼓励药品研发创新,促进药品高质量发展。自2015 年以来药品审评审批制度具体改革措施包括:完善药品注册法规,推进《疫苗管理法》出台及《药品管理法》制修订;优化注册审批流程,完善《药品注册管理办法》及配套文件,建立突破性治疗、优先审评审批程序、附条件批准程序、特别审批程序等加快药品上市的制度;加强全过程沟通交流,建立多维度沟通交流机制;加强受理、审评、核查、检验等各环节协调,提高审评质量和效率;推进监管科学研究,包括针对新的研发生态转化为“新工具、新标准、新方法”等,颁布通用型技术指南和个药技术指南数百份;促进境内外产品同步研发和申报,推动监管标准与国际接轨。
2. 生物制品研发申报情况
根据近3 年国家药品监督管理局药品审评中心公开的审评报告,2019~2021 年我国生物制品申请受理量呈上升趋势,年均增长约26% ;2021 年需技术审评的生物制品受理量约为2019年的2 倍;生物制品建议批准量每年呈上升趋势,年均增长约29% ;2021 年的建议批准量约为2019 年的2.16 倍。根据《药品附条件批准上市申请审评审批工作程序(试行)》,截至2022年9 月30 日,已附条件批准68个品种,其中生物制品附条件批准25 个品种,涉及38 个适应症。本文汇总了2022 年我国批准的生物制品创新药,见表2。
2、生物制品的研发情况
近年来,随着生物制品技术不断升级,以抗体类药物、核酸药物、细胞和基因治疗产品为代表的新一代生物技术产品逐步成熟。据统计, 目前全球有超过1000 个新的生物制品在开展临床研究,适应症主要集中在肿瘤、免疫、感染、心血管等疾病领域。
(一)抗体类药物
抗体类药物是目前全球生物制品市场中规模最大的类别,因其能够特异性结合相关抗原,靶向性强、临床疗效确切、不良反应小,因此发展十分迅速。抗体类药物通常分为单克隆抗体(单抗)、双特异性抗体(双抗)、基因工程抗体片段[ 如纳米抗体、单链可变区片段(single-chain variable fragment,scFvs)等]。此外,有的抗体还可与小分子偶联,制备成兼具靶向性和细胞毒性的抗体偶联药物(antibody drug conjugate,ADC), 抗体按照人源化程度的不同,又可分为鼠源性单克隆抗体、嵌合性单克隆抗体、人源化单克隆抗体和全人源单克隆抗体。随着近年来抗体药物制备技术的迅速发展,单抗、双抗、ADC 等技术的突破为抗体药物开拓了更宽广的发展空间。
据《2024-2029 年中国生物制药产业前景预测及投资研究报告》,在近8 年间,全球抗体药物市场均保持着10% 以上的增速,并在2021 年首次突破2000 亿美元, 与2020 年相比增长16.5%, 其中有23 个品种销售额超30 亿美元。自1986 年首个治疗性抗体莫罗单抗CD3(muromonab-CD3)被批准上市以来[1],美国食品药品监督管理局(Food and Drug Administration,FDA) 累计批准了121 个抗体药物,包括12 个ADC 药物、4 个双抗药物和105个单抗药物,主要集中在肿瘤和自身免疫疾病领域,并延伸至神经系统、眼科、心血管疾病等领域。
1. 单克隆抗体药物的发展态势
我国抗体产业起步较晚,但自1999 年我国首个单抗药物注射用抗人T 细胞CD3 鼠单抗获批上市[2],距今已发展20 多年,目前已进入快速发展的成长期。
随着抗体药物临床研究不断推进、产品商业化策略不断完善,截至目前,我国已批准上市60 个国产抗体药物(其中25 个创新药),58 个进口抗体药物。随着众多单抗生物类似药的上市,生物类似药市场将迎来爆发式增长。
2. 双特异性抗体药物的发展态势
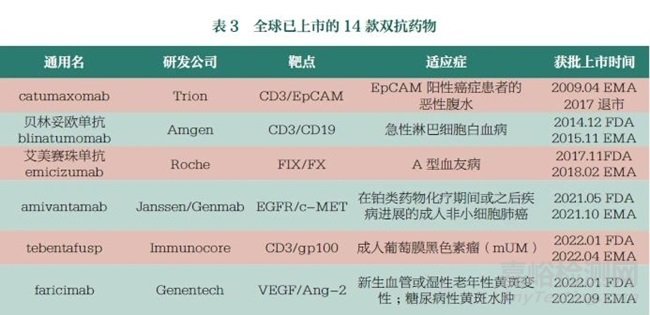
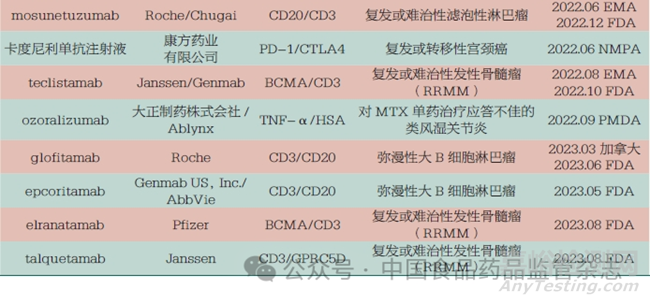
2022 年,全球双抗药物的获批数量显著增长,共有6 款双抗药物获批上市;截至2023 年9 月,共计14 款双特异性抗体药物获批上市,其中包含1 款国产双抗,即康方药业有限公司的卡度尼利单抗注射液(商品名:开坦尼),见表3。经过60 多年的发展,双特异性抗体具备了一定的市场规模,近几年双抗药物已成为国内外制药企业的重要研发管线,热度持续攀升。
目前,全球有超过10 款双抗药物处于上市申请及Ⅲ期临床试验阶段,我国至少有3 款双抗产品处于Ⅲ期临床试验阶段。此外,三抗、四抗药物的研发也已在路上,参与研发的公司包括境外的赛诺菲、强生、Harpoon 等,以及我国的浙江道尔生物科技有限公司、嘉和生物药业有限公司等多家制药企业,四川百利药业集团甚至已经开展五抗药物的研发。
3. ADC 的发展态势
据Grand View 研究机构的数据,2015~2020 年全球ADC市场规模的年复合增长率为32.9%,2021~2025 年的年复合增长率将达到53.0%。随着ADC 技术的变革,抗体精准靶向,连接子(linker)定点偶联技术进一步优化,未来该类产品的渗透率将进一步增加,市场规模还会持续增长,2020 年ADC 产品全球市场规模约25 亿美元,2025年预计将增至211 亿美元。
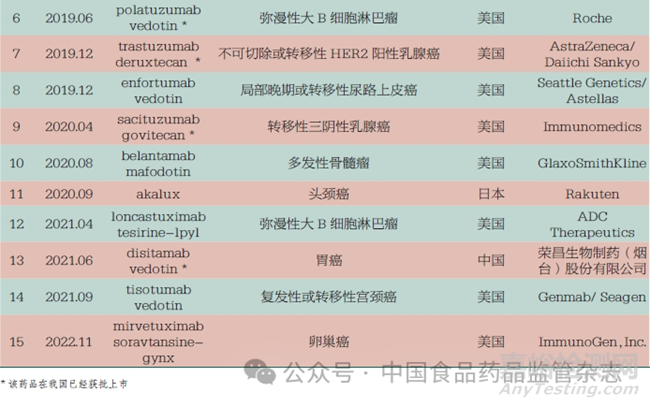
截至2022 年底,全球已有15 款ADC 获批上市,治疗领域集中在实体瘤和血液瘤,如乳腺癌、宫颈癌、弥漫性大B 细胞淋巴瘤。2020 年至今,我国共计7款ADC 获批上市,其中荣昌生物制药(烟台)股份有限公司的注射用维迪西妥单抗( 商品名: 爱地希) 是我国自主研发的一款靶向HER2 的抗体偶联药物,见表4。
4. 抗体类药物靶点分布
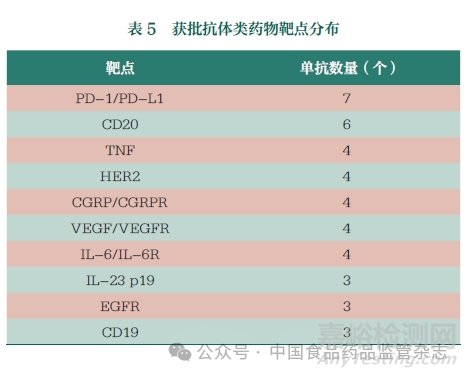
截至2022 年6 月30 日,全球已批准和上市的抗体药物共162 种,使用抗体疗法的优势源于其高选择性和优秀的抗原结合亲和力[2]。相比于其他疾病的治疗靶点,癌症和免疫相关疾病的治疗靶点, 如PD-1/PD-L1、CD20、肿瘤坏死因子(TNF)-α、HER2 和CD3 等将更多地被投入研究[3]。目前,已批准的抗体疗法主要是为治疗癌症和免疫相关疾病适应症而开发。本文列举了已经获批抗体类药物的主要靶点分布情况,见表5。
目前,我国抗体药物研发也主要集中在抗肿瘤和免疫调节两个领域, 抗体药物研究的热门靶点主要包括PD-1/PD -L1、TNF-α、血管内皮生长因子(VEGF)、HER2、CD20 和表皮生长因子受体(EGFR) 等,均已有多家药品企业的相关抗体药物上市或处于上市审批中,我国已逐渐成为抗体药物在研数量最多的国家和地区之一。
5. 抗体类药物的未来研发方向
虽然在国家政策的支持下,我国治疗性抗体药物产业迅猛发展,抗体药物品种和市场规模持续增长,但是抗体药物的研发依然存在着研究扎堆、创新不足等问题[4]。因此,建议我国治疗性抗体药物企业,首先应着眼于对疾病的发病机制和抗体作用机制的深入了解,从而选择合适的药物靶点,研制具有自主知识产权的创新型抗体药物。其次,抗体药物的免疫原性与临床疗效密切相关。免疫原性较强的抗体药物,尤其是采用动物来源制备的抗体药物(如早期采用鼠腹水制备的等)容易引起严重的不良反应,包括过敏性反应、输液反应、内源性免疫球蛋白交叉反应、药物不良事件和药动学改变等[5]。因此,完善抗体技术,提高基因工程来源的抗体药物比例是较为有效的解决方案,通过规范流程,可使药物的生产易于标准化、规模化。对于基因工程抗体药物,也需在开发过程中考虑对目的序列、生产工艺进行优化,明确序列选择及工艺等对产品质量产生的影响,合理控制可能导致免疫原性的关键质量属性,以提高工艺的批间一致性。
抗体药物的稳定性和溶解度,同样也是抗体药物研发的方向。高浓度剂型可以减少给药频率、延长药物作用时间、降低患者用药负担,但开发高浓度剂型需要解决抗体药物的稳定性和溶解度等问题。例如诺华公司研发的靶向VEGF 的人源化单链抗体片段brolucizumab, 其通过阻止VEGF 与VEGFR 的结合,抑制眼底血管生成,能够用于治疗年龄相关性黄斑变性(age-related macular degeneration ,AMD)。得益于brolucizumab高达120mg/ml 的溶解度,其治疗摩尔剂量约为同类产品的22倍,减少药物眼内注射频率,提高了患者的依从性[6]。
多特异性抗体,由于其能够覆盖更多的抗原表位,从而避免位点突变逃逸,以减少不良反应,具有更为广阔的前景[7]。但多特异性抗体可能由于具有非天然结构,导致其稳定性降低。此外,由于多个位点引入,可能导致分子量较大,因此对实体瘤的治疗效果可能产生影响,需要在给药途径、给药方案或制剂处方等方面针对上述挑战做出更多探索性和确证性研究。
(二)疫苗
1. 国外疫苗市场和研发情况
据Evaluate Pharma 的分析,国际疫苗市场上GSK、默沙东、辉瑞和赛诺菲4 家企业凭借产品优势占据了疫苗市场90% 的份额。从2021 年的销售额来看,除新冠疫苗外,销售前三位的为默沙东的人乳头瘤病毒(HPV)疫苗,辉瑞的13 价肺炎球菌多糖结合疫苗以及赛诺菲巴斯德的流感疫苗。
截至2022 年12 月底, 全球正在研发的候选疫苗达966种, 主要集中在美国、中国和西欧。研发品种集中在:新冠病毒(246 种,25%);流感病毒(104 种,11%);艾滋病病毒( 84种,9%)。另外,猴痘疫苗、呼吸道合胞病毒(RSV)疫苗、埃博拉疫苗、肺炎疫苗、带状疱疹疫苗等也是研究比较集中的几类疫苗。从技术路线看,欧盟和美国以核酸疫苗和病毒载体疫苗为主;我国以灭活疫苗较多,核酸疫苗和病毒载体疫苗相对较少;以mRNA 疫苗为代表的第三代核酸疫苗新技术的成功应用及产业化成为疫苗研发史上的里程碑事件[8]。
2. 我国疫苗市场和研发情况
近年来疫苗在我国医药市场的占比呈稳步上升趋势,尤其是在新冠疫情的暴发、疫苗技术创新的推动下,据《中国疫苗行业市场前景及投资机会研究报告》,我国疫苗市场由2016 年的240亿元增加至2021 年的760 亿元(新冠疫苗除外)。随着高附加值的疫苗国产大品种包括13 价肺炎球菌多糖结合疫苗、HPV 疫苗等的逐步上市以及在公众疫苗接种意识提高、国家免疫规划扩大等因素的驱动下,未来我国疫苗产业规模还将持续增加,疫苗研发更多地转向成人疫苗。
政策利好释放, 创新疫苗申报量及批准量不断加大。2020~2022 年,国家药监局批准疫苗产品上市(以药品批准文号计)数目为7~15 个。2023 年仅1~9 月就批准上市疫苗13 个。另外,值得关注的是,2021~2023年9 月,国家药监局共批准74个产品的临床试验申请(含不同规格),其中九价肠外致病性大肠埃希菌疫苗、MVA-BN-RSV疫苗、重组RSV 疫苗(AS01E佐剂系统)、二价肠道病毒灭活疫苗(Vero 细胞)、冻干人用CpG佐剂狂犬病疫苗(Vero 细胞)等均是采用全新技术的创新疫苗。
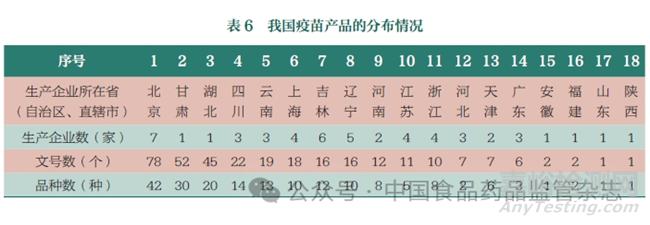
从疫苗产品的地域分布情况来看,疫苗生产主要涉及18个省(自治区、直辖市),其中有52 家生产企业投入疫苗的生产,北京、吉林、辽宁生产企业数量最多,分别为7 家、6 家、5家;北京、甘肃、湖北的生产企业生产疫苗品种数较多,见表6。
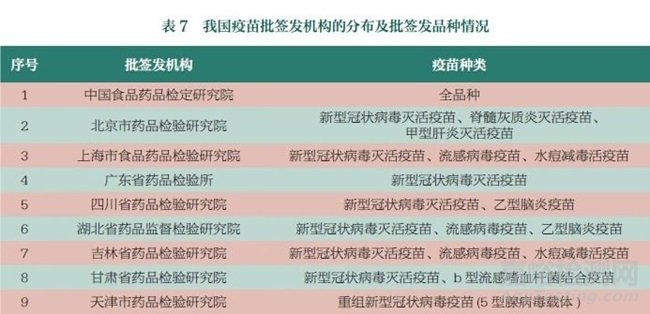
2018~2022 年我国疫苗批签发品种和数量均保持稳中有升态势,批签发数量在5000~6300 批、5.37 亿剂~6.35 亿剂。2022 年,各级机构共计批签发57 个疫苗品种。随着投入疫苗生产的企业增加,疫苗批签发机构授权范围也逐步扩大,目前已授权中国食品药品检定研究院和北京、上海、四川等18 家省级检验机构承担指定品种的疫苗批签发工作,见表7。
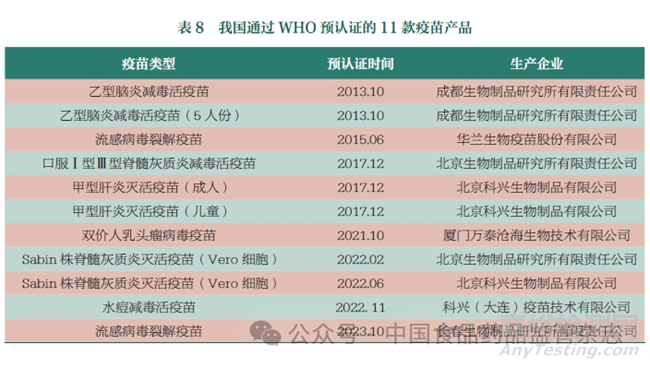
2022 年8 月23 日, 世界卫生组织(World Health Organization,WHO) 宣布我国再次通过疫苗国家监管体系(National Regulatory Authority,NRA)评估。这彰显了我国疫苗监管体系已经能够对标国际前沿标准,疫苗产品的安全性、有效性得到保障且质量可控,为我国疫苗产品出口奠定了基础。从2013 年开始,我国共计7 家企业11 款产品通过WHO的疫苗预认证(表8),标志着我国疫苗产品的监管、研制和生产体系以及产品质量获得了国际认可,极大地推动了我国疫苗企业国际化进程。
3. 新冠疫情与新冠疫苗对传统疫苗的影响和改变
根据WHO 公布的数据,截至2023 年3 月,全球在研的新冠疫苗共计382 个, 其中183个进入临床研究,53 个被批准上市或紧急使用;疫苗类型包括mRNA 疫苗、灭活疫苗、腺病毒载体疫苗和重组亚单位疫苗等。全球针对一种病原体、由多个国家和地区第一时间启动多条技术路线开展疫苗研发尚属历史首次。
在新冠疫情的影响下,我国疫苗研发格局发生了巨大变化。首先,从技术层面来看,我国疫苗研发已呈现由跟随性向原创性转变,传统灭活疫苗技术处于国际领先水平,重组蛋白和病毒载体疫苗领域实现了与国际并跑,mRNA 技术、新型佐剂疫苗等虽与国际水平还存在一定差距,但已初步具备产业化能力。其次,从疫苗产业层面来看,我国疫苗产业效率、产能、配套均得到全方位提升;多家传统生物制品企业及新创企业进入疫苗领域;疫苗企业生产趋向大规模、高质量,且产能大幅提高;疫苗产业配套政策等得到全方位提升,原辅料及设备国产化提速,批签发及冷链能力建设提升。第三,我国疫苗的国际化整体进程加快,相关企业积极参与到全球突发公共卫生事件防控及市场竞争中。3 家企业的疫苗被纳入WHO 应急使用清单。截至2022 年5 月,我国累计向153 个国家和地区以及15 个国际组织提供了22 亿剂新冠疫苗[9] ;通过在境外建设疫苗工厂,推动了我国疫苗企业走向国际化;通过在境外开展临床试验,推动了我国疫苗评价标准与国际标准的融合。
在保障企业快速发展成长的过程中,国家药品监管部门坚持以推动疫苗的快速研发为导向,建立了科学高效的监管科学体系,有力助推了新冠疫苗的快速研发,监管能力和水平得到有力提升并经受了实践考验。我国自2005年出台《国家食品药品监督管理局药品特别审批程序》以来,在甲型流感疫苗、脊髓灰质炎灭活疫苗中多次启动,在应对全球流感大流行、全球消灭脊髓灰质炎行动( global polio eradication initiative,GPEI) 等突发公共卫生事件中发挥了重要作用,相关经验还纳入到了《疫苗管理法》框架中。此次,针对新冠疫情等全球应急状态下疫苗及治疗用生物制品的研发,我国按照统一指挥、早期介入、快速高效、科学审批的原则,对突发公共卫生事件应急处理所需药品进行特别审批。技术标准先行,检验、核查、审评并行,申报资料滚动提交,临床试验无缝设计,接受境外数据,实现远程核查,采用附条件批准上市,并将加快程序运行至包括上市后变更的全生命周期监管中,以满足短期内公众的接种需求。
4. 未来疫苗的发展方向
目前,病毒载体技术、新型佐剂、mRNA 技术、反向遗传学等疫苗新技术的应用已拓展至许多大品种,包括RSV 疫苗、登革热疫苗,尚未攻克的艾滋病(HIV)疫苗、巨细胞病毒疫苗、诺如病毒疫苗,以及许多治疗性疫苗和肿瘤疫苗等。
经历多次疫苗技术革命,我国疫苗产业的未来发展将更聚焦临床急需,加强疫苗开发的规范化、创新化、规模化、集约化和国际化,具体表现为:①我国将加速联合疫苗的研发上市,包括境外已上市的以百白破三联疫苗(DTaP)、麻腮风三联疫苗(MMR)等为基础的联合疫苗, 及其他可能提高临床适用性、依从性的新型联合疫苗的研发,鼓励倡导研制及使用多联疫苗产品。②对标国际先进技术和标准,加快疫苗已上市产品的升级换代,例如多糖蛋白结合疫苗、病毒样颗粒疫苗等,进一步提升疫苗的安全性和有效性。③结合我国传染病特点,布局创新疫苗品种及技术路线,并进行国内传染病、医院感染及耐药菌疫苗等研发;根据WHO 等机构对广谱疫苗的定义更新及人工智能(AI)技术的发展,加强通用疫苗靶抗原筛选和广谱疫苗的开发。④布局更多的技术路线,推动新型蛋白疫苗、载体疫苗、新佐剂疫苗、核酸疫苗等技术路线的研发,推动新的制剂技术、递呈系统、纳米材料、给药装置的平台、AI 药物设计等技术发展;加强平台技术发展及模型株疫苗开发,实现新发突发传染病平台开发及储备;加强黏膜免疫疫苗及新型给药途径疫苗的开发。⑤以境外进入临床研究或已上市的治疗性疫苗为参考,重点关注肿瘤疫苗、慢性病疫苗、过敏性疾病疫苗等研发。
(三)血液制品
1.国内外血液制品市场情况
目前,全球已上市的血液制品有36 种,主要以免疫球蛋白和凝血因子类产品为主。免疫球蛋白、凝血因子和白蛋白约占70%的市场份额,其中免疫球蛋白(含特异性免疫球蛋白)约占50%的市场份额。据《2022-2027年免疫球蛋白行业市场深度分析及发展规划咨询综合研究报告》,2022 年全球静脉注射用人免疫球蛋白市场规模达1107.65 亿元(人民币),我国静脉注射用人免疫球蛋白市场在全球市场约占14.54%。
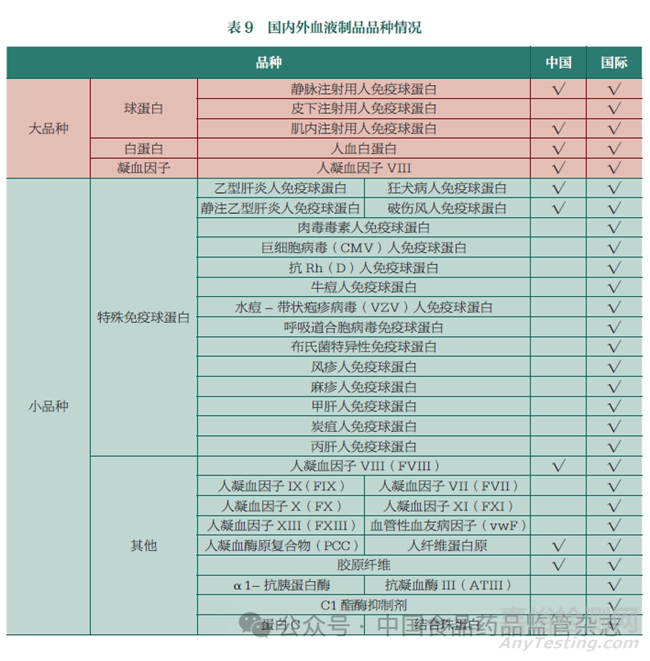
目前,我国批准上市的血液制品共有16 种,市场上以人血白蛋白和静脉注射用人免疫球蛋白为主,人血白蛋白市场份额占据市场总份额约60% 以上,其中进口白蛋白占市场供应量的60%。目前,市场对于血源制品仍然存在较大需求,但血液资源利用率低。本文总结了国内外血液制品品种的情况(表9)。
2. 我国血液制品生产情况
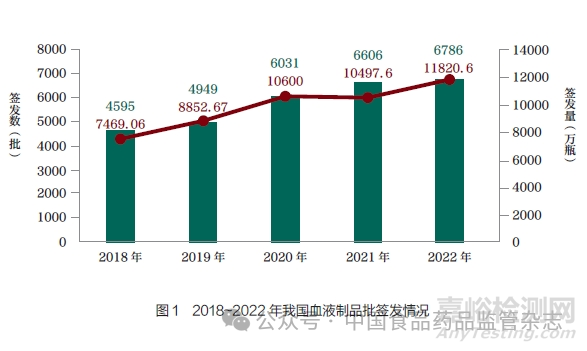
自2007 年6 月1 日起, 我国开始对人免疫球蛋白产品实施批签发, 至2008 年1 月1 日,所有上市销售的血液制品均实施批签发。近5 年,每年申请批签发种类大概有12~15 种,血液制品批签发数量也逐年增加,如图1所示。
根据国家药监局授权, 中国食品药品检定研究院和9 个省(自治区、直辖市)的药品检验机构承担指定区域内企业生产的血液制品批签发工作。目前,我国共有26 家血液制品生产企业, 生产文号达到204 个, 见表10。
3. 我国血液制品未来发展趋势
随着我国医疗水平的不断提升,对血液制品临床应用认识的持续提高,以及我国医疗保障系统不断完善,血液制品消费结构将得到优化,其中白蛋白占比将继续下降,静脉注射用人丙免疫球蛋白及特异性免疫球蛋白等产品的投入产出比将得到提升。蛋白质分离纯化、病毒去除/ 灭活工艺、基因工程等技术研发的强化和血浆综合利用的提高将成为未来技术发展的趋势。我国重组血液制品仅有注射用重组人凝血因子Ⅷ于2023 年9 月获批上市,目前尚多依赖于国外进口,具有广阔的研发前景。
(四)细胞和基因治疗产品
1.细胞和基因治疗产品的国内外市场情况
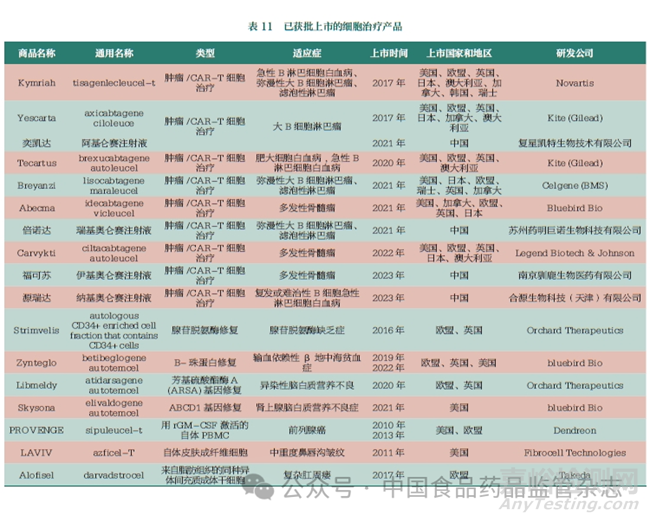
细胞和基因治疗(cellular and gene therapy, CGT) 是指将确定的遗传物质转移至患者的特定靶细胞内,通过基因添加、基因修正、基因沉默等方式修饰个体基因的表达或修复异常基因,以达到治愈疾病目的的过程[10]。其优势表现为:①个体化治疗优势。相比传统生物制品,CGT 产品可实现个体化治疗,可基于患者个体和病因差异进行个体化设计。②疗效持久。细胞产品在人体内可具有一定的扩增和存续时间,基因治疗可针对致病机制实现长时间或永久的基因替代、补偿、阻断和修正疗效。③可实现遗传病的治愈。CGT 可在基因水平实现遗传病的治愈,尤其是单基因遗传病的治愈的可能。④不良反应较少。与手术及放疗、化疗方法相比,部分CGT 产品的治疗周期较短,不良反应类型少,程度相对较轻。全球已经批准30 余款CGT 产品,主要集中在美国和欧洲等国家和地区。据pharmaprojects 数据库,目前,有近4000 种CGT 产品处于临床前至上市申请阶段,其中54%的产品为基因治疗产品,22% 的产品为非基因修饰的细胞治疗产品。在基因治疗产品中,体内基因的治疗产品占30%。而在体外基因治疗中,CAR-T 治疗产品占据主导地位,约为46%,其中95% 的CAR-T 细胞药物的适应症为肿瘤,其他适应症还包括硬皮病、艾滋病以及自身免疫性疾病等。本文汇总了当前国内外已获批上市的细胞治疗产品,见表11。
随着我国细胞治疗产业政策支持的不断加强,陆续发布了各类细胞治疗相关的政策法规、技术规范和指导原则,细胞治疗领域迅速发展。对于免疫细胞治疗的发展,从早期以自然杀伤细胞(natural killer cell,NK) [11]、树突状细胞(dendritic cell,DC)等研究为主,到CAR-T 细胞疗法[12] 成为当前的研究热点,全球已批准15 种免疫细胞产品上市,其中10 个为CAR-T 产品, 我国已批准上市4 个。
随着人们在细胞领域的不断探索与发现,干细胞疗法逐渐成为再生医学以及慢性病的新疗法之一。根据市场研究组织Fact.MR 的预测, 到2023 年, 全球干细胞治疗市场将达到389.1亿美元, 并呈现逐年增长的趋势。据ClinicalTrials 统计, 截至2023 年10 月,全球共开展了7805 项干细胞临床研究,涉及200 多种适应症。目前,国际上已批准21 个干细胞产品上市,主要用于治疗骨损伤、心肌梗死等;我国已批准23 个干细胞产品进入临床试验,但尚无产品获批上市。
2. 细胞和基因治疗的研究方向及面临的挑战
CGT 已成为全球生物技术领域最受关注的新兴领域之一,在市场、政策等因素的驱动下,我国CGT 产业发展势头迅猛,市场规模呈指数级的增长。然而,与传统生物制品相比,CGT 产品,尤其是细胞治疗产品在产品生产和临床使用方面仍面临较多新的挑战,包括:①部分细胞治疗产品个体化差异明显,细胞来源和产量较为有限,对生产和质量控制要求较高。②部分细胞治疗产品为新鲜细胞制剂,产品效期较短,对产品质控、保存、运输和临床使用要求较高。③细胞治疗产品作用机制复杂,体外生物学活性与临床疗效的相关性较差,无法良好预测产品的临床疗效。④ CGT 产品相关的不良反应,如细胞因子风暴、神经毒性、基因脱靶风险等仍需要进一步通过产品设计和临床应用降低风险。⑤各类CGT 产品的体内存续或疗效持续时间差异较大,各类疾病的复发风险仍有待进一步考察。⑥患者身体条件、疾病进展等原因,可能无法满足个体化细胞治疗产品的生产和使用条件等。从产能提升和患者可及性的角度考虑,着眼于研发通用型细胞疗法,解决生产耗时过长、工艺难以规范、产能难以提高及生产成本昂贵等问题,是未来提高细胞疗法的可及性的重要发展方向。
CGT 产品在分析方法和质量控制策略方面也面临较多挑战。例如,来源和产量较为有限的细胞治疗产品和产量较为有限的罕见病基因治疗产品等,其产量可能无法满足或支持传统的质控策略和分析方法。另外,部分与临床安全性和有效性直接相关的质量属性尚未完全确定;产品质量表征和控制的方法有限,缺少新的分析技术等。针对以上问题,未来可能需要相关研究人员制定和发布更具有适用性的、具体的、标准化的分析方法技术要求和指南。
此外,对于一些个体化产品,考虑到其本身的特殊性,需要对每批次细胞治疗产品的质量属性与临床疗效进行相关性分析。基于有限研究结果分析,笔者认为此类产品的临床疗效除了与产品的生产工艺相关外,一定程度上还取决于患者自身的细胞状态。因此,个体化产品的质量控制策略的制定一直以来也是该类产品研发过程中所面临的挑战。
3、结 语
生物医药是面向21 世纪的高技术产业,也是我国的战略性新兴产业。生物制品主要包括疫苗、血液制品、治疗用重组蛋白、基因和细胞治疗产品等,在疾病的预防和治疗中发挥着越来越重要的作用。疫苗的接种被认为是防控传染病最经济且有效的手段,为维护公众健康和国家安全发挥了关键作用。随着重组DNA 等技术的进步,各种治疗用重组蛋白不断涌现,在许多重大疾病的治疗中发挥了不可替代的作用,单抗类药物异军突起,作为一种具有独特优势的生物靶向治疗药物,以其高特异性、有效性和安全性的特点,已成为近年来全球药物研发的热点。以基因治疗、基因编辑、溶瘤病毒、干细胞和CAR-T 疗法为代表的创新技术和产品不断取得革命性的突破,为生物医药产业的发展带来了新的增长点,也对药品监管科学的发展提出了更高的要求。
我国生物制品产业在国家政策的支持下取得了长足发展,目前正处于创新产品开发和产业高速发展的重要战略机遇期。在相关政策和科技专项的支持下,生物制品研发关键环节的总体能力显著提升、产业化链条不断完善,在新药创制基础条件及品种产出方面均取得了显著的进步,目前已有相当数量的创新药进入临床研究阶段,一批创新药品获准上市,众多国产新药开始走向国际市场。可以预测,在“十四五”期间我国仍将有多种生物制品获批上市,可进一步提升公众对高质量生物制品的用药可及性。未来我国生物制品的发展仍将以满足临床需求为导向,聚焦重大疾病,推动原始创新,进一步突破和提升生物制品研发和产业化全链条关键技术,保障生物制品的安全性、有效性和质量可控性,推动生物制品产业成为有影响力的战略新兴产业和支柱产业,推动我国由制药大国向制药强国转变。
引用本文
李敏,郭志鑫,付志浩,张辉*.生物制品的研发现状和发展趋势[J].中国食品药品监管,2023(12):18-33.