近日FDA官网显示,奥林巴斯已经对UHI-4高流速气腹机发起一级召回。
该产品用于腹腔镜检查或腹腔镜手术中,向腹腔注入二氧化碳气体。FDA官网显示产品召回原因是,有报告称患有心率失常的患者在使用UHI-4的外科手术中出现了短暂的心脏骤停,可能是由于使用 UHI-4 导致腹腔过度充气造成。
奥林巴斯发言人在一份电子邮件声明中表示,召回和纠正措施是FDA在对涉及严重患者受伤和一人死亡的不良事件投诉进行全面评估后采取的。
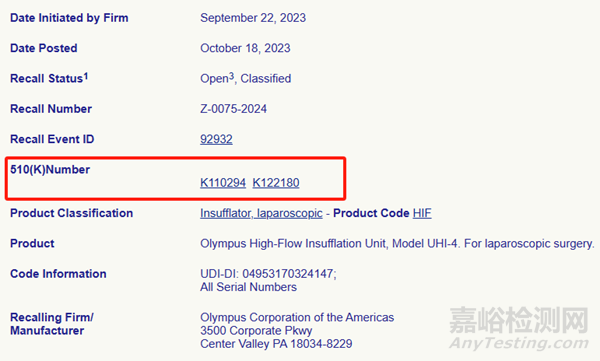
根据FDA的数据库,奥林巴斯于9月22日启动召回,共涉及在美国的3136台产品。
1、涉及3136台产品
医用气腹机的主要功能是通过对腹腔内加压注气抬高前腹壁,从而为手术治疗提供足够的操作和视野空间,是临床腹腔镜手术中必备的辅助设备之一。
公司官网介绍,UHI-4主要有四大优势,具有45L/min的最大流量,提供市场上最高的吹气速率;自动和可调设置, 允许自动排烟和高速吹气,可调整为高、低或关闭设置;具有适用于内镜下血管采集的小腔模式;带切换阀的新型气缸软管,让医生可以自由切换 CO2 罐,而不会中断手术。
此次UHI-4在美国召回涉及的产品编号如下:
奥林巴斯建议客户仔细阅读纠错信函,并向公司报告投诉,包括使用UHI-4进行手术过程中过度吹气造成的伤害。
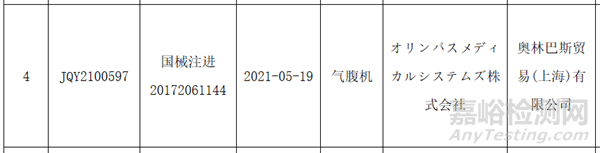
据查证,UHI-4在中国也有销售,于2021年5月在国内获批,是市面上常见的气腹机型号之一。
2、FDA发出警告信
今年3月,奥林巴斯及其子公司Aizu Olympus还收到了FDA的警告信。信中说明,其位于日本福岛会津若松的制造工厂违反了《食品、药品和化妆品法案》(<The Food, Drug and Cosmetic Act>,FD&C Act)。
涉及产品包括用于十二指肠镜的一次性远端盖和用于支气管镜的一次性吸入阀配件。
FDA透露,其对该设施的检查显示,用于设备制造,包装,储存或安装的方法或用于设备的设施或控制不符合联邦法规(CFR)第21篇第820部分中质量体系法规的当前良好生产规范要求。
接获160起投诉
信中写道:自2020年11月以来,奥林巴斯已收到大约160起投诉,称型号为MAJ-2315的远端盖发生脱落。但公司获知投诉量过高后并没有启动纠正和预防措施。
此外,政府注意到在2023年10月13号至23号期间生产的MAJ-2315远端盖包装密封处有皱纹,可能导致无菌包装被破坏。但奥林巴斯对此采用了可用于所谓的“低风险不合格品”的产量控制,而不是采用不合格品程序。
在对MAJ-2315远端盖脱落进行健康危害分析(HHA)后,奥林巴斯得出结论,除了监测患者远端帽脱落的投诉外,不需要采取其他行动。政府在警告信中表示,它不同意这一评估,该HHA没有考虑与远端帽脱落相关的多种风险。
患者受伤投诉,调查延迟两年
警告信称:奥林巴斯进行的HHA没有讨论为何在手术过程中由于远端盖脱落,导致接触未覆盖的内窥镜不会增加患者的风险。
该HHA没有考虑使用未覆盖的内窥镜尖端导航胃肠道导致的组织损伤风险。此外,奥林巴斯的文件得出结论,如果用户正确应用了远端帽,远端帽不太可能脱落。
FDA的警告信还强调了2020年的一项投诉,其中一名患者遭受食道创伤,组织卡在设备的远端尖端。客户将这些事件归因于远端盖破裂,并注意到从包装中取出时已经有一些破裂。该公司的投诉处理程序要求在 30 天内对投诉进行调查,但是,直到2022年,即投诉提出两年后,才对此投诉进行了调查。
3、标杆内镜新品,美中接连获批
尽管面临产品召回,近期奥林巴斯也有好消息传出。
2023年10月19日,奥林巴斯宣布向市场推出其下一代 EVIS X1内窥镜系统。EVIS X1主机CV-1500于今年8月获得NMPA批准,5月2日获得美国FDA批准。
据悉,EVIS X1系统具有扩展景深技术、红色双色成像及纹理色彩增强成像等技术,相比上一代产品,可展现更加清晰的组织纹理和色彩,是奥林巴斯的标杆产品。