抗体药物偶联物(antibody-drug conjugates,ADC)是一类由单克隆抗体和小分子细胞毒性药物通过连接子偶联而成的新型生物治疗药物 。与传统的细胞毒药物相比,ADC具有靶向性强,毒副作用小等优势,在临床上展现较好的治疗潜力。其中,抗体部分通过与肿瘤细胞表面的靶向抗原结合,精准地将小分子细胞毒性药物递送至肿瘤部位,从而实现肿瘤特异性杀伤效果。ADC药物结合了高特异性靶向能力和强效杀伤作用的优势,实现了对癌细胞的精准高效杀灭,已成为抗癌药物研发的热点之一。
ADC
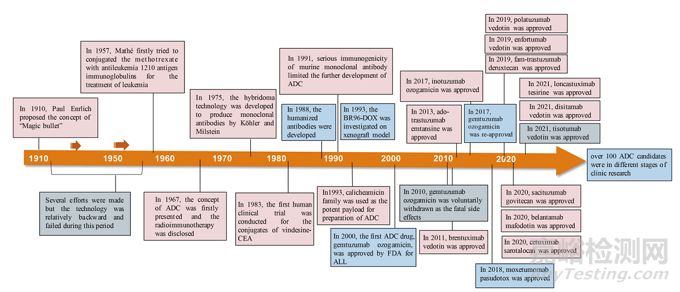
早在 20 世纪初,Paul Ehrlich 就首先提出了“魔法子弹”的概念,并假设某些化合物可以直接进入细胞中某些所需的靶点,从而治愈疾病。从理论上讲,这些化合物应该能有效杀死癌细胞,但对正常细胞无害。2000年,美国食品药品监督管理局(FDA)首次批准ADC药物Mylotarg® (gemtuzumab ozogamicin)用于成人急性髓系白血病(AML),标志着ADC靶向治疗癌症时代的开始。图1描绘了过去百年ADC药物从婴儿阶段到成熟发展阶段的标志性事件。随着靶点和适应症的不断扩大,ADC正在引领癌症靶向治疗的新时代,未来有望替代传统化疗药物。
图1 一个世纪ADC药物开发和批准的重要事件的时间表
1、 ADC药物的构成
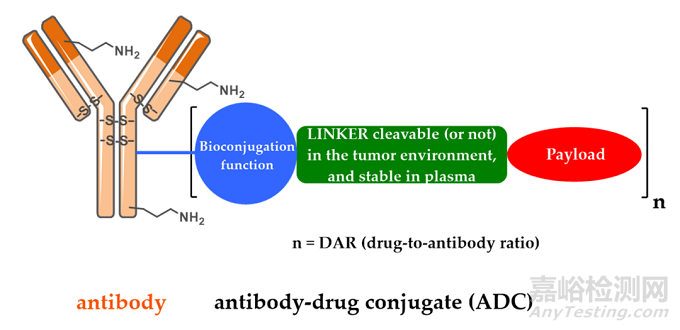
ADC由抗体、有效载荷和化学接头组成。理想的 ADC 药物在血液循环中保持稳定,精准到达治疗目标,并最终在目标附近(例如癌细胞)释放细胞毒性有效载荷。每个要素都会影响 ADC 的最终疗效和安全性,总体而言,ADC 开发需要考虑所有这些关键组成部分,包括靶点、抗体、细胞毒有效载荷、接头以及偶联方法的选择。
图2 ADC药物的结构和特性
2、ADC的作用机制
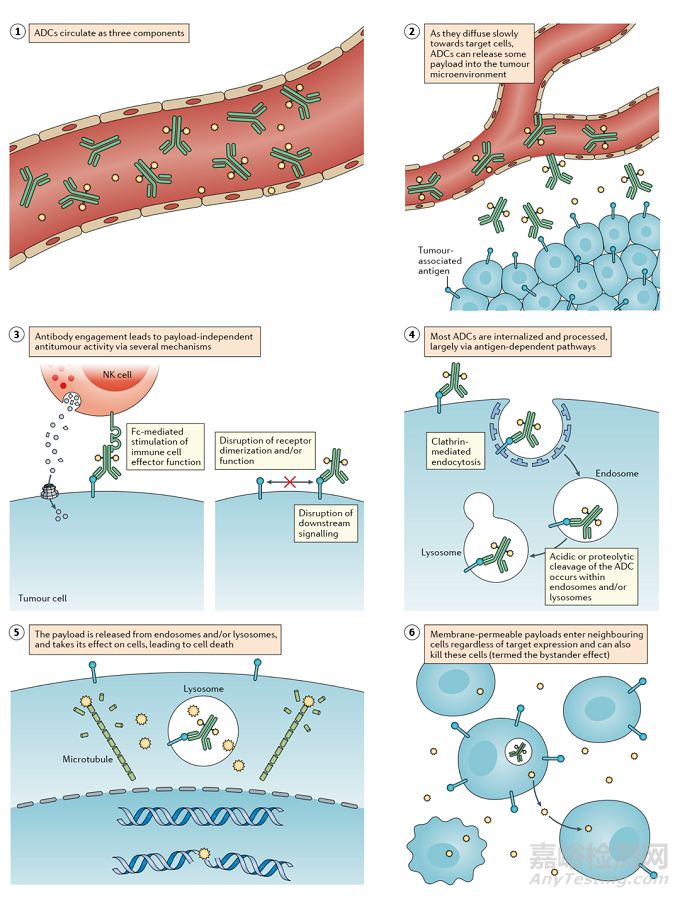
ADC通过组合发挥“特异性”靶向作用和“高效”杀伤癌细胞的作用。这类药物就像精准制导的“生物导弹”,能够精准摧毁癌细胞,提高治疗窗口,减少脱靶副作用。
图 3 ADC杀死癌细胞的作用机制
ADC的抗癌活性还涉及ADCC、ADCP和CDC的作用。一些 ADC 的抗体 Fab 片段可以结合病毒感染细胞或肿瘤细胞的抗原表位,而 FC 片段结合杀伤细胞(NK 细胞、巨噬细胞等)表面的 FCR,从而介导直接杀伤效果。此外,ADC的抗体成分可以特异性结合癌细胞的表位抗原,抑制抗原受体的下游信号转导。
3、ADC的研究进展
从药物组成和技术特点来看,ADC药物可细分为三代。早期ADC主要由常规化疗药物通过不可切割的接头与小鼠来源的抗体偶联而成。这些 ADC 的效力并不优于游离的细胞毒性药物,并且具有很强的免疫原性。后来,更有效的细胞毒剂与人源化 mAb 的组合使用极大地提高了疗效和安全性,因此第一代 ADCs 获得了市场批准(包括 gemtuzumabozogamicin 和 inotuzumab ozogamicin)。
以Brentuximabvedotin 和 Ado-trastuzumab emtansine为代表的第二代 ADC 在优化 mAb 同种型、有效载荷以及linker后获批。这两种 ADC 使用IgG1 同种型 mAb,更适合具有小分子有效载荷和高癌细胞靶向能力的生物偶联。毒性更高的有效载荷,提高了水溶性和偶联效率。可以将更多有效负载分子加载到每个 mAb 上,而不会诱导抗体聚集。Linker的改进实现了更好的血浆稳定性和均匀的 DAR 分布。总体而言,这三个要素的改进提高了第二代 ADC 的临床疗效和安全性。
第三代 ADC 以 polatuzumabvedotin、enfortumab vedotin、fam-trastuzumab deruxtecan为代表。他们具有1)均一 的DAR(2 或 4),显示出更少的脱靶毒性和更好的药代动力学效率;2)完全人源化抗体而不是嵌合抗体来降低免疫原性。此外,正在开发抗原结合片段 (Fab) 以替代许多候选 ADC 中的完整 mAb,因为 Fab 在体循环中更稳定,并且可能更容易被癌细胞内化。此外,已经开发出更有效的有效载荷:如 PBD、微管溶素和具有新机制的免疫调节剂。总的来说,第三代 ADC 具有更低的毒性和更高的抗癌活性以及更高的稳定性,使患者能够接受更好的抗癌治疗。
4、当前的挑战及下一代ADC
从已批准药物和开发中的候选药物可以看出,新一代 ADC 的特异性和细胞毒性比前几代产品越来越好。然而,在开发ADC 的过程中仍然存在许多挑战, 如复杂的药代动力学特征,不可避免的副作用,肿瘤靶向和有效载荷释放及耐药性。
下一代ADC
1、双表位或双靶点ADC
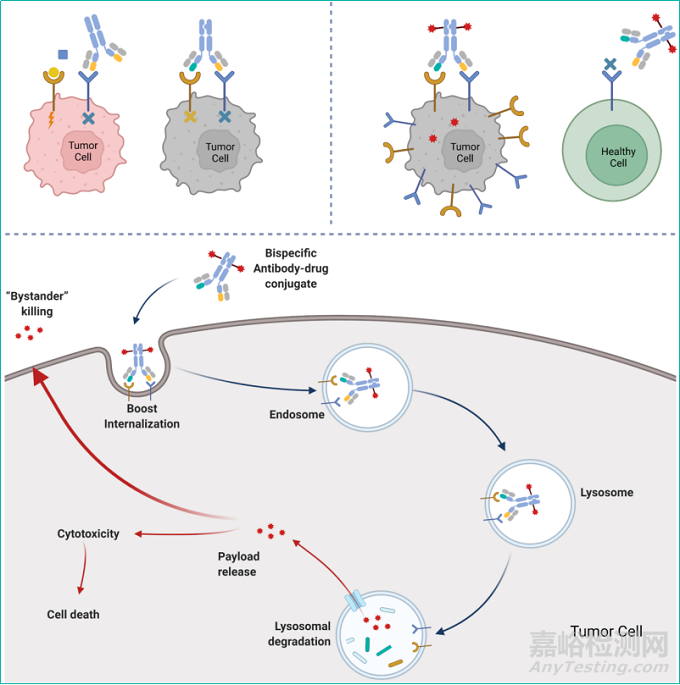
双特异性抗体技术的进步为ADC创新带来了更多可能。与单抗药物不同,双特异性抗体(双抗)可以同时识别一个靶点的两个表位或是两个不同的靶点,进而通过多种不同的分子机制产生更好的疗效。双特异性抗体的临床治疗效果优于单克隆抗体(monoclonal antibody, MoAbs),广泛应用于肿瘤免疫治疗和其他疾病的治疗。结合了双抗和ADC优势的双抗ADC药物,或将成为一种新的解决ADC药物现有的内吞、毒性和耐药问题的有效方案。
双抗ADC药物,是在单抗ADC优势之上再升级的一种崭新形式:一方面通过双抗更加特异性地靶向肿瘤细胞,增加药物的安全性;另一方面通过交联作用促进两个靶点的协同内吞,在提高毒素进入肿瘤细胞效率的同时,进一步通过减少受体蛋白在细胞膜上的表达量来抑制肿瘤细胞生长信号,达到更好的治疗效果。
图4.靶向双TAA靶点的双抗ADC作用机制
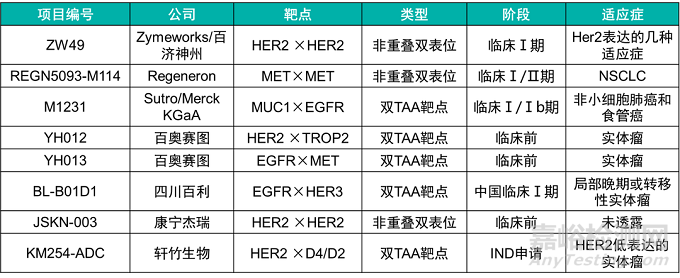
下表整理了目前已知的一些双抗ADC项目:
其中,ZW-49是由Zymeworks开发的双特异性抗体ADC药物,可同时特异性结合HER2受体的两个非重叠表位(ECD4/trastuzumab和ECD2/pertuzumab),该双特异抗体ADC是在ZW25的基础上通过蛋白酶切割链接子偶联Auristatin毒素A。在临床前的NHP动物模型中,该双抗ADC的最高耐受剂量到达18mg/kg。因为该药物是在双特异抗体ZW25上的改造,因此具有ZW25的多种优点,如有效地在细胞表面聚集HER2受体并增强HER2内化和下调等。在临床前动物模型中,ZW-49可以有效的杀伤HER2中表达和高表达的肿瘤,与阳性对照药物相比,其更能显著的延长动物的生存时间及生存几率。
图5. ZW49双表位ADC结构
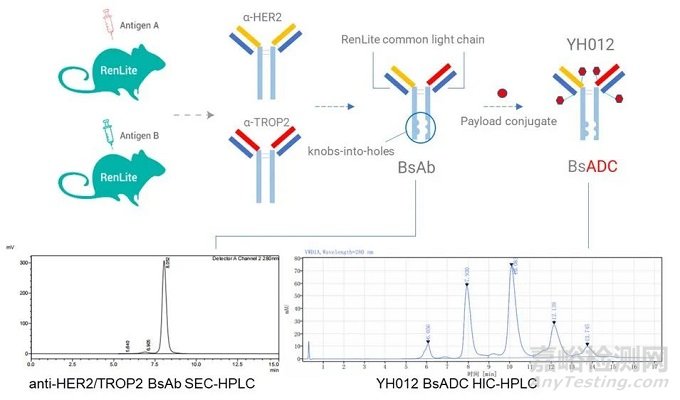
YH012是百奥赛图利用其RenLite®双特异抗体平台上构建的双靶点ADC(HER2×TROP2),RenLite®利用共同轻链的方法防止双特异抗体轻链的错配,同时采用Knob-In-Hole防止抗体重链错配,可以实现高纯度双特异抗体的生产。在此基础上,其利用链间半胱氨酸进行偶联,linker为可裂解的二肽VC(valine-citrulline),毒素为MMAE。在NCI-N87肿瘤细胞中,靶向Her2/TROP2的双抗ADC YH012可以被肿瘤细胞快速内化,并且其内化效率优于单靶点的对照ADC药物。在体内模型中,双抗ADC YH012可以有效的抑制肿瘤细胞的生长,在疗效上优于偶联相同毒素的单克隆抗体,而且优于更高剂量的双抗裸抗。
图6. YH012双靶点ADC结构
双抗ADC作为一个新的概念,目前还处在早期临床验证阶段,仍需要进一步验证疗效与安全性,但从药物研发的原理以及临床前的数据来看,这一类药物未来的前景仍然值得期待。
2、使用两种不同的有效载荷组合
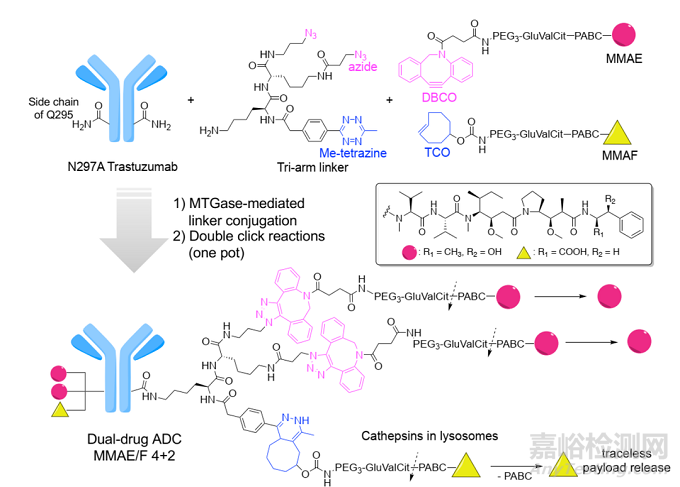
使用两种不同的细胞毒剂作为有效载荷的双有效载荷 ADC 以降低耐药性。通过准确控制两种药物的比例,将两种协同有效载荷递送到癌细胞中,可以实现更有效的疗效。并且随着两种不同机制的有效载荷的应用,耐药性的发生率将显着降低。例如,设计了一种同时包含 MMAE 和 MMAF 的均一的抗 HER2 ADC,并在异种移植小鼠模型中发挥了比共同只用相应的单有效载荷 ADC 更显着的抗肿瘤活性。
图7. 双药adc的分子设计和偶联策略
3、多肽偶联物(PDC)
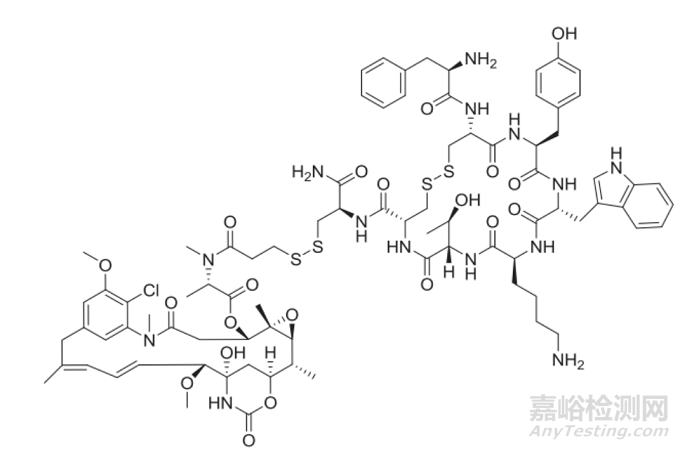
另一种ADC发展策略是摒弃mAb的传统结构,选择将payload与分子量较小的多肽片段偶联。这些策略的主要目的是降低 ADC 的分子量,从而提高穿透效率和有效载荷向肿瘤组织的传递。例如,PEN-221是一种 ADC,由 DM-1 与靶向生长抑素受体 2 的多肽链结合而成。其分子量仅为 2 kDa,远低于传统 ADC 中 150 kDa 的 IgG 分子。目前此类 ADC 面临的技术挑战是它们可能会在血浆中快速清除。然而,如果我们能够克服这一障碍,它在治疗难以接近的肿瘤方面具有潜力,包括血管神经支配不良的肿瘤和中枢神经系统肿瘤。
图8. PEN-221微型药物结合物
4、开发非内化
ADC 传统上,为了将有效载荷输送到癌细胞中,ADC 需要高内化能力的 mAb。然而,由于抗原屏障,mAb 通常难以扩散到实体瘤块中。因此,可以为 ADC 开发非内化抗体。它是基于有效载荷在肿瘤微环境中在还原条件下直接释放到细胞外,然后扩散到癌细胞内部导致细胞死亡的原理。最后,在有效载荷选择方面仍有很多创新机会。
总结
目前已成功开发出多种 ADC 疗法,使数以万计的癌症患者受益。14 种上市的ADC药物以及多种 ADC优异的临床表现也引起了人们对该领域的更多关注,这对于这个相对年轻但高度复杂的领域来说非常重要。随着这些领域研究人员的不断努力,不难想象未来的ADC将在癌症靶向治疗中展现出更多的惊喜。
参考资料:
[1] [1] Fu Z , Li S , Han S , et al. Antibody drug conjugate:the"biological missile"for targeted cancer therapy[J]. 信号转导与靶向治疗(英文), 2022, 7(4):25.
[2] Drago J Z , Modi S , Chandarlapaty S . Unlocking the potential of antibody-drug conjugates for cancer therapy[J]. Nature reviews. Clinical oncology.
[3] Hamilton G S. Antibody-drug conjugates for cancer therapy: The technological and regulatory challenges of developing drug-biologic hybrids[J]. Biologicals, 2015, 43(5):318-332.
[4] You G, Won J, Lee Y, et al. Bispecific Antibodies: A Smart Arsenal for Cancer Immunotherapies.[J]. Multidisciplinary Digital Publishing Institute, 2021(7).
[5] Beck A, Goetsch L, Dumontet C, et al. Strategies and challenges for the next generation of antibody-drug conjugates. [J]. Nature Reviews Drug Discovery, 2017, 16(5):315-337.
[6] Tarantino P, Pestana R C, Corti C , et al. Antibody-drug conjugates: Smart chemotherapy delivery across tumor histologies[J]. CA: a cancer journal for clinicians.