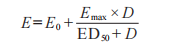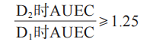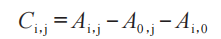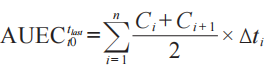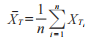美国食品药品监督管理局(FDA)于2022年10月发布了“皮肤局部用皮质类固醇:体内生物等效性的供企业用的指导原则草案”[1],介绍 1种证明局部用皮质类固醇生物等效性的体内药效学方法。已知局部皮质类固醇可导致皮肤血管收缩,从而产生皮肤变白的药效学效应。变白的程度取决于皮质类固醇的作用强度,并且适当控制研究参数时,其作用增强与渗透到皮肤中的皮质类固醇的量相关。因此,药效学血管收缩反应可以作为局部皮质类固醇在皮肤作用部位可获得的速率和程度的替代测量,从而用于证明试验的局部用皮质类固醇与其参比标准品(RS)[通常为参比制剂(RLD)]之间的生物等效性。该指导原则对用于证明局部用皮质类固醇生物等效性研究的研究设计、方法鉴定、数据分析和数据报告提出了详细而具体的建议。该指导原则还讨论了评估关键性研究参数的考虑因素和方法。
我国目前还没有专门针对皮肤局部用皮质类固醇的体内生物等效性指导原则。本文详细介绍FDA该指导原则,期待对中国皮肤局部用皮质类固醇体内药效学生物等效性研究和监管有帮助。
一、该指导原则的前言
该指导原则由美国食品药品管理局药品评价和研究中心仿制药办公室与临床药理学办公室协商编制。该指导原则旨在帮助申请人提交所有作用强度(potency)组的皮肤局部用皮质类固醇产品的简化新药申请(ANDA),以下简称局部用皮质类固醇。局部用皮质类固醇的作用强度是产生期望的治疗效果所需的药物量。血管收缩试验可用于测定作用强度。该指导原则介绍,证明局部用皮质类固醇生物等效性体内研究的建议。
定稿后,该指导原则将取代 1995 年 6 月发布的“皮肤局部用皮质类固醇:体内生物等效性”供企业用的指导原则[2]。修订该指导原则将为潜在的ANDA申请人,提供有关适当的试验性和关键性研究(pilot and pivotal studies),以及评估皮肤局部用皮质类固醇生物等效性的药效学方法的其他建议的明确信息。自1995年发布最初指导原则以来,这些建议不断演变。
该指导原则对用于证明局部用皮质类固醇生物等效性的试验性给药-持续时间血管收缩反应研究和关键性血管收缩生物等效性研究的研究设计、方法鉴定、数据分析和数据报告提出了建议。该指导原则还讨论了评估关键性研究参数的考虑因素和方法[例如,与血管收缩反应相关的半数有效剂量(ED50)以及关键性血管收缩生物等效性研究的样本量]。
一般来说,FDA的指导原则文件没有规定法律上强制执行的责任。相反,指导原则描述了FDA当前对某一主题的看法,除非引用了具体的规章或法定要求,否则仅应视为建议。在FDA指导原则中使用“should”一词意味着建议或推荐,而不是必需的。
二、该指导原则出台的背景
“联邦食品、药品和化妆品法案”(FD&C Act))通常要求 ANDA 除其他外,包含表明拟用仿制药品(试验产品)与其参比制剂具有生物等效性的信息。“生物等效性”是指当在适当设计的研究中以相同摩尔剂量在类似条件下给药时,药物等效物或药物替代品中的活性成分或活性部分,在药物作用部位可获得的速率和程度没有显著差异。”
该指导原则描述了1种证明局部用皮质类固醇生物等效性的体内药效学方法。已知局部皮质类固醇可导致皮肤血管收缩,从而产生皮肤变白的药效学效应。变白的程度(皮肤颜色的变化)取决于皮质类固醇的作用强度,并且适当控制研究参数时,其作用增强与渗透到皮肤中的皮质类固醇的量相关。因此,药效学血管收缩反应可以作为局部皮质类固醇在皮肤作用部位可获得的速率和程度的替代测量。
常规进行的确定关键性血管收缩研究的适当参数的血管收缩试验性研究,用于证明试验的局部用皮质类固醇与其参比标准品(通常为 RLD)之间的生物等效性。因此,该指导原则建议,拟使用体内药效学方法证明,试验的局部皮质类固醇与其参比标准品之间的生物等效性的ANDA申请人,进行两项体内血管收缩研究:(1)使用参比标准品进行试验性给药-持续时间血管收缩反应研究;(2)比较试验的局部皮质类固醇和参比标准品的关键性的血管收缩生物等效性研究。该指导原则后续章节将更详细地讨论所提出的方法,包括试验性给药-持续时间血管收缩反应研究的研究设计、模型选择和模型优化,以及关键性血管收缩生物等效性研究的统计方法。
试验性给药持续时间血管收缩反应研究(或试验性血管收缩研究或试验性研究)的目的是确定关键性血管收缩生物等效性研究中,被研究的局部用皮质类固醇的给药持续时间-反应关系。试验性血管收缩研究结果可提供,确定在预期申请人的关键性血管收缩生物等效性研究中,使用的参数 ED50、D1和 D2所需的给药持续时间-反应信息。ED50为半数最大血管收缩反应;D1为给药持续时间约等于该人群 ED50的 0.5 倍;D2为给药持续时间约等于所使用的简单 Emax模型的该人群 ED50的 2倍。开发和验证给药持续时间-反应标准曲线的适当敏感和识别区域,对于估计血管收缩反应的 ED50、D1和 D2至关重要。该方法类似于使用标准曲线,表征生物流体中药物的生物分析方法的线性、范围和定量限。对于研究的每种局部皮质类固醇的关键性研究,应在与试验性研究相同的条件下进行。
关键性血管收缩研究的目的是,使用体内的方法证明试验产品与RLD的生物等效性。或者,当拟定的仿制配方在非活性成分或配方的其他方面与RLD无差异(这些差异可能显著影响活性成分的局部或全身可利用性)时,可以采用基于体外特征的方法,确定局部用皮质类固醇产品的生物等效性。如果合适,鼓励潜在申请人提交受控信函,或请求召开 ANDA 中可能提交的相关复杂产品的产品开发会议,以讨论具体的科学问题(例如,在进行关键性血管收缩研究之前,拟定的研究设计或与方法鉴定、给药持续时间-反应或试验性给药持续时间-反应研究的其他方面相关的问题),或讨论替代的生物等效性方法(例如基于特征的方法)[3-5]。申请人必须与ANDA一起提交,ANDA依赖其批准的生物等效性研究的完整研究报告。
三、药效学血管收缩研究
3.1 血管收缩方法检定
分光光度计是最常用于测量局部用皮质类固醇涂抹后引起的药效学皮肤变白反应的仪器。在为血管收缩研究收集数据之前,应校准分光光度计并应对其预期用途进行鉴定。此外,不同操作人员进行的分光光度计测量的重复性和耐用性也应合格。这些合格确认应在研究开始前完成。如果研究有多个组,至少应在第一组开始日期之前进行方法确认。重复性表示在短时间间隔内,相同操作条件下的精度。耐用性是指该方法在各种正常但可变的试验条件下的再现性。可变条件可能包括不同的机器、操作人员和试剂批次。耐用性提供对实验再现性的估计,然而具有不可避免的误差。
3.1.1 分光光度计检定
使用校准的分光光度计进行分光光度计检定,以支持证明多个分光光度计单元的分光光度计测量的耐用性。在试验性给药-持续时间血管收缩反应研究和关键性血管收缩生物等效性研究中,可以设置多个分光光度计单元,测量血管收缩反应。这些试验性和关键性血管收缩研究中,使用的所有分光光度计都应报告其特定的识别号码,并经过确认,以确保研究数据收集的一致性。应使用1名操作人员、1例受试者和每个规定皮肤部位的至少 4 个读数,对计划用于试验性和关键性血管收缩研究的所有分光光度计进行检定。分光光度计内变异性计算,为通过 1 名操作人员使用 1台分光光度计计算 1个皮肤部位的多个读数内的变异性。不同分光光度计之间的变异性计算,为不同分光光度计读数的变异性,即1名操作人员在1个皮肤部位从每台分光光度计获得多个读数的平均值。应至少对4例的研究受试者重复分光光度计检定,每例研究受试者至少使用4个皮肤部位,以证明分光光度计测量结果的再现性。为了确定分光光度计之间和内部的程序一致性,每例受试者的分光光度计内和分光光度计间测量的变异性变异系数(CV)不得超过15%。
3.1.2 操作人员的资格认证
进行操作人员资格认证,以支持证明在多位操作人员之间分光光度计测量的耐用性。进行试验性和关键性血管收缩研究的操作人员应报告其特定的识别号或名称,并获得资格,以确保每位操作人员都一致性地操作分光光度计和测量皮肤反应。操作人员资格认证应由多名操作人员在 1例受试者身上使用 1台分光光度计进行,每例受试者在1个规定的皮肤部位至少有4个读数。操作人员内变异性的计算为,1 名操作人员在 1 个皮肤部位使用 1 台分光光度计,计算多个读数内的变异性。操作人员间变异性的计算为,不同操作人员之间的变异性,即使用同一受试者的 1个皮肤部位的 1 台分光光度计,计算每位操作人员的多个读数的平均值。应至少对 4 例的研究受试者,重复操作人员资格认证,每例研究受试者至少有 4 个皮肤部位,以支持证明方法的再现性。为了确定操作人员之间和操作人员内部的程序一致性,操作人员内部和操作人员之间测量值的CV应不超过每例受试者的15%。
3.2 给药持续时间-反应模型
应优化进行关键性血管收缩生物等效性研究的条件,以确保在反应曲线的敏感(陡峭)部分,比较试验的局部用皮质类固醇和参比标准品,在这种条件下血管收缩反应对试验品和参比标准品之间皮质类固醇生物利用度的差异,是敏感的和有区别力的。局部用皮质类固醇的给药持续时间-反应关系的建立,依赖于预定剂量的药物产品持续给予皮肤。建立局部用皮质类固醇的给药持续时间-反应关系,将确定敏感的给药持续时间-反应区域,以支持关键性研究设计。应测量反应的时间过程,直到其回到基线,以确保在每个给药持续时间,观察到最大药效反应。
识别药效学皮肤变白效应的给药持续时间-反应曲线的敏感和区分区域,有以下益处:(1)产生预期释入皮肤的皮质类固醇药物量增加的条件[调节释入皮肤药物(皮质类固醇)量的实际方法,是在皮肤上给予固定量的局部用皮质类固醇产品,逐渐增加给药持续时间];(2)测量由皮肤血管收缩引起的皮肤变白的效果。
尽管有多种模型可用于表达药物剂量和药效学效应之间的关系,但 FDA 建议使用下面最大效应(Emax)模型,描述局部用皮质类固醇的给药持续时间-反应,该模型根据基线效应(E0)、Emax和ED50时的给药-持续时间(D),描述效应量(E)。
如果潜在申请人认为上述 Emax模型不合适,可以使用替代模型,并提供理由和适当的模型选择程序(见附录IV)。潜在申请人应证明其选择的Emax模型是合理的,并鼓励他们使用药效学血管收缩研究数据,支持从给药持续时间-反应模型中选择给药持续时间,以便群体估计。在群体给药持续时间-反应模型中,可以考虑 Emax和 ED50的固定效应和(或)随机效应。应规定群体分析中Emax和ED50参数的模型参数分布假设的类型(正态或对数正态)。潜在申请人应描述其模型优化程序,并在ANDA前会议请求或ANDA提交资料中,提供ED50选择的理由。建议包括的模型优化的一些方面如下:Emax模型选择;估算方法比较;模型参数选择;错误模型选择;初始估算程序[6]。
当皮肤血管系统不能进一步收缩时,体内血管收缩反应(用作皮肤变白检测)通常接近最大值。在强效局部用皮质类固醇的相对较高作用强度下,随着给药持续时间的延长,血管收缩反应可能减弱(高端反应曲线变平)。相反,在低效局部用皮质类固醇的相对较低作用强度下,尽管给药持续时间延长),但引发血管收缩反应可能是困难的(低端反应曲线变平)。因此,潜在申请人应设计试验性血管收缩研究,根据局部皮质类固醇的作用强度,适当覆盖大部分给药持续时间-反应曲线,从而改进给药持续时间-反应模型。
3.3 研究设计
3.3.1 试验性研究
该给药持续时间-反应研究应仅基于参比标准品 ,并随机化持续给药的皮肤部位。
应使用每个臂上未经处理的对照部位,校正研究期间与药物暴露无关的活性药物皮肤部位的颜色变化。由于与参比标准品相对应的辅料通常不可得,未经处理的对照部位指的是,未处理的皮肤区域,而不是应用辅料的皮肤区域。
应适当设计给药持续时间(如 0.25~6.0 h),以探索给药持续时间-反应关系,并确定关键性研究的适当给药持续时间。在去除残留的局部皮质类固醇后,通过每个给药持续时间结束时的分光光度计读数 ,根据效应曲线下面积(AUEC)测量药效学反应。
应使用非线性混合效应模型方法,建立给药持续时间-反应数据模型,以确定群体 ED50值,该值将作为关键性血管收缩研究的近似给药持续时间。建议至少12例受试者。
3.3.2 关键性研究
该药效学生物等效性研究采用基于试验性研究中确定的群体 ED50试验的局部用皮质类固醇和参比标准品的单次给药持续时间。此外,关键性研究中还应包括参比标准品的每个给药持续时间(D1和D2)的重复。
对于生物等效性分析,个体受试者的选择基于每例受试者 D2处的平均参比 AUEC 与 D1处的平均参比AUEC的可接受比率。如果提出简单的Emax模型 ,则比率的最小值应为 1.25,D1 和 D2 处的平均AUEC 值均为负值。然而,根据所选的给药持续时间-反应模型,可以使用该比率的其他值并提供理由。符合该给药持续时间-反应标准的个体受试者(在平均 D1和 D2值均为负值的条件下)被定义为检出者(detector,即可评价的受试者)。
申请人有责任设计充分有力的关键性生物等效性研究。建议申请人纳入足够数量的受试者,以产生足够数量的检出者,为研究提供动力。在确定入选受试者的样本量时,应考虑退出率和所需检出者的估计数量。根据ANDA中提交的研究结果,关键性研究通常使用 40 例或更多检出者。关键性研究的样本量的确定,应在方案中预先规定并证明其合理性。应招募足够的受试者,持续给药的皮肤部位随机化,并在研究开始时给药,以确保所需数量的检出者用于分析。分析中应包括所有检出者。
3.4 受试者入选标准
一般人群中的男性和未怀孕、未哺乳的女性。证明对参比标准品有充分的血管收缩反应的受试者(有关筛选反应的受试者,请参考第3.6节)。在整个研究过程中,愿意使用相同的肥皂或洁肤液淋浴(研究完成期间的筛选访问)。愿意遵守研究限制[请参考第9.1(.c)(-f)节]。
3.5 受试者排除标准
临床上严重的高血压或循环系统疾病。研究1周内吸烟。研究前或研究期间,咖啡因摄入量每天超过500 mg。咖啡、茶和能量饮料都应被视为重要的咖啡因来源。具有临床意义的酗酒或药物滥用史。
研究前1个月内在前臂腹侧使用局部皮肤病药物治疗(作为治疗或参与临床研究)。局部或全身皮质类固醇的不良反应。任何当前或过去的疾病,包括活动性皮炎或任何其他皮肤病,都可能明显影响对所给药物的药效学反应。
使用任何可能调节血流的血管活性药物(收缩剂或扩张剂,处方药或非处方药)。这类药物的实例包括硝酸甘油、抗高血压药、抗组胺药、非甾体抗炎药、阿司匹林和含有抗组胺药和(或)苯丙醇胺或酚妥拉明的非处方咳嗽或感冒药。
需要前臂腹侧剃毛,以确保皮肤表面的剂量一致。两手臂之间肤色的任何明显差异。
3.6 筛选反应的受试者
在该指导原则中,“反应者(responder)”被定义为在试验性和关键性血管收缩研究中,在使用相同密封或非密封条件下,对相应参比标准品的单次给药持续时间,表现出皮肤变白血管收缩反应的受试者。在试验性和关键性血管收缩研究中,用分光光度计量化皮肤变白,被认为是最令人满意的反应测量。然而,反应者的状态可基于离散多单位量表的视觉读数(0~3或0~4)。建议给药持续时间4 h或6 h,在除去药物后2 h,评估皮肤变白。反应者显示至少1个单元的视觉读数。
纳入无反应者,可降低研究检测试验的局部用皮质类固醇和参比标准品之间真实差异的能力(如果存在)。因此,对于试验性给药持续时间-反应研究和关键性生物等效性研究,只有反应者才应纳入研究。
为了保护前臂腹侧的皮肤部位,以便在给药持续时间-反应研究或生物等效性研究中使用,反应者的状态可基于在前臂以外的部位(如上臂)的研究。研究报告中应包括确定反应者的标准(包含给药持续时间、反应强度和试验的皮肤部位)。
3.7 密封与非密封
当特定参比标准品的说明书中允许使用密封时,可使用非吸收性密封薄膜,进行试验性给药持续时间-反应血管收缩研究和关键性血管收缩(生物等效性)研究。密封可能仅适用于血管收缩研究中作用较弱的产品。建议谨慎,因为试验性研究数据表明 ED50(关键性研究中使用的给药持续时间)随着局部用皮质类固醇产品作用的增强而降低[7]。给药持续时间-反应评价需要 ,低于 ED50 的某个时间(即 D1)的给药持续时间数据。很短的给药持续时间很难进行试验,并且往往产生反应的高变异性。如果密封用于试验性血管收缩研究,它也应用于关键性血管收缩研究。
3.8 敷药和除去方法
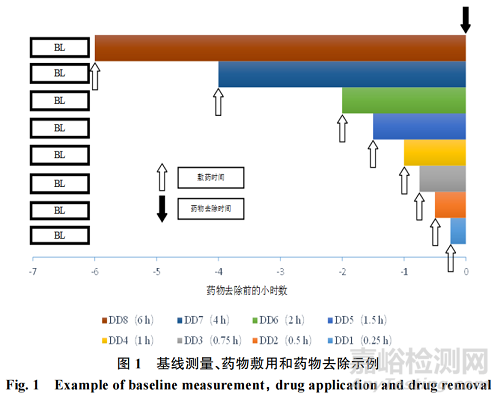
在试验性和关键性血管收缩研究中,可采用同步除去的交错敷用(即在不同时间将局部用皮质类固醇敷于皮肤部位,并同时除去)(见附录I)。
3.9 研究日活动和限制
3.9.1 试验性研究
(a)受试者应在每个研究日大致相同的时间(1 h内)开始研究。
(b)通过排除可调节血流药物(收缩剂或扩张药)的充分洗脱史检查。
(c)在研究持续期间,大体上任何1只手臂都不运动,也不剧烈运动。
(d)在药物敷用和皮肤变白评估期间,不得洗澡或淋浴。
(e)在研究前24 h内和整个过程中,前臂上不得使用护肤剂、润肤剂或类似产品。
(f)前臂应无任何污垢或颗粒物质,这些物质可干扰药物的正确敷用或药效学反应的评估。不鼓励清洁皮肤,因为可能会影响药物吸收和药物的药效反应。如有必要,应在用药前至少 2 h进行清洁。如果进行了清洁,应在研究报告中注明。
(g)无论研究是在密封或非密封条件下进行建议使用保护性非密封防护装置,防止皮肤部位涂抹或从皮肤部位去除局部用皮质类固醇。应注意避免防护装置与局部用皮质类固醇接触,以防止未经治疗的对照部位或其他试验部位意外污染。
(h)皮肤部位离肘前窝或腕关节的距离不得小于3~4 cm。
(i)参比标准品应适用于前臂腹侧相同表面积的皮肤部位。建议试验性研究的给药持续时间为0.25、0.5、0.75、1、1.5、2、4、6 h,但可因研究中的局部皮质类固醇而异。
(j)8个给药持续时间(即活性药物部位),应在两个臂之间平均分配。
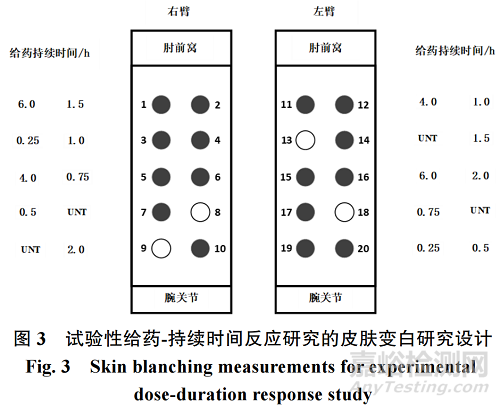
(k)研究开始前,应确定药物用量、皮肤部位大小和部位间距。如研究人员在每平方厘米(cm2)皮肤表面积,可以使用 5~12 μL制剂和范围为 1.6 cm直径部位。根据皮肤表面的适宜性(如血管、痣等)和手臂长度,部位的中心距可接近2.5 cm,可呈直线或交错排列。如果2个相邻试验部位的血管收缩效应重叠,且研究者无法辨别每个试验部位的收缩效应,则应将其受试者排除在数据分析之外。应将 8个给药持续时间(一式两份;见附录 II)和 4 个未处理的对照部位随机分配到 20个部位,保留 2个未处理的对照部位,每臂 8 个给药部位(每个臂 10 个部位),并在每个持续时间重复测量。
(m)在敷药期结束测量药效学皮肤变白(血管收缩)反应之前,应轻轻除去皮肤上残留的局部皮质类固醇。这可以通过下列任一种方法实现:用干棉签连续 3 次擦拭;或用温和的皮肤清洁剂和水清洗所有皮肤部位,用非摩擦性毛巾吸干皮肤部位,并在评估前风干至少 5 min。用最少量的温和液体皮肤清洁剂清洁手臂表面,如1滴液体清洁剂,在湿润的手上起泡沫,然后冲洗。如果 5 min后,受试者有任何与洗涤相关的可见皮肤影响,则可能需要更长的等待时间。该方法适用于同步去除法的交错敷药。
(n)评 估 每 个 部 位 的 基 线 皮 肤 颜 色 和 皮 肤变白。交错敷药和同步去除的评估时间段示例如下:对于所有给药持续时间和未处理的对照部位,在最长给药持续时间的药物敷用前 1 h 内,以及在 0、2、4、6、8、10、12、20、24 h或更长时间内的基线读数,直到药物产品去除后反应恢复到基线(见附录 I)。给药持续时间将取决于所研究的局部皮质类固醇。时间零点(0)定义为去除药物后15 min内。
3.9.2 关键性研究
(a)如适用,遵循上文第“3.9.1”节中列出的建议。为了消除潜在的操作员偏倚,分析员(如分光光度计操作员)应该对产品处理分配处于盲态。
(b)应随机分配每个受试者前臂腹侧皮肤部位的给药持续时间的敷药,维持以下建议。根据上文第“3.7”节的考虑因素和试验性研究中使用的研究设计,可能密封或非密封部位。还应包括未处理的对照皮肤部位。各臂上的给药持续时间和对照部位应包括:
R:根据试验性研究中的参比标准品,确定的给药持续时间约相当于 ED50的参比标准品(如每臂 2个部位)。
T:试验局部皮质类固醇的给药持续时间与参比标准品的ED50大致相同(如每臂2个部位)。
D1:较短给药持续时间的参比标准品校准部位(如每臂2个部位)。
D2:较长给药持续时间的参比标准品校准部位(如每臂2个部位)。
UNT:未处理的对照组(如每臂2个部位)。治疗部位的总数为 16 个(即每臂 8 个部位)。如上所述,8 个治疗和 2 个 UNT 应随机。每个臂上的敷药方式应该是互补的,即 D2与 D1互补,R 与 T互补,UNT 与 UNT 互补。例如,当 T 被分配给 1 只手臂上的特定皮肤部位位置时,R应该被分配给另1只手臂的相应皮肤部位。如果 UNT 被分配给 1 只手臂上的特定皮肤部位位置,则UNT应被分配给另1只手臂的相应皮肤部位。
特定受试者两臂从肘前窝到腕关节的代表性敷 药 顺 序 可 能 如 下 :左 臂 为 D1、T、UNT、R、D1、UNT、T、D2、R、D2;右臂为 D2、R、UNT、T、D2、UNT、R、D1、T、D1。
在研究报告或研究方案中,应描述皮肤部位的具体模式,即内侧(尺骨)到外侧(桡骨),以及上下。
(c)对于D1、D2和ED50给药持续时间,应使用与试验性研究中使用的方法一致的交错敷药和同步去除方法。
(d)参考第 3.9.1(n)节,评估每个部位的基线肤色和皮肤变白。
3.10 数据分析和药效学模型
3.10.1 试验性和关键性研究的AUEC计算
(a)调整(通过减法)每个皮肤变白反应的分光光度计原始数据与时间曲线(活性药物部位和未处理的对照部位),以确定该部位的基线值。根据同一臂上 2 个基线调整的未处理对照部位的平均值,校正每个基线调整的活性药物部位。
(b)使用梯形法计算每个基线调整、未处理对照部位校正给药持续时间的AUEC(见附录III)。同步去除法交错敷药的 AUEC(0-t() 见附录 III),0 为药物去除后 15 min 内 ,t 为药物去除后至少24 h。
3.10.2 试验性研究的药效学模型
(a)不建议通过每个给药持续时间的各受试者的平均值,拟合给药持续时间-反应数据。相反,该数据应该通过使用非线性混合效应模型,使用所有个体受试者的所有观察结果拟合。模型软件应提供,至少 12 例受试者数据的 ED50 和 Emax 参数的总体估计。
(b)确定 ED50(对应于半数最大反应的给药持续时间)。
(c)确定D1和D2,分别对应于ED50的大约1/2和ED50的2倍(对于使用的简单Emax模型),以用于关键性研究。这些值包括 ED50,分别对应于最大反应的约33%和67%,代表给药持续时间-反应曲线的敏感部分。估计的 ED50值最多可四舍五入 15 min,以获得关键性研究中使用的 ED50值。对于 ED50值较短的强效皮质类固醇,这些建议可能需要调整。如果是这样的话,可以通过受控通信或对于相关复杂产品通过ANDA前会议,咨询FDA。
3.10.3 关键性研究的数据分析
(a)数据分析中只应包括检出者的数据。定义检出者的给药持续时间-反应标准为:
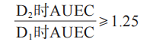
D2 时 AUEC 为 D2 时 左 臂 和 右 臂 AUEC 的 平 均 值 ,D1 时AUEC为D1时左臂和右臂AUEC的平均值
(b)生物等效性比较应基于根据附录III计算的AUEC值,给药持续时间约等于ED50(治疗T和R)。
(i)统计分析需要使用未转换的数据,因为治疗T和R的AUEC值(根据基线调整的、未处理的对照部位-校正数据计算)通常为负值,尽管有时为正值。正和负数据的存在 ,阻止传统统计转换的使用。Locke方法[8]可提供未转换数据的精确置信区间。
(ii)使用来自检出者的数据,应使用Locke方法计算,试验产品(如AUEC0-24h)反应(4次重复的平均值)与参比产品(的 AUEC(如 AUEC0-24h)反应(4 次重复的平均值)之比的 90%CI。附录 V 给出了基于数据的公式和样例。
试验与参比 AUEC之比的 90% 置信区间,不应在80.00%~125.00%区间内。
3.10.4
数据提交的格式应按照 FDA 的建议,以下列格式提交试验性和关键性研究的研究数据 :https://fda.report/media/87599/Topical-DermatologicCorticosteroids-In-Vivo-Bioequivalence-Study-Summary-Tables-and-SAS-Transport-Formatted-Tablesfor-Dataset-Submission.pdf。分光光度计原始数据、基线调整数据、基线调整的未处理对照部位校正数据 和 AUEC 数 据 应 安 排 在 单 独 的 文 件 中 。
应提交所有研究数据,包括非检出者的数据。在血管收缩研究评价中未使用的任何数据,都应附有解释(如非检出者、由于邻近部位导致的血管收缩效应重叠等)。随机化代码应与研究报告一起提交,说明每个给药持续时间和对照部位分配的特定皮肤部位。
四、附录
4.1 附录 I:试验性研究方案的同步去除交错敷药示意图
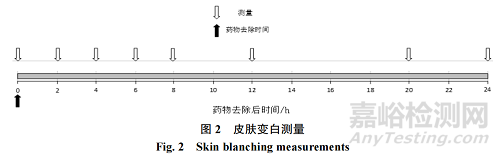
上文第“3.8”节提及试验性研究方案的敷药和除去方法,此处用图 1 详细介绍基线(baseline)测量、药物敷用和药物去除示例,DD 为给药持续时间(DD-dose duration)。上文第“3.9.1”节提及交错敷药和同步去除的评估时间段,在此用图 2 详细展示。图2中时间零点(0)为去除药物后15 min内。
4.2 附录 II:试验性给药-持续时间反应研究的皮肤变白研究设计的示例
上文第“3.9.1(l)”提及两臂随机分配给药部位和未处理部位,在此用图 3 形象展示。图中亮圆为未处理的部位;而暗圆则为不同给药持续时间的治疗部位;0.25~6.0 h 的给药持续时间代表皮肤暴露于参比标准品的时间。
4.3 附录III:AUEC的计算
步骤1:计算每个相应治疗部位的基线调整、未处理对照部位校正的量表数据(Ci,j):
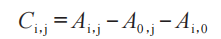
其中i是药物去除后的第i次测量(h):如,从0 h到(t 至少24 h);j是第j个给药持续时间:从给药持续时间DD1到最后给药持续时间 DDn;Ai,j是在药物去除后的时间 i处,第 j个给药持续时间内,每个相应治疗部位的原始量表数据部位读数;A0,j是最长给药持续时间,用药前 1 h 内的基线(给药前)读数;Ai,0是在同一臂的药物去除后的时间i的未处理对照部位读数的平均值
步骤 2:根据基线调整和未处理对照部位的AUEC 计算,校正所有受试者的试验局部皮质类固醇和参比标准品量表数据(Ci,j)。
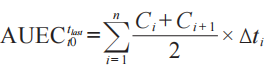
其中 t0表示第 1次测量的药效学反应的时间,如药物去除后0.25 h;Δti=ti+1-ti,tlast 表示最后1次测量的药效反应时间
4.4 附录IV:EMAX模型
应使用群体模型方法,开发如下所示的简单Emax模型,因为Emax模型需要考虑受试者之间的变异性。FDA不再建议使用幼稚的池(所有受试者都作为1个池)。

E是敷药给药持续时间(D)时的反应(基线调整、未处理对照部位校正 AUEC),Emax是最大反应,以及 ED50是发生半数最大反应的持续时间。
如果上述 Emax模型不能拟合给药持续时间-反应数据,则可以使用替代的 sigmoidal 模型,并提供理由和适当的模型选择程序。潜在的替代模型如下:

如果有充分的理由,其他替代模型也可以接受。有关群体模型、模型验证/确认和 Emax模型的详细信息,请查阅下列指导原则和出版物。群 体 药 动 学 供 企 业 用 的 指 导 原 则(2022年2月)[6];
暴露-反应关系—研究设计、数据分析和监管应用供企业用的指导原则(2003年4月)[9];
Ozdin等[10]重新审视 FDA 1995年《局部皮肤用皮质类固醇生物等效性建立:基于研究的新建议》指导原则;
Upton 等体模型、模拟和基于模型的药物开发的基本概念:第3部分:药效学模型方法介绍[11]。
4.5 附录V:生物等效性评价的LOCKE法和样例
表 1 中关键性生物等效性数据集(关键性研究中受试者的平均 AUEC值)的 90% 置信区间计算如下。用于计算置信区间的数据是,“检出者”的平均基线调整值和未处理的对照部位校正AUEC值。置信区间的计算可通过下列中间量的计算实现:
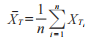

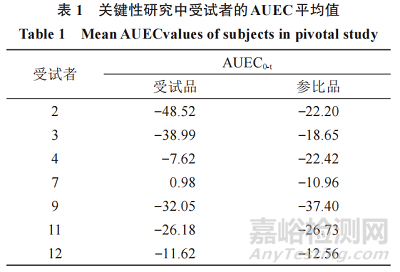
在该例中,这些是XˉT=−23.43,XˉR=−21.56,σźTT=323.13,σźRR=80.10,和σźTR=78.83;对于n=7,(t 自由度6)为1.943 2。G=0.093 0<1,则K=6 872.791。
根据可评价受试者的数据,90% 置信区间限值为 53.6% 和 165.9%,不在 80.00%~125.00% 可接受范围内。
五、结语
FDA“皮肤局部用皮质类固醇 :体内生物等效性的供企业用的指导原则草案”对局部用皮质类固醇体内药效学生物等效性研究提出了许多 具 体 的 建 议 ,涉 及 许 多 方 面 ,其 中 包 括 血 管收缩方法的检定 、给药持续时间-反应模型 、研究设计、受试者入选标准和排除标准、筛选有反应的受试者、密封与非密封给药、敷药和除去方法、研究日的活动和限制以及数据分析和药效学模型并辅以图表和计算说明。这些建议对我国这方面的研究和监管有重要的参考价值 ,并有如下启示。
5.1 中国应制定“皮肤局部用皮质类固醇体内药效学生物等效性研究指导原则”
美国 FDA于 2022 年 10 月发布的“皮肤局部用皮质类固醇:体内生物等效性的供企业用的指导原则草案”是在 1995 年 6 月发布的“皮肤局部用皮质类固醇:体内生物等效性”供企业用的指导原则”基础上,经历 20 多年反复修订而形成的新的版本,这种研究方法趋于成熟。虽然中国在“局部给药局部起效药物临床试验技术指导原则”[12]中,提及“对于含皮质类固醇激素的外用制剂,可在药学对比研究达到高度相似性的基础上,后续采取皮肤变白试验(skin blanching study)这一体内药效学方法,以PD 参数为终点来评估仿制药与参比制剂的等效性。”,但还没有专门针对皮肤局部用皮质类固醇体内药效学生物等效性研究的指导原则。建议我国药政管理部门,参考本文介绍的 FDA 指导原则,结合我国实际制定“皮肤局部用皮质类固醇体内药效学生物等效性研究指导原则”。
5.2 FDA该指导原则中特别值得关注的建议
FDA在本文介绍的指导原则中有许多建议,有利于我国这类药品的研究和监管,值得我国这类药品研究和监督管理人员特别关注。譬如,操作人员内部和操作人员之间测量值的CV应不超过每例受试者的 15%;给药持续时间-反应的 Emax模型;关键性研究通常使用40例或更多检出者;受试者的入选和排除标准;试验性给药持续时间-反应研究和关键性生物等效性研究,只有反应者才应纳入研究;研究日的活动和限制;试验与参比AUEC之比的 90%置信区间,不应在80.00%~125.00%内。