随着新冠疫情被有效控制,美国于2月9号宣布COVID-19公共卫生紧急状态(PHE)将于2023年5月11日结束。除此之外,EUA也即将迎来终止。
为了给所有利益相关者和FDA工作人员提供一个明确的政策,并帮助制造商和其他利益相关者为过渡到正常运作做好准备,并促进遵守FD&C法案及其实施条例的适用要求,3月24号,FDA发布两份过渡指南:
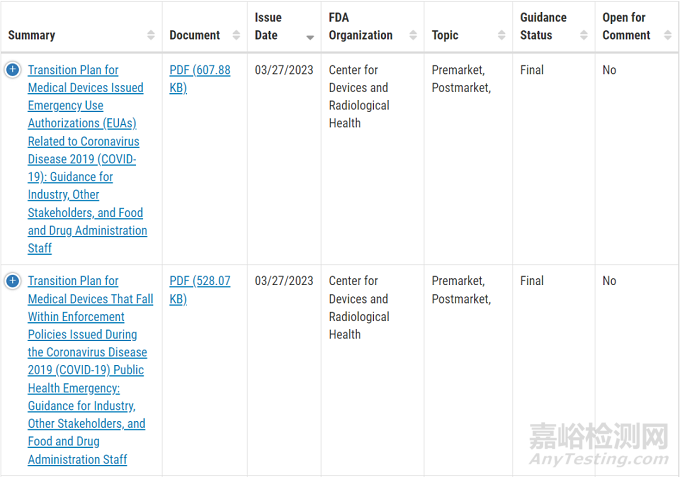
Transition Plan for Medical Devices Issued Emergency Use Authorizations (EUAs) Related to Coronavirus Disease 2019 (COVID-19)
描述FDA对获得COVID-19紧急使用授权(EUA)的器械过渡到正常操作的一般建议,包括关于提交上市申请的建议,如适用,并对这些器械采取其他行动。
Transition Plan for Medical Devices That Fall Within Enforcement Policies Issued During the Coronavirus Disease 2019 (COVID-19) Public Health Emergency
描述了FDA对属于COVID-19公共卫生紧急情况(PHE)期间发布的某些执法政策的相关器械的建议。
指南概要
A. 针对已拥有EUA授权的可重复使用的生命支持或生命维持器械
FDA要求器械制造商向FDA提交有关他们是否打算向FDA提交上市申请并在EUA终止日期后继续销售其产品的信息。
B. 针对打算在EUA终止日期之后继续销售的器械
1、FDA建议制造商尽快提交产品的上市申请,以便有足够的时间被FDA接受。
2、提供过渡实施计划。
3、在有关的EUA终止声明的预先通知发出后的90天内,选择申请豁免或改变器械Quality System的要求。
4、当制造商已经向FDA提交了一份上市申请,且在EUA终止日期前被FDA接受,并且FDA还没有对该申请采取最终行动的时候,FDA不打算反对制造商在EUA终止日期后继续销售该器械。
5、对于在病人护理环境中使用,想要分类为CLIA Waiver的EUA IVD产品,FDA建议制造商根据指南Recommendations for Dual 510(k) and CLIA Waiver by Application Studies进行上市申请。
C. 当制造商不打算在EUA终止日期后继续销售其器械
FDA不打算反对处置和使用已经销售的器械。
此外,在2023年11月7日之后,针对部分医疗器械产品的指南将不再有效,具体的信息可参考指南Transition Plan for Medical Devices That Fall Within Enforcement Policies Issued During the Coronavirus Disease 2019 (COVID-19) Public Health Emergency。
利益相关者们需要尽快准备起来,做好过渡工作。