随着耐抗生素的“超级细菌”的出现,抗生素的耐药性引起了人们的广泛关注。在抗生素的选择性压力下,具有耐药性的致病菌大量繁殖,并在宿主(动物或人体)之间传播,最终会对人类健康形成巨大威胁。为了对抗多重耐药细菌,人们大力发展除小分子抗生素以外的其他抗菌药物,其中模拟宿主防御肽(HDP)结构特点的阳离子两亲聚合物具有广谱高效的杀菌效果和相对于抗菌肽更低的成本,是一种极具前景的新型抗菌药物。HDP 模拟聚合物通常是具有一定比例的阳离子和疏水侧基的无规共聚物,具有抗菌活性的阳离子基团促进聚合物与阴离子细菌细胞膜的初始结合,疏水基团则插入膜内导致细胞裂解和细菌死亡。因此,系统地调整聚合物的分子结构,分子量以及阳离子/疏水基团的比例,对于最大限度地提高 HDP 模拟聚合物的抗菌性能同时最大限度地降低其生物毒性至关重要。然而,已开发的HDP 模拟聚合物往往在生理条件下长期保持化学稳定,持续存在低于最小抑菌浓度(MIC)的抗菌聚合物会对细菌施加选择性进化压力,最终可能诱发细菌耐药性;同时也可能会对人体产生长期毒性以及引起免疫反应。因此,研究出一类具备生物分子触发的可降解性和降解前后良好生物相容性的抗菌聚合物是十分有必要的。
近期,华南理工大学前沿软物质学院(华南软物质科学与技术高等研究院)唐雯研究团队通过氨基官能化硫辛酸的开环聚合反应,合成了一系列谷胱甘肽触发的可生物降解的聚二硫化物,该类聚合物具有出色的抗菌活性。同时,作者系统地调整了聚二硫化物的分子量和阳离子/疏水基团的平衡,以最大限度地提高对人体细胞的选择性杀菌能力。该类聚合物的抗菌活性可以通过谷胱甘肽触发的降解来关闭。该研究以题为“Glutathione-triggered biodegradable poly(disulfide)s: ring-opening copolymerization and potent antibacterial activity”的论文发表在《Polymer Chemistry》上。本文第一作者是华南理工大学前沿软物质学院博士生郭佳,通讯作者是华南理工大学前沿软物质学院唐雯副教授。
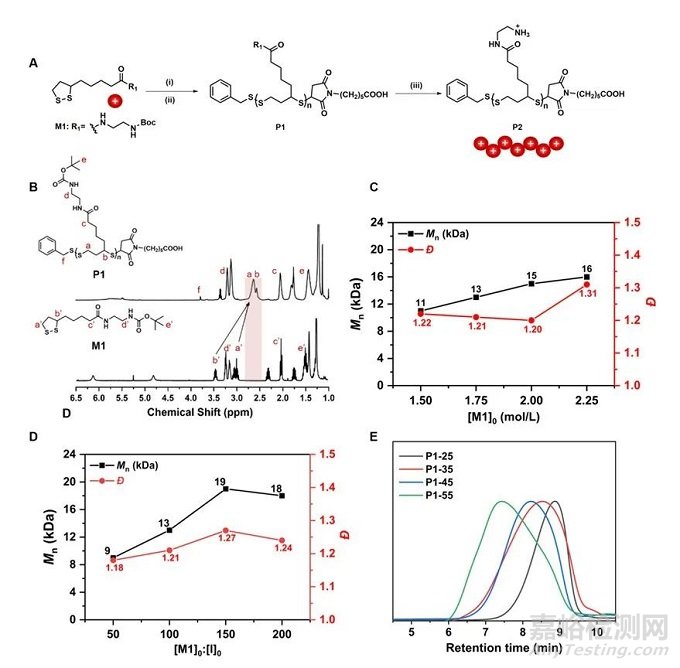
在本工作中,作者通过阴离子开环聚合的方法合成了氨基官能化的聚二硫化物(图1 A)。同时,调整例如单体浓度和投料比等反应条件,可得到具有可控分子结构的一系列均聚物。图1 B展示了单体与聚合物的核磁结果。均聚物的分子量与分子量分布随反应条件的变化情况如图1 C-E所示。
图1. 氨基官能化的聚二硫化物开环聚合的合成与表征。(A) 合成路线图;(B) 聚二硫化物1 (P1) 和单体1 (M1) 在CDCl3中的 1H NMR 谱;(C) Mn 和 Đ 与初始单体浓度 ([M1]0) 的关系图;(D) Mn 和 Đ 与单体1和引发剂的比率 ([M1]0: [I]0) 的关系图;(E) 制备型 GPC 纯化后,具有不同数均聚合度的P1的GPC结果。
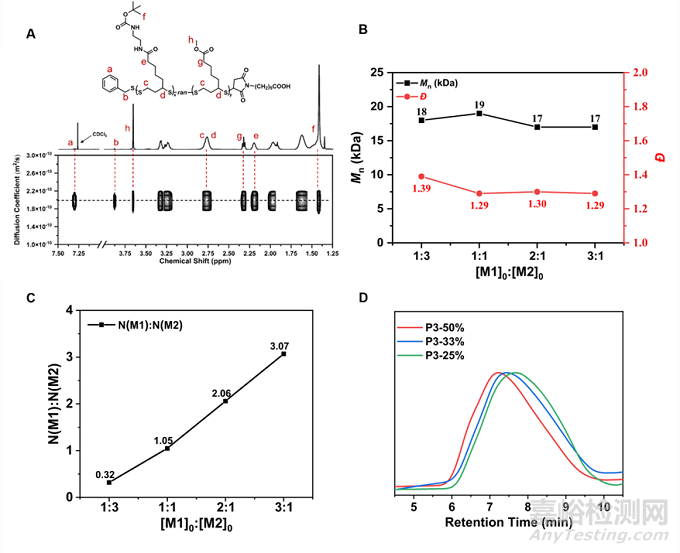
对于抗菌聚合物,阳离子/疏水基团比例的优化对于提升其抗菌性能以及选择性十分重要。基于此,作者进一步合成了含有疏水侧基的阳离子两亲聚二硫化物的无规共聚物,图2 A证实了共聚物的成功合成。如图2 B-D所示,通过控制两种单体M1与M2的投料比,可以高效的合成出分子量与分子量分布接近、聚合物中两种侧基比例可控的无规共聚聚二硫化物。
图2 通过阳离子单体 (M1) 和疏水单体 (M2) 的共聚,合成阳离子疏水两亲聚二硫化物,其阳离子和疏水基团的平衡可通过调整投料比来控制。(A) 共聚物 P3-50% 的 DOSY NMR 谱图;(B) Mn 和 Đ 与 M1 和 M2 比率([M1]0 : [M2]0) 的关系图;(C) 脱保护前共聚物 中 M1 和 M2 的比率与初始投料单体比率([M1]0:[M2]0) 的关系图;(D) 制备型 GPC 纯化后,具有不同疏水重复单元比例(50%、33% 和 25%)的共聚物的 GPC 结果。
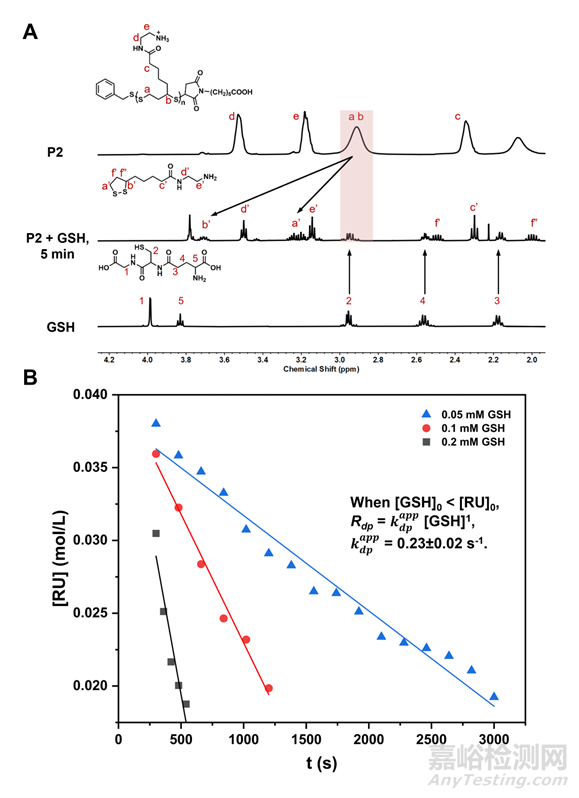
已有研究者表明富含胍的聚二硫化物在还原环境中会快速降解。本文中,作者聚焦于谷胱甘肽(GSH)对聚二硫化物的响应性降解,结果表明在生理环境(pH = 7.4)或细菌感染部位的典型微环境(pH = 5)下,均聚以及共聚的氨基官能化的聚二硫化物可以在5分钟内实现快速降解(图3 A)。同时,作者也探究了该类聚二硫化物在37 ℃ 下的降解动力学。图3 B 表明,当初始GSH的浓度([GSH]0)远小于聚合物中重复单元的浓度([RU]0)时,降解速率Rdp = kdpapp [GSH]1,kdpapp = 0.23±0.02 s-1。
图3 GSH引发的聚二硫化物的降解。(A) P2-55在 37 ℃,pH = 5.0 的条件下, GSH 在 D2O 中处理5分钟前后的 1H NMR 谱图;(B) P2-45与不同浓度的 GSH 在 37 ℃, pH = 7.0 的条件下聚合物解聚的散点图。
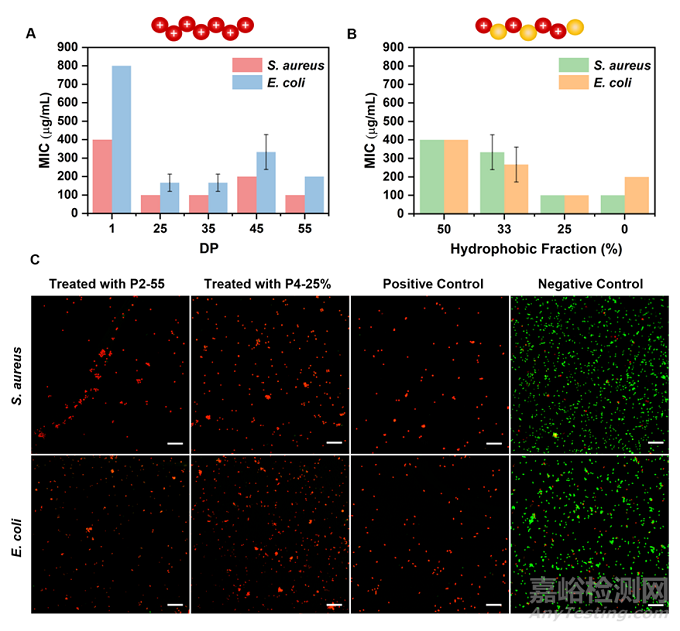
作者随后对脱保护后的氨基官能化阳离子聚二硫化物P2以及含疏水基团的随机共聚物P4进行了抗菌性能研究,并将含不同聚合度的P2以及含不同疏水基团比例的P4的最小抑菌浓度(MIC)汇总在图4 A与B中。结果表明所有的聚合物均显示出对革兰氏阳性(金黄色葡萄球菌)和革兰氏阴性(大肠杆菌)细菌的有效体外抗菌能力,并且被GSH降解的 P2 (DP = 1) 具有低得多的抗菌活性,实现了对聚二硫化物杀菌能力的可控调节。此外,作者也通过荧光共聚焦显微镜观察了聚二硫化物处理2小时后的活死细菌的染色情况,结果显示实验组中几乎所有的细菌均被杀死,表现出氨基修饰的聚二硫化物高效的杀菌能力。
图4 氨基官能化聚二硫化物(P2)和阳离子两亲性无规共聚物(P4)的抗菌活性。(A) 具有不同 DP 的 P2 的 MIC结果。DP = 1 表示 P2 的降解产物;(B) 具有不同疏水基团比例的P4 的 MIC结果;(C) 用 P2-55 或 P4-25% (2× MIC) 处理 2 小时,然后进行活/死染色(合并)的金黄色葡萄球菌和大肠杆菌的荧光共聚焦图像。SYTO 9 染色剂(绿色荧光)通常标记膜完整的细菌(活细菌),而碘化丙啶(PI,红色荧光)仅穿透膜受损的细菌(死细菌)。
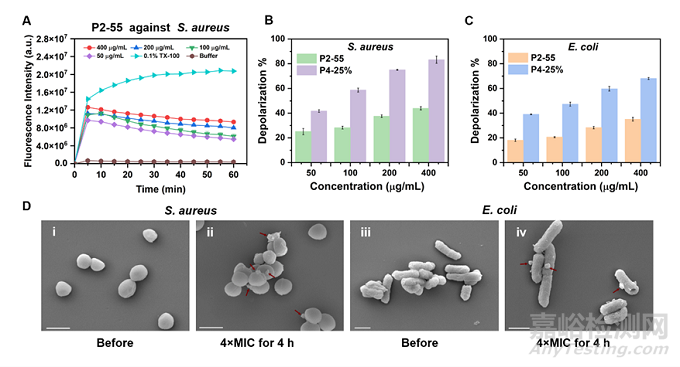
为了探究聚二硫化物的抗菌机理,作者还进行了细胞质膜的去极化实验(图5 A-C)。无论是均聚物还是共聚物,对两种细菌都产生了一定程度的去极化现象,且共聚物产生的去极化现象更为明显。这些结果还表明,具有更高疏水性的 P4-25% 与细胞膜表现出更强的相互作用,并在细胞膜中停留更长时间。结合扫描电子显微镜(SEM)观察到的金黄色葡萄球菌和大肠杆菌的形态变化(图5 D),作者认为富含氨基的聚二硫化物主要通过消除膜电位,诱导膜破裂,最终导致细胞死亡。
图5 抗菌聚二硫化物诱导的细胞质膜去极化和膜破裂现象。(A) P2-55 在用 DISC3(5) 荧光定量的金黄色葡萄球菌中引起细胞质膜去极化;P2-55 和 P4-25% 对金黄色葡萄球菌 (B) 和大肠杆菌 (C) 的膜去极化百分比。(D) 金黄色葡萄球菌和大肠杆菌用 P2-55 在4× MIC 下处理4小时后的扫描电子显微镜 (SEM) 图像。
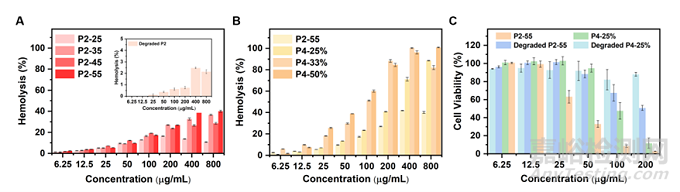
最后,作者进行了体外溶血和细胞毒性测定以评估抗菌聚二硫化物的生物相容性。P2 和 P4 均显示浓度依赖性溶血,且不同聚合度的P2 HC50值均超过 800 μg mL−1。用 GSH 降解后,观察到高浓度下溶血百分比低得多(在 800 μg mL−1 浓度下小于3%),表明降解产物具有很好的生物相容性。在 HeLa 细胞中,测试了 P2-55 和 P4-25%(用 GSH 降解前后)的细胞毒性,结果如图6 C所示。总体而言,作者认为这类的聚二硫化物的生物相容性在 GSH 引发的快速降解后得到极大改善,从而消除了阳离子抗菌聚合物在使用时通常出现的长期毒性和环境危害的潜在风险。
图6 氨基官能化聚二硫化物 (P2) 和阳离子两亲无规共聚物 (P4) 的生物相容性。(A) 具有不同 DP 的 P2和降解 P2后的产物(插图)的溶血结果 (%)。(B) 具有不同疏水比例的 P4 的溶血结果 (%)。(C) 用 P2-55、P4-25%、降解的 P2-55 和降解的 P4-25% 处理的 HeLa 细胞的细胞活力 (%)。
综上所述,在这项工作中,作者通过阴离子开环聚合,合成了一系列分子量与亲疏水基团比例可调、GSH触发后抗菌活性可按需失活并具有强大杀菌能力的氨基官能化聚二硫化物。这类聚二硫化物的可控合成为开发具有选择性和强效杀菌能力的新型抗菌剂搭建了分子平台,为解决抗生素长期存在所带来的多重耐药细菌的进化以及不可避免的细胞毒性等问题提供了可能。