今日头条
和铂CCR8靶向抗体获批临床。和铂医药自主开发的针对G蛋白偶联受体(GPCR)CCR8的单抗药物HBM1022获FDA临床批件。HBM1022可通过抑制CCR8阳性的调节T细胞,启动肿瘤微环境中效应性T细胞的肿瘤特异性杀伤,从而起到治疗肿瘤的作用。HBM1022有望为包括乳腺癌,结肠癌,胃癌,非小细胞肺癌,头颈癌等实体瘤患者提供新的治疗选择。
国内药讯
1.礼来减重新药中国III期研究成功。礼来宣布其每周注射1次的GIP/GLP-1双重激动剂Tirzepatide(替尔泊肽),在用于肥胖或超重中国患者的III期SURMOUNT-CN研究达到主要终点和所有关键次要终点。临床中未出现新的安全性信号,具体数据正在整理当中。去年10月,FDA已授予tirzepatide用于成人肥胖或超重的快速通道资格,礼来目前已向FDA滚动提交减重适应症上市申请。
2.乐普/康诺亚CLDN18.2-ADC早期临床积极。乐普生物与康诺亚合作开发的靶向Claudin 18.2的ADC创新药CMG901在ASCO GI2023年会上公布治疗晚期实体瘤的Ia期临床积极数据。结果显示,CMG901在Claudin 18.2阳性胃癌或胃食管结合部腺癌患者中的客观缓解率达到75%,疾病控制率为100%。中位无进展生存时间(mPFS)和中位总生存时间(mOS)均尚未达到。此外,药物总体耐受性良好。
3.默沙东新型抗凝药在华启动临床。默沙东新型凝血因子XI抑制剂MK-2060在国内首次登记启动一项I期临床,拟评估MK-2060在中国健康成年男性受试者中的安全性、药代动力学和初步疗效。MK-2060既可阻断凝血因子XI的活化,又能抑制XI所介导的下游级联凝血反应。此前,FDA已授予MK-2060快速通道资格,用于降低终末期肾病(ESRD)患者发生重大血栓性心血管事件的风险。
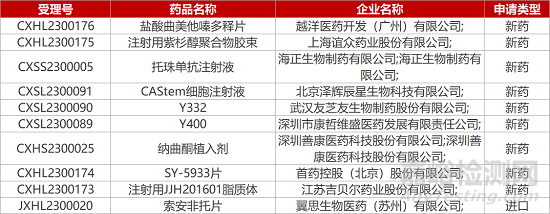
4.再鼎引进TF靶向ADC报IND。再鼎医药与Seagen公司合作开发的3.1类新药“注射用tisotumab vedotin”临床试验申请获CDE受理(JXSL2300032)。tisotumab vedotin是一款靶向组织因子(TF)的抗体偶联物药物(ADC),也是首个靶向TF的宫颈癌新药,已在2021年获FDA加速批准上市。去年年底,该新药在中国登记启动一项国际Ⅲ期临床,旨在复发性或转移性宫颈癌患者中比较tisotumab vedotin与化疗方案的临床疗效改善。
5.武汉友芝友两款双抗报IND。武汉友芝友开发的两款1类生物制品Y332和Y400的临床试验申请获CDE受理。Y332是一款重组抗VEGF/TGF-β双抗,通过同时靶向VEGF和TGF-β,在协同效应下改变癌症患者的免疫抑制性TME,恢复患者失调的抗肿瘤免疫力。Y400是一种抗VEGF/ANG2双抗,武汉友芝友已于2022年7月将Y400的所有权利及资产转让给康哲眼科。
国际药讯
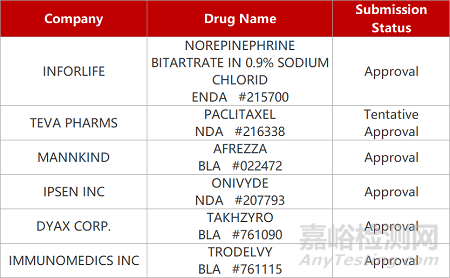
1.武田HAE单抗获批用于儿童。FDA批准武田Takhzyro(lanadelumab)的补充生物制品许可(sBLA)申请,用以预防2岁至12岁以下儿童患者遗传性血管性水肿(HAE)发作。Takhzyro是一款靶向HAE的抗体药物,可特异性结合并抑制HAE患者体内不受控制的血浆激肽释放酶,从而达到预防发病的效果。2018年8月,Takhzyro已获FDA批准上市,用于预防12岁及以上患者的HAE发作。
2.阿片类药物过量抢救疗法报NDA。Orexo公司开发的鼻内抢救药物OX124向FDA递交新药上市申请(NDA),用于阿片类药物使用过量的抢救。OX124含有高剂量纳洛酮,旨在逆转强效的合成阿片类药物(如芬太尼)的作用。在关键研究(OX124-002)中,与肌肉注射的活性对照组相比,OX124中纳洛酮的吸收速度更快、程度更高。
3.杨森FcRn抗体Ⅱ期临床积极。强生旗下杨森(Janssen)靶向新生儿Fc受体(FcRn)的潜在“best-in-class“抗体nipocalimab,在用于治疗高风险出现严重新生儿溶血病(HDFN)孕妇的Ⅱ期临床中达到主要终点。大部分接受nipocalimab治疗的孕妇成功在孕期32周后生下活着的婴儿,并且在整个怀孕期间未接受宫腔内输血(IUT)。此前,该新药已获FDA授予的预防胎儿和新生儿溶血病的孤儿药资格,并已在治疗重症肌无力的Ⅱ期临床中获得积极结果。
4.渤健抑郁症新药获FDA优先审评。渤健与Sage开发的新一代GABAA变构调节剂Zuranolone的上市申请获FDA受理,用于治疗重度抑郁症(MDD)和产后抑郁症(PPD)。FDA同时授予其优先审评资格,PDUFA日期为8月5日。在CORAL研究中,Zuranolone联合标准治疗使MDD患者的17项汉密尔顿抑郁量表(HAMD-17)评分较安慰剂显著改善(-8.9±0.39vs-7.0±0.38,p=0.0004)。在SKYLARK研究中,与安慰剂相比,50mg zuranolone治疗组第15天时HAMD-17评分较基线显著降低(-15.6vs-11.6,p=0.0007)。
5.Idorsia公司脑出血药物欧美Ⅲ期临床失败。Idorsia公司在日本获批上市的脑出血药物Clzosentan,日前在一项欧美开展的Ⅲ期临床中未能达到预期结果。该项研究评估Clzosentan用于预防动脉瘤性蛛网膜下腔出血(aSAH)后延迟性脑缺血引起的并发症的能力。结果显示,在aSAH中,大脑血管变窄,导致血液聚集在大脑表面,从而增加对大脑的压迫。详细数据将在科学文献中公布。
6.安斯泰来更换总裁兼CEO。安斯泰来日前宣布,执行副总裁Naoki Okamura被任命为公司新总裁兼CEO,继续推进CSP 2021(2021-2025财年)战略计划。前总裁兼CEO Kenji Yasukawa升任公司董事会主席。同日,安斯泰来还公布2022年业绩报告,2022自然年全年营收112.45亿美元,其中Xtandi(48.60亿美元)、Prograf(15亿美元)、Betanis/Myrbetriq/Betmiga(14.28亿美元)业绩耀眼。
医药热点
1.广东非免疫规划疫苗接种有新方案。广东省卫健委发布《广东省非免疫规划疫苗接种方案(2023年版)》。新版方案对接种原则、接种方案、其他事项等作出规定,对重组乙型肝炎疫苗等22类疫苗的疫苗作用、推荐接种人群、免疫程序等提出详细的指导意见。据新版方案,2023年,广东新增一款疫苗,该疫苗为2022年新上市的ACYW135群脑膜炎球菌多糖结合疫苗(CRM197载体)。该疫苗可预防A群、C群、Y群和W135群脑膜炎球菌引起的流行性脑脊髓膜炎,推荐适用人群为3月龄至3岁儿童。
2.电子科技大学新添附属医院。四川省肿瘤医院5日举行电子科技大学附属肿瘤医院揭牌仪式。据悉,四川省肿瘤医院与电子科技大学已长期保持良好深度合作关系。未来,双方将在临床医学博士点申报、学科建设、重大科研项目申请与转化等方面,充分发挥电子科技大学与四川省肿瘤医院各自的优势,整合医、工的各类资源,催生新技术,产出大成果,实现新突破。
3.辅助生殖技术将逐步纳入医保范围。针对建议将不孕不育治疗纳入免费医疗的提案,国家医保局近日答复,医保部门始终高度重视人口问题,已将符合条件的生育支持药物如溴隐亭、曲普瑞林、氯米芬等促排卵药品纳入医保支付范国;下一步,国家医保局将逐步把适宜的分娩镇痛和辅助生殖技术项目纳入基金支付范围,减轻不孕不育患者医疗负担。
评审动态
1. CDE新药受理情况(02月07日)
2. FDA新药获批情况(北美02月06日)