您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-12 11:06
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
岸迈PD-L1/OX40双抗国内报IND。岸迈生物自主研发的PD-L1/OX40双抗EMB-09注射液临床试验申请获CDE受理,拟开发用于治疗晚期实体瘤患者。今年3月,该新药已在澳大利亚获批开展I期临床。该研究是一项多中心、开放、多剂量的首个人体临床试验,旨在评估EMB-09在晚期实体瘤患者中的安全性和耐受性,以及药代动力学、免疫原性和抗肿瘤活性。目前,国内同类药物仅有康宁杰瑞的KN052进入临床开发阶段。
国内药讯
1.默沙东PD-1单抗治疗肝癌在华获批。默沙东重磅PD-1抑制剂帕博利珠单抗(可瑞达,Keytruda)获NMPA批准第九项适应症,单药用于治疗既往接受过索拉非尼或含奥沙利铂化疗的肝细胞癌(HCC)患者。Keytruda是FDA批准的首款PD-1抑制剂,可阻断PD-1与其配体PD-L1和PD-L2之间的相互作用,从而激活T淋巴细胞,增强人体免疫系统发现和消灭癌细胞的能力。目前该药已在美国获批超过30种适应症。
2.礼来VEGFR-2单抗治疗肝癌在华获批。礼来VEGFR-2抗体雷莫西尤单抗(希冉择)获国家药监局批准新适应症,用于治疗既往接受过索拉非尼治疗且甲胎蛋白(AFP)≥400 ng/mL的肝细胞癌(HCC)患者。在一项二线治疗晚期肝癌的III期(REACH-2)临床中,雷莫西尤单抗组和安慰剂组的中位OS分别为9.07和6.18个月(HR=0.854),中位PFS分别为2.76和1.45个月(HR=0.488),显示出与全球关键注册临床REACH-2一致的生存获益。
3.万泰鼻喷型新冠疫苗国际III期临床积极。万泰生物与厦门大学、香港大学合作研发的鼻喷流感病毒载体新冠疫苗国际III期临床中期数据积极。针对无免疫史人群,鼻喷新冠疫苗免疫后3个月内绝对保护效力达到55%;针对有免疫史人群,鼻喷新冠疫苗加强免疫后6个月内绝对保护力为82%;60岁以上人群保护效力不弱于18-59岁人群。疫苗总体安全性良好,不良反应率与安慰剂均为12.4%。
4.先为达GLP-1小分子上I期临床。先为达生物口服GLP-1受体激动剂XW014用于肥胖症和2型糖尿病适应症的美国I期临床首例受试者给药。这是一项双盲、随机、安慰剂对照、单/多剂量递增的I期临床研究,其中,多剂量递增(MAD)受试组中将纳入体重指数(BMI)偏高的健康受试者和2型糖尿病患者。该试验旨在评估XW014的安全性、耐受性、食物影响、药代动力学、药效动力学及早期疗效的探索。
5.先声2款生物药国内报IND。先声药业两款1类生物制品(SIM0237和SIM0348)的临床试验申请获CDE受理。SIM0237是一种PD-L1/IL15v双功能融合蛋白,旨在通过PD-L1阻断PD-1/PD-L1免疫抑制通路,同时将IL-15直接递送至肿瘤微环境,激活CD8+T细胞和NK细胞,从而起到解除免疫抑制和激活免疫系统的双重协同作用。SIM0348为一款TIGIT/PVRIG双抗,拥有优化的Fc功能,可高效杀伤TIGIT阳性的Treg细胞。
6.和铂终止特那西普干眼症III期临床。和铂医药日前宣布,该公司已决定按照独立数据监察委员会(IDMC)的建议,基于观察到的疗效不足趋势,结束其特那西普(HBM9036)滴眼液在中国用于治疗中重度干眼症(DED)的III期临床。该项试验过程中并无观察到任何严重安全隐患的信号。HBM9036是一款由HanAll公司开发的肿瘤坏死因子(TNF)受体-1片段型药物,分子量仅为19kDa。
国际药讯
1.TGF-β靶向疗法肺动脉高压III期临床成功。默沙东TGF-β靶向疗法sotatercept用于肺动脉高压(PAH)的III期STELLAR临床研究达到主要终点和多个次要终点。作为背景疗法的附加治疗,sotatercept较安慰剂显著改善患者24周后6MWD(6分钟步行距离)指标;次要终点包括NT-proBNP(通常用来诊断心衰)水平改善、WHO FC(肺动脉高压功能分级)改善或WHO FC维持II级水平等数值也显著改善。安全性与既往II期研究一致。
2.葛兰素史克PD-1单抗肺癌II期临床成功。葛兰素史克PD-1单抗Jemperli(dostarlimab)联合化疗头对头比较Keytruda联合化疗一线治疗转移性非鳞状非小细胞肺癌(NSCLC)的II期PERLA试验达到主要研究终点。主要终点是盲法独立审查委员会根据RECISTv1.1评估的客观缓解率(ORR)。次要终点包括无进展生存期(PFS)、总生存期(OS)等。该试验中dostarlimab的安全性与既往研究一致。详细结果数据将在学术会议上公布。
3.杨森IL-23抗体UC临床长期数据积极。强生旗下杨森制药IL-23抗体guselkumab与TNFα抗体golimumab联用,治疗中重度溃疡性肠炎(UC)的Ⅱa期临床38周治疗数据积极。组合疗法与guselkumab单药或golimumab单药相比,临床缓解率更高(三组临床缓解率分别为47.9%、31.0%和20.8%),内镜评估组织学指标也更优。该公司同时也公布了IL-12/IL-23抑制剂Stelara的长期扩展研究的最终结果。数据显示,在诱导期治疗获得缓解的患者中,症状缓解持续接近4年的患者达到55.2%。
4.新型TCR细胞疗法早期临床积极。Immatics公司靶向PRAME的T细胞受体(TCR)细胞疗法IMA203用于实体瘤的Ⅰb期临床最新结果积极。接受高剂量(超过10亿个TCR-T细胞)IMA203治疗的12个患者中,确认的客观缓解率(cORR)达到50%,对多种实体瘤包括黑色素瘤、头颈癌、葡萄膜黑色素瘤、卵巢癌和滑膜肉瘤患者均具有抗肿瘤活性;而且获得初步缓解的患者中,缓解持续时间均超过12周。
5.赛诺菲引进一款临床前ARC。miRecule公司与赛诺菲将联合开发和商业化“best-in-class”抗体-RNA偶联物(ARC),用于治疗面肩肱型肌营养不良症(FSHD)。此次合作将结合miRecule专有的DREAmiR平台开发的的抗DUX4 RNA疗法和赛诺菲专有的肌肉靶向纳米抗体技术,并利用miRecule的NAVIgGator偶联技术和配方化学将这两个分子连接成ARC,选择性靶向和抑制肌肉组织中的病变部位。根据协议,赛诺菲将获得FSHD疗法的全球独家许可,并全权负责IND研究以及全球开发和商业化活动。此项交易的总金额约4.3亿美元。
6.奥贝胆酸NASH相关肝硬化III期临床失败。Intercept公司FXR激动剂新药奥贝胆酸(Ocaliva)治疗非酒精性脂肪肝炎(NASH)相关代偿性肝硬化的III期REVERSE研究未达到主要终点。与安慰剂相比,Ocaliva组患者纤维化程度达到至少改善1级且未出现NASH恶化的比例不具有统计学意义的显著改善(11.1%和11.9%,vs9.9%)。在安全性方面,最常见的不良反应是瘙痒。2016年5月,FDA已批准该药用于治疗原发性胆汁性胆管炎。
医药热点
1.徐徕担任上海市药监局局长。10月10日,上海市政府发布关于闻大翔、徐徕等同志职务任免的通知,决定任命闻大翔为上海市中医药管理局局长;免去邬惊雷的上海市中医药管理局局长职务。任命徐徕为上海市药监局局长;免去闻大翔的上海市药监局局长职务。根据公开信息,徐徕,女,1969年11月出生,籍贯浙江江平。在职博士研究生学历,理学博士。曾任上海市药监局党委委员、副局长,上海市市场监督管理局副局长、党组成员。
2.北京精神科床位超万张。10月10日是第31个世界精神卫生日,今年的主题是“营造良好环境,共助心理健康”。据北京市卫健委介绍,目前北京已建立精神(心理)诊疗服务的医疗机构共189家,精神科床位数为10956张(配置水平达到5.09张/1万人,较2014年增长11.7%),精神科医师有1746人(配置水平为8.11人/10万人,较2014年增长42.8%),可提供心理治疗/咨询服务的医疗机构达到110余家,并建立121家社会心理服务站和300家职工心灵驿站,覆盖全市16个区。
3.上海公立医院高质量发展40家试点名单公布。10月10日,上海市政府官网发布《上海市深化医改领导小组办公室关于开展上海市公立医院高质量发展试点工作的通知》,并公布遴选确定的40家试点单位名单,以及20家辅导类试点单位,旨在打造公立医院高质量发展的“上海方案”,提高群众和广大医务人员的获得感和满意度。其中,复旦大学附属中山医院、上海交通大学医学院附属瑞金医院、上海交通大学医学院附属仁济医院、上海市第一人民医院、复旦大学附属华山医院等上海市级医院均在试点范围内。
评审动态
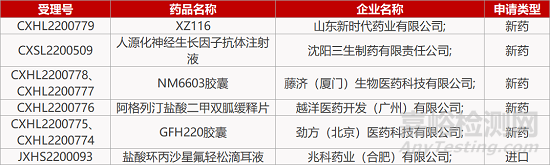
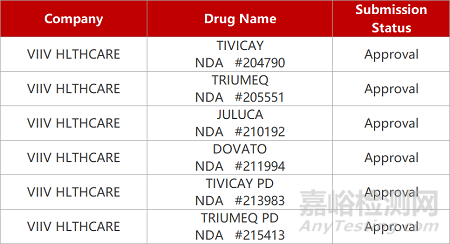

来源:药研发


