您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-12 11:09
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.罗氏新一代C5补体抑制剂在华报产。CDE受理罗氏珂罗利单抗注射液(Crovalimab)的上市申请,用于治疗阵发性睡眠性血红蛋白尿症(PNH)患者。Crovalimab是罗氏通过连续单克隆抗体回收技术(Smart-Ig)工程化改造自主研发的的新一代C5抑制剂,可以阻断补体C5裂解为C5a和C5b,有望抑制补体活化。该新药此前已获CDE纳入优先审评品种名单,有望成为罗氏首款创新药物在中国获得全球首批。
2.武田富马酸伏诺拉生片新适应症报产。武田富马酸伏诺拉生片新适应症上市申请获CDE受理,推测新适应症为与适当的抗菌药物联用以根除幽门螺杆菌(HP)。富马酸伏诺拉生片是一款新型钾离子竞争性酸阻滞剂(P-CAB),此前已在中国获批用于反流性食管炎的初始治疗,以及用于反复发作的反流性食管炎患者的维持治疗。
3.康方CTLA4/PD-1双抗启动肝癌III期临床。康方生物CTLA4/PD-1双抗卡度尼利单抗(AK104)登记启动一项III期临床,评估用于高复发风险肝细胞癌(HCC)根治术后辅助治疗的有效性和安全性。卡度尼利单抗是全球首款基于PD-1的双抗药物,已于今年6月获国家药监局批准上市,用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者。除HCC外,该新药还有多项临床试验正在进行当中,涉及胃癌、鼻咽癌和非小细胞肺癌等适应症。
4.康宁杰瑞PD-L1/CTLA-4双抗上肺癌Ⅱ期临床。康宁杰瑞PD-L1/CTLA-4双抗KN046联合辉瑞阿昔替尼一线治疗晚期非小细胞肺癌(NSCLC)的Ⅱ期临床(KN046-209)首例患者给药。该项研究拟评估这一组合疗法治疗局部晚期或转移性NSCLC患者的有效性、安全性和耐受性。KN046目前正在澳大利亚、美国和中国开展多项临床研究,评估用于治疗NSCLC、胸腺癌、胰腺癌、肝癌、食管鳞癌、三阴乳腺癌等10余种肿瘤的潜力。
5.亦诺微新型溶瘤病毒获孤儿药认定。FDA授予亦诺微医药研发的全新疱疹溶瘤病毒(oHSV)候选产品MVR-C5252孤儿药资格,用于治疗恶性胶质瘤。MVR-C5252是一款针对中枢神经系统肿瘤而设计的溶瘤病毒候选产品,能够靶向杀伤恶性神经胶质细胞,它还可以促进肿瘤微环境的免疫应答,达到最佳的抗肿瘤活性。此前,该候选产品已获得FDA的IND许可,目前处于I期临床研究准备阶段。
国际药讯
1.皮内注射猴痘疫苗获批EUA。Bavarian Nordic公司生产的Jynneos(MVA-BN)疫苗获FDA授予紧急使用授权(EUA),允许18岁及以上的猴痘感染高风险患者皮内注射该疫苗,即每次使用原有剂量的五分之一注射进皮层之间的狭窄空间。该措施可使疫苗剂量总数增加五倍,以应对猴痘疫苗供应不足的情况。Jynneos是FDA批准的唯一一款非复制型天花疫苗,也是世界上唯一一个获批的猴痘疫苗,已于2019年获FDA批准上市,间隔28天皮下注射接种两次用于18岁以上的高危成年人群预防天花和猴痘感染。
2.Tecentriq辅助治疗肺癌Ⅲ期临床积极。罗氏制药PD-L1抑制剂Tecentriq在WCLC2022会议上首次公布用于PD-L1≥1%、Ⅱ~ⅢA期非小细胞肺癌(NSCLC)患者手术和含铂化疗后的辅助治疗的Ⅲ期IMpower010研究总生存(OS)数据。首次分析是在中位随访32个月时,与标准治疗相比,Tecentriq显著改善这类患者的DFS(HR 0.66,P=0.0039),将3年DFS率提高12%。此次公布数据显示,中位随访46个月后,两组中位OS尚未达到,OS HR为0.71,OS曲线区分明显。两组3年OS率分别是82.1%vs78.9%,5年OS率为76.8%vs67.5%。试验中无新的安全性信号出现。
3.BCMA靶向CAR-T骨髓瘤Ⅲ期临床积极。百时美施贵宝与2seventy bio公司开发的BCMA靶向CAR-T疗法Abecma(idecabtagene vicleucel)在治疗复发或难治性多发性骨髓瘤(RRMM)的Ⅲ期临床KarMMa-3达主要终点。与标准治疗方案相比,Abecma显著提高既往已接受2-4线疗法的RRMM患者的无进展生存期;Abecma在关键次要终点总缓解率上亦有所改善。药物的安全性与之前研究一致。2021年3月,FDA已批准Abecma用于上述适应症。
4.抑郁症新药获FDA快速通道认定。FDA授予Relmada公司该新型NMDA受体拮抗剂REL-1017(右美沙酮)快速通道资格,用于单药治疗重度抑郁症(MDD)。REL-1017通过优先靶向过度活跃的GluN1-GluN2D NMDAR通道,有效阻止过量钙离子进入神经元内;同时还能够维持生理性谷氨酸神经传递,有利于恢复对心理健康至关重要的神经元回路。目前,Relmada正处于III期临床开发阶段。
5.新靶点合成致死药物上II期临床。Artios Pharma公司日前启动聚合酶theta (Polθ)小分子抑制剂ART4215联合PARP抑制剂他拉唑帕尼(talazoparib)治疗BRCA缺陷型乳腺癌的概念验证II期研究。这项研究属于ART4215正在进行的全球开放性first in human的I/II期研究的拓展队列,预计2024年将获得BRCA缺陷型乳腺癌的II期数据。Polθ是一种肿瘤特异性DDR靶标,参与微同源介导的末端连接 (MMEJ),在许多肿瘤中过度表达,在健康组织中含量较低。
6.BMS拟19亿美元布局T细胞疗法。百时美施贵宝与GentiBio公司将利用后者专有调节性T细胞平台,合作开发新式工程化调节性T细胞(Treg)候选疗法,拟用于炎症性肠病(IBD)的治疗。GentiBio技术平台能够克服此类疗法的许多局限性,包括内源性调节性T细胞种群的稀有性和可塑性。根据协议,GentiBio将获得预付款,最多达19亿美元的开发与销售里程碑潜在付款。百时美施贵宝将拥有最多三个候选产品的临床开发、注册和商业化授权。
7.弗立特里希氏共济失调新药遭FDA延迟审查。Reata公司开发的Nrf2调节剂omaveloxolone用于治疗弗立特里希氏共济失调(FA)的新药上市申请(NDA)的PDUFA日期被FDA推迟至2023年2月28日。FDA认为需要时间以全面审查和分析Reata公司提交的新数据。FA是一种罕见的遗传性、衰弱性和退行性神经肌肉疾病,通常由frataxin基因的第一个内含子中的三核苷酸重复序列扩增引起。目前尚无治疗FA的疗法获批上市。
医药热点
1.黄果任国家药品监督管理局副局长。人社部官网8月10日发布国务院任免国家工作人员。其中,任命黄果为国家药品监督管理局副局长。免去陈时飞的国家药品监督管理局副局长职务。根据国家药监局官网,黄果,2011年8月,任原国家食品药品监督管理局办公室副主任;2013年12月,任办公厅副主任;2017年4月,任原国家食品药品监督管理总局信息中心(中国食品药品监管数据中心)主任;2017年6月,任信息中心(中国食品药品监管数据中心)党委书记。
2.日本日增新冠感染者首超25万人。据日本电视台10日报道,日本当天新增新冠确诊人数达到250403例,首次超过25万人,刷新历史最高记录,北海道、爱知、兵库等20个地区确诊病例刷新过去最高纪录。日本10日新冠死亡人数为251人,连续两天超200人,累计死亡病例34390例。据日本厚生劳动省统计,截至9日日本共有约190万人居家隔离、入住酒店隔离及住院治疗等。
3.英国检测出更多脊髓灰质炎病毒毒株。英国卫生安全局10日发表声明说,继今年早些时候在伦敦污水样本中检测到“疫苗衍生”2型脊髓灰质炎病毒后,又检测出更多病毒毒株。英国政府关于免疫接种的科学顾问机构建议为伦敦所有1至9岁儿童提供脊髓灰质炎疫苗加强针。目前,英国没有脊髓灰质炎病例报告。
评审动态
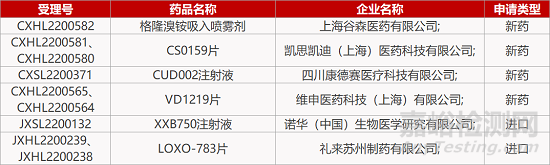
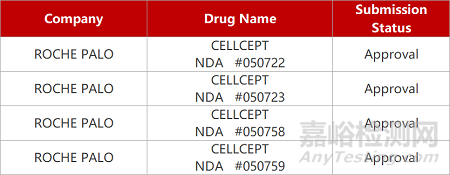

来源:药研发


