您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-10 11:13
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.诺华BAFF-R抑制剂在华启动Ⅲ期临床。诺华BAFF-R抑制剂ianalumab(VAY736)在中国登记启动一项Ⅲ期临床试验。这是国际临床试验的中国部分,旨在评价ianalumab在活动性狼疮肾炎(LN)(ISN/RPS III、IV型活动性肾小球肾炎,伴或不伴并存的V型特征,或单纯性V型膜性LN)成人受试者中的疗效、安全性和耐受性,从而支持狼疮肾炎适应症注册。该项试验的主要研究者由广东省人民医院医学博士余学清担任。
2.开拓ALK-1单抗上国际II期临床。开拓药业ALK-1单抗GT90001联合PD-1单抗Opdivo治疗晚期肝细胞癌(HCC)的国际II期临床试验(NCT05178043)在美国完成首例患者给药。去年1月,GT90001联合Opdivo治疗晚期HCC在ASCOGI 2021上公布的中国台湾II期临床试验数据积极,联合疗法达到40%的客观缓解率(ORR),而且该药安全性良好。在中国,GT90001联合Opdivo治疗晚期HCC的临床试验也获得CDE的默示许可。
3.前沿生物新冠小分子获批Ⅱ/Ⅲ期临床。前沿生物宣布,该公司开发的新冠小分子药物3CL蛋白酶抑制剂FB2001获批开展一项国际Ⅱ/Ⅲ期临床。该试验旨在评估FB2001用于新冠住院患者的有效性与安全性。在中、美两国开展的I期临床初步数据显示,注射用FB2001重复给药可维持预测有效的抗病毒药物浓度,无需联合药代动力学增强剂(如利托那韦等);而且该药安全性和耐受性良好。
4.真实生物与华润双鹤达成战略合作。华润双鹤药业宣布与真实生物签署《战略合作协议》及《阿兹夫定片委托加工生产框架协议》。真实生物所持有的阿兹夫定是抗艾滋病药物,于2021年获得国家药监局批准,目前新增临床试验为抗新冠病毒适应症。目前华润双鹤已向北京市药监局提交药品生产许可证C证核发申请并获审批通过,具备受托加工该产品的生产能力和质量保证能力。后续将由真实生物向相关部门提交有关“增加生产地址”的药品生产许可证B证核发申请。
5.礼新Claudin 18.2-ADC海外授权。礼新医药宣布与Turning Point公司达成一项独家授权协议,Turning Point将获得礼新医药Claudin 18.2-ADC创新疗法LM-302在全球除大中华区及韩国以外国家及地区的开发及商业化权益。根据协议,礼新将获得2500万美元的首付款,研发里程碑付款1.95亿美元及后续商业化里程碑,总金额超过10亿美元,以及产品的销售分成。此外,双方还可共同开发3款后续ADC产品,进一步拓展合作范围。
国际药讯
1.Amylyx渐冻症复方Ⅱ期临床积极。Amylyx公司公布口服复方制剂AMX0035(苯丁酸钠/牛磺酸二醇)治疗肌萎缩侧索硬化症(ALS,又名渐冻人症)的Ⅱ期临床CENTAUR校正安慰剂交叉后的长期生存分析结果。经校正安慰剂交叉,AMX0035与安慰剂相比,患者中位生存期延长10.6至18.8个月;而在ITT分析中,AMX0035与安慰剂相比,患者中位生存期仅延长6.8个月。相关结果发表在医学期刊《Muscle & Nerve》上。今年3月底,该药用于ALS的上市审查已被FDA延迟至6月29日。
2.CD40拮抗剂治疗RA临床成功。Horizon公司CD40配体拮抗剂dazodalibep(HZN-4920)在治疗类风湿性关节炎(RA)的Ⅱ期临床达到主要终点。所有四个dazodalibep给药组患者的DAS28-CRP相对基线的平均变化均具有统计学显著改善;dazodalibep总体耐受性良好。给药后观察到的药代动力学和药效学参数也将为其他dazodalibep研究的给药方案提供信息。详细结果将在医学会议上公布。
3.创新VEGF/DLL4双抗胆道癌Ⅱ期临床积极。Compass公司VEGF/DLL4双抗ES104(CTX-009)联合紫杉醇治疗胆道癌的Ⅱ期临床获积极中期结果。在24例患者中,ES104达到42%的总缓解率和92%的临床获益率;而且该药耐受性良好,具有初步的安全性特征。科望医药拥有该药在大中华区的独家授权,正在中国开展Ⅰ/Ⅱ期临床,评估ES104用于治疗不可手术切除的局部晚期或转移性结直肠癌的安全性和有效性。
4.赛诺菲渐冻人症FIC新药进入Ⅱ期临床。赛诺菲中枢神经系统(CNS)渗透性RIPK1小分子抑制剂SAR443820(DNL788)针对肌萎缩侧索硬化(ALS,又名渐冻人症)开展一项Ⅱ期临床。在健康受试者中进行的Ⅰ期临床中,SAR443820在耐受性良好的剂量下,表现出与靶点的强力相互作用。此前,FDA已授予SAR443820治疗ALS的快速通道资格。赛诺菲还计划在多发性硬化患者中启动Ⅱ期临床试验。
5.Dianthus完成融资推进新一代补体药物临床。Dianthus公司宣布完成1亿美元A轮融资,主要用于将其主打项目DNTH103推进至临床阶段。DNTH103是一款选择性靶向处于激活状态的补体C1s蛋白的新一代单抗药物。它可能允许更低剂量给药,并且降低皮下注射频率。此轮融资还将用于加快该公司治疗严重和罕见自身免疫性疾病的管线项目开发。
6.FDA撤销罗米地辛治疗PTCL的加速审批。FDA撤回百时美施贵宝注射用Istodax(罗米地辛)用于外周T细胞淋巴瘤(PTCL)适应症的加速批准。罗米地辛是新基开发的一种组蛋白去乙酰化酶抑制剂(HDACi),属于表观遗传疗法。由于在验证性III期临床中,与CHOP(环磷酰胺、多柔比星、长春新碱、泼尼松)相比,罗米地辛联合CHOP一线治疗PTCL 患者未达到无进展生存期的主要终点。去年8月,百时美施贵宝已宣布从美国撤回Istodax治疗PTCLI的适应症。
医药热点
1.河南多政策鼓励生三孩。近日,河南省出台《河南省优化生育政策促进人口长期均衡发展实施方案》。该省将参保女职工生育三孩的费用纳入生育保险支付范围,将3岁以下婴幼儿照护费用纳入个人所得税专项附加扣除,并探索制定根据养育未成年子女负担情况实施差异化租赁和购买房屋的优惠政策。
2.美国CDC公布2021年新冠病死人数。2022年4月29日,美国疾控中心(CDC)周报报告2021年美国新冠病死率。报告显示,2021年COVID-19作为美国根本死因(underlying cause)或者促死原因(contributing cause)的死亡人数为460,513例,比2020年的384,536例增加20%,且以25-54岁的中青年增幅最高;2021年美国COVID-19病死人数更多,主要是由于新冠病毒的突变;新冠是2021年美国人第三位的根本死因,但其他疾病亦不容忽视。
3.国内首个分子医学专业委员会成立。5月8日,中国科学院基础医学与肿瘤研究所分子医学高峰论坛在杭州召开,会上,中国化学会分子医学专业委员会正式成立。这是国内首个分子医学专业委员会,将系统地开展学科规划、科学研究和人才培养及学术交流,集中一支专业、全面、多学科综合交叉的人才队伍进行学科设计、协同创新,为生命健康领域基础科学重大发现和重大疾病诊疗等问题的解决贡献力量。当日,浙江省医学会分子医学分会也同时成立。
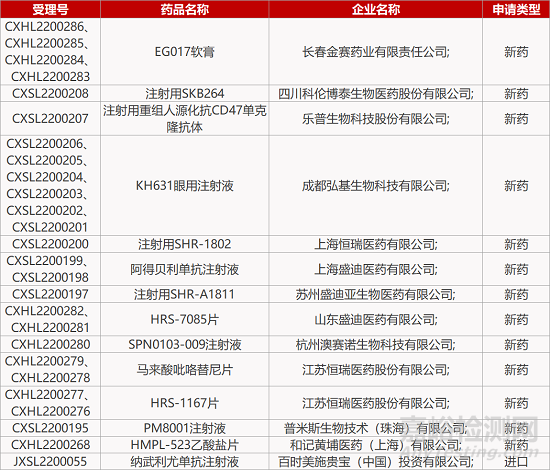
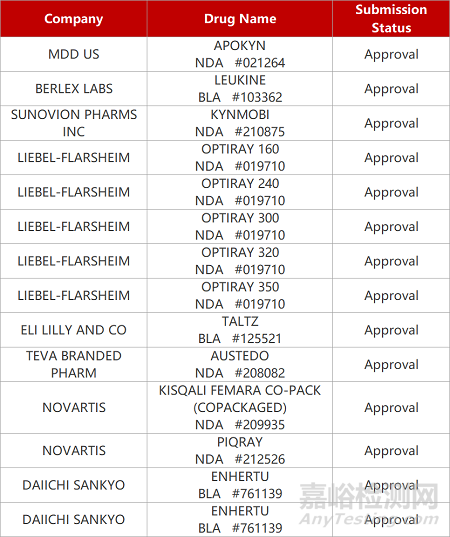
评审动态

来源:药研发


