您当前的位置:检测资讯 > 热点事件
嘉峪检测网 2022-04-05 20:30
雅培宣布其无导线起搏器----Aveir获FDA批准上市,用于治疗缓慢性心律失常患者。这是继美敦力的Micra系列之后,雅培成为第二家获得批准上市的无导线起搏器企业。

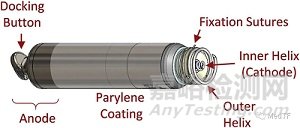
Aveir上市之路崎岖,其前身Nanostim因为质量问题被迫退市。因此雅培不得不对Nanostim进行升级优化,解决前身的质量问题(电池提前耗竭、按钮(Docking Button)脱落)。同时优化产品性能,以便和美敦力的Micra系列进行竞争。
年前雅培开启一项双腔无导线起搏器研究,旨在解决两个无导线起搏器的同步困难问题。
为了解决这个问题,雅培开发“i2i technology”技术。“i2i technology”能够实现两个无导线起搏器之间相互通讯(一个位于右心室,一个位于右心房)。从而实现同步调节心室之间的心率,并实现真正的双心室无导线起搏。

Aveir
Aveir是目前为止第三款成熟无线起搏器,前两款为分别为美敦力的Micra VR 和 Micra AV 。
Aveir是世界上唯一一款具有独特映射功能的无导线起搏器,可在放置前评估正确定位。
Aveir旨在提高心室节律-仅在需要需要时才触发电脉冲,以使缓慢的心脏重回正轨,而不是保持恒定的频率。Aveir螺旋式锚定设计,可以允许医生在电池耗尽时,通过静脉快速取出,无需开胸。
根据雅培介绍Aveir 是一款具有更长电池寿命的起搏器(电池寿命长达12至13年),是同类产品的两倍。
目前数据显示Aveir主要克服了Nanostim电池不稳定、按钮脱落等问题,至于其它性能和Nanostim类似。
Aveir临床研究
Leadless II IDE 研究评估了 Aveir 无线起搏器在心律异常患者中的应用。研究数据显示 Aveir 达到了其预先指定的主要终点。
Leadless II 在美国、加拿大和欧洲的 43 个中心招募的 200 名患者,随访周期为六周,并对主要安全性和有效性终点进行分析。结果显示:
98% 的患者成功植入了 Aveir。
在植入后六周,96% 的患者无严重并发症,95.9%患者达到可接受的治疗效果。
在 96% 的临床病例中,医生能够在第一次或者通过一次重新定位,即可准确定位植入。

来源:MedTF


