您当前的位置:检测资讯 > 热点事件
嘉峪检测网 2022-03-30 22:37
3月30日消息,国家药品监督管理局对外发布《关于调整《医疗器械分类目录》部分内容的公告(2022年第30号)》(以下简称“《公告》”)。
其中,值得关注的是,此次发布的《医疗器械分类目录》部分内容调整表对部分医美产品监管类别做出调整,具体如下:
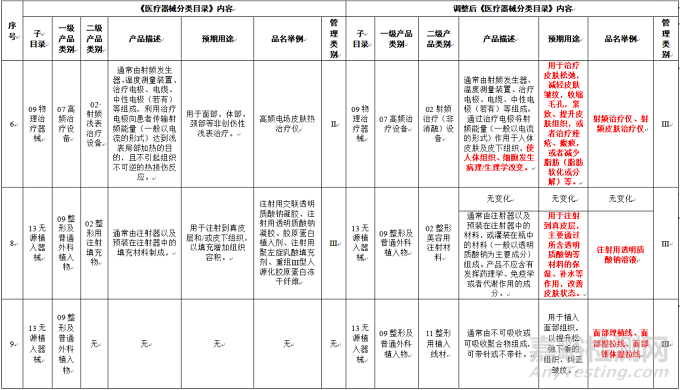
▲《医疗器械分类目录》部分内容调整表对部分医美产品监管类别做出调整(来源:医疗器械标准管理中心)
部分医美产品类别监管调整
1、射频治疗仪、射频皮肤治疗仪,用于治疗皮肤松弛,减轻皮肤皱纹,收缩毛孔,紧致、提升皮肤组织,或者治疗痤疮、瘢痕,或者减少脂肪(脂肪软化或分解)等,明确按照III类器械监管。子目录为09-物理治疗器械,一级产品类别为07-高频治疗设备,二级产品类别为02 射频浅表治疗设备;(推荐阅读:注意了 | 射频美容类器械产品监管类别可能要调整!)
2、新增面部埋植线、面部提拉线、面部锥体提拉线品名举例,用于植入面部组织,以提升松弛下垂的组织,纠正皱纹。按照III类器械监管。子目录为13-无源植入器械,09-整形及普通外科植入物;
4、注射用透明质酸钠溶液,用于注射到真皮层,主要通过所含透明质酸钠等材料的保湿、补水等作用,改善皮肤状态,明确按照III类器械监管。子目录为13-无源植入器械,09-整形及普通外科植入物,二级产品类别为02整形用注射填充物;
“水光针”:正走向合规!
在医疗美容领域,透明质酸钠被作为组织填充剂注射至面部组织内,可以起到支撑填充的作用,从而达到纠正皱纹的目的。CMDE此前曾对外发布《医美相关产品问题答疑》(以下简称“《问题答疑》”)。(推荐阅读:关注 | CMDE针对“透明质酸钠产品”相关审评答疑汇总)
《问题答疑》中披露,境内已批准上市的以透明质酸钠为主要成分的填充剂产品主要有:1)以交联透明质酸钠为主的:“注射用交联透明质酸钠凝胶”、“注射用修饰透明质酸钠凝胶”。2)以非交联透明质酸钠为主要成分的:“注射用透明质酸钠复合溶液”;3)以及含有透明质酸钠的:“医用羟丙基甲基纤维素-透明质酸钠溶液”、“医用透明质酸钠-羟丙基甲基纤维素凝胶”、“医用含聚乙烯醇凝胶微球的透明质酸钠-羟丙基甲基纤维素凝胶”、“含左旋乳酸-乙二醇共聚物微球的交联透明质酸钠凝胶”等。上述产品批准的适用范围绝大多数产品用于纠正中重度鼻唇沟,少数用于纠正额部皱纹,极少数用于丰唇,隆鼻,面中部注射填充,以及纠正颈部或手部皱纹。
其中,值得关注的是,因透明质酸钠具有较强的亲水性,所以医疗美容行业也会利用其进行“锁水”。如以透明质酸钠为主要成分的溶液注射至面部真皮浅层以改善皮肤状态——“水光针”。《问题答疑》强调,截止目前,我国尚没有按医疗器械监管并获批上市的合法“水光针”植入剂。
如今,《医疗器械分类目录》部分内容调整表已完全落实。未来,可以预见的是,迈向合规的水光针,必将成为医美行业的下一个增长极。而等待我们的就是:谁将获得国内首款、合法“水光针”?花开须有时,唯有静待之。我们拭目以待,静等花开!

来源:Medactive


