您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-09-14 13:42
我国2019年修订的《药品管理法》首次在法律层面提出附条件批准上市,标志着我国正式实施附条件批准上市制度。本文通过比较我国与欧美地区附条件批准上市药品的法规与技术要求,借鉴欧美地区对附条件批准化学药品的药学审评经验,探讨我国附条件批准上市化学药品的药学审评技术要求。
附条件批准上市药品是指用于治疗严重危及生命且尚无有效治疗手段的疾病以及罕见病的药品、公共卫生方面急需的药品,现有临床研究资料尚未满足常规上市注册的全部要求,但药物临床试验已有数据显示疗效并能预测其临床价值,因临床急需,在规定申请人必须履行特定条件的情况下,可基于替代终点、中间临床终点或早期临床试验数据而批准上市。其目的是缩短药物临床试验的研发时间,提早应用于无法继续等待的急需患者。
1992 年,美国FDA 为解决未满足的医疗需求首创了加速批准制度(Accelerated Approval),该制度允许使用合理的替代终点或中间临床终点来预测试验药物的临床疗效,但由于这些药物在临床研究中尚未真正观察到临床获益,通常会在药品上市后,要求申请人完成确证性临床试验以证明其临床获益,保证公众用药安全、有效[1]。
2006 年,欧盟EMA 同样为解决未满足的医疗需求制定了附条件批准上市程序(Conditional Marketing Authorisation),允许基于不全面(相比于通常要求)但能够初步证明药物获益大于风险的临床试验数据而获得批准,上市后应通过完整的临床试验以证明药物的安全有效[2]。
我国2019 年修订的《药品管理法》首次在法律层面提出附条件批准上市,2020 年7 月1 日实施的新版《药品注册管理办法》界定了附条件批准上市的适用范围与上市后继续研究要求,标志着我国正式实施附条件批准上市制度,同年发布的《药品附条件批准上市技术指导原则(试行)》明确了附条件批准上市的技术要求。自实施附条件批准上市以来,诸如马来酸吡咯替尼、泽布替尼、奥布替尼等多个原创新药,特别是新型冠状病毒疫苗的附条件批准上市,加快了一大批具有突出临床价值的急需药品上市进程,尽早满足公众用药的迫切需求。但与欧美相比,我国附条件批准上市的审评实践处于起步阶段,为更好地开展附条件批准化药的药学审评,本文整理了欧美地区附条件批准上市药品的法规与技术要求,梳理了欧美监管机构公开的附条件批准上市药品审评信息,探讨我国附条件批准上市化药的药学技术要求。
1 国内外附条件批准上市法规与药学技术指南
1.1 美国加速批准制度(Accelerated Approval)
1992 年,FDA 启动了加速批准制度,允许使用合理的预示患者获益的替代终点为基础给予新药上市许可,申请人在药品上市后应继续完成确证性临床试验以证明其临床获益。
美国联邦法规第21 章314 节Subpart H 规定了加速批准的适用范围等;2014年5 月发布的重大情况下加速批准项目指南-化药和生物制品(Guidance for Industry Expedited Programs for Serious Conditions – Drugs and Biologics)中指出包括加速批准的界定条件、加速批准终点、批准依据等信息,但上述法规与技术指南均未提及加速批准上市需满足的药学研究要求[3]。
1.2 欧盟附条件批准上市程序(Conditional Marketing Authorisation)
欧盟2006 年发布的委员会507/2006 号条例[Commission Regulation(EC)No 507/2006]实施附条件批准上市程序(Conditional Marketing Authorisation),其中,对于授予附条件批准的药品,不充分的临床前或药学研究数据仅在用于危害公众健康的紧急情况的药品才能被接受[2]。
欧盟关于实施委员会507/2006 号条例中符合No 726/2004 条例规定范围内的人用药附条件批准上市时的科学应用和必要的实践安排技术指南[Guideline on the scientific application and the practical arrangements necessary to implement Commission Regulation (EC) No 507/2006 on the conditional marketing authorisation for medicinal products for human use falling within the scope ofRegulation (EC) No 726/2004]中,规定附条件批准上市药品需提交完整的药学研究数据;用于应急时,如药学研究数据不完整,也可附条件批准上市,此种情形需个案评估,结合药品的获益-风险进行评价[4]。
英国药品和健康产品管理局(MHRA)于2019 年3 月发布的附条件批准上市指南(Guidance for UK Conditional Marketing Authorisation Applications)中明确参照欧盟委员会507/2006 号条例[Commission Regulation (EC) No 507/2006]的要求[5],可见英国的附条件批准上市技术要求与欧盟一致。
1.3 我国附条件批准上市程序
原国家食品药品监督管理总局于2016 年发布(现已废止)的《食品药品监管总局关于解决药品注册申请积压实行优先审评审批的意见》中,提出对于治疗严重危及生命的疾病且尚无有效治疗手段、对解决临床需求具有重大意义的新药,若根据早期临床试验数据,可合理预测或判断其临床获益且较现有治疗手段具有明显优势,允许在完成Ⅲ期确证性临床试验前有条件批准上市[6]。
2019 年修订的《药品管理法》第二十六条则首次在法律层面定义了附条件批准上市,即“对治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,可以附条件批准,并在药品注册证书中载明相关事项”[7]。
2020 年实施的《药品注册管理办法》第六十三条规定了可以申请附条件批准上市的前提条件:(一)治疗严重危及生命且尚无有效治疗手段的疾病的药品,药物临床试验已有数据证实疗效并能预测其临床价值的;(二)公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的;(三)应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的其他疫苗,经评估获益大于风险的[8]。
国家药品审评中心2020 年11 月19 日发布的《药品附条件批准上市技术指导原则(试行)》提出了附条件批准上市药品的技术要求,对于药学研究要求:“通常,附条件批准上市药品的药学、药理毒理学要求与常规批准上市药品相同;对于公共卫生方面急需的药品或应对重大突发公共卫生事件的药品,可根据具体情况,结合药品的获益-风险进行评价”[9]。
1.4 我国附条件批准药学技术要求与欧美的比较
美国自1992 年实施加速批准上市制度,美国联邦法规与技术指南对加速批准的适用范围、批准程序与批准原则等要求予以明确,尽管未对药学研究的程度提出要求,但美国《联邦食品、药品和化妆品法案》505(b)(1)对新药生产与质量控制的规定以及FDA 完备的技术指南体系保证了上市新药药学研究的全面性。欧盟法规和指南中要求一般情况下附条件批准药品应提供完整的药学和临床前研究资料;仅在紧急情况下,如无法提交完整的药学和临床前研究资料,经个案讨论后,可能授予附条件批准。我国2019 年修订的《药品管理法》首次在法律层面提出附条件批准上市,2020 年实施的《药品注册管理办法》界定了附条件批准上市的适用范围与上市后继续研究要求。《药品附条件批准上市技术指导原则(试行)》中明确提出了附条件批准药学研究应达到的程度,与美国加速批准、欧盟附条件批准上市并无本质区别。
2 附条件批准上市药品药学审评分析
2.1 美国药学审评信息
FDA 鼓励申请人在药物开发初期针对加速批准条件的潜在资格、拟定的替代终点或中间临床终点、临床试验设计以及验证试验的计划和进行方面与FDA进行沟通。寻求加速批准的申请人可能还需要尽快为药物开发的药学研究与生产、开发必要的辅助诊断等方面做出准备。
对于药学方面,FDA 认为药物一旦满足加速批准的条件,申请人需要加快药学方面的开发计划,以适应临床试验的快速进展。申请人应当与FDA 针对加速批准药物的生产和质量控制进行充分的沟通交流,确保药学方面满足批准上市的要求[10]。
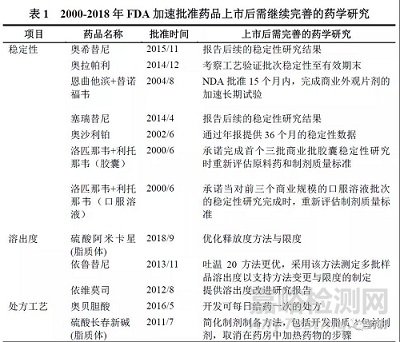
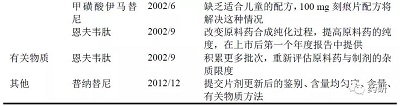
FDA 公开了2000 年至2018 年加速批准上市的105 个药品的审评与批准信息,部分药品的批准信(Approval Letter)注明了需要在上市后继续完善的药学内容(详见表1),大多集中在补充后续稳定性试验数据等方面,还有一些药品的处方工艺、杂质控制也需要继续优化,但是均属于质量提升的范畴。
图片【网络】药品研发质量管理体系建立、实施及案例分享
通过调研FDA 公开的105 个加速批准上市药品的审评文件[11],发现在关键临床前以及申报上市前的pre-NDA 沟通交流时,即针对起始物料的指定、质量标准的制定、稳定性试验结果等重要药学问题进行交流,明确了申报上市应满足的药学要求。FDA 在审评过程中发现的药学主要缺陷包括起始物料的质量控制(部分药品要求起始物料前移)、原料药工艺过程控制不全面、有关物质与含量测定方法与限度、遗传毒性杂质的研究与控制、稳定性数据不支持有效期、容器密封性与相容性研究等,FDA 均发出缺陷信(Information Request)要求申请人补充完善,使药学研究具备批准上市的要求。
2.2 欧盟药学审评信息
通过收集整理EMA 公开的2006 年至2016 年附条件批准上市的21 个化学药品的公开审评信息,发现除依维莫司(Votubia®)、克唑替尼(Xalkori®)以外,其他药品均无上市后的药学研究要求。尽管依维莫司、克唑替尼的药学研究存在一定的问题,但EMA 审评认为并不影响对产品获益风险平衡的评估而批准附条件上市。下文分别以依维莫司、克唑替尼为例进行说明。
【网络】药品研发质量管理体系建立、实施及案例分享
Votubia®是依维莫司片剂,有2.5,5,10 mg 3 种规格,由诺华公司于2010年7 月通过集中审评程序提出上市许可申请[12],申请适应证为治疗与结节性硬化症(TS)相关的室间隔膜下巨细胞星形细胞瘤(SEGA),EMA 审评认为该产品质量研究方面还需要重新评估原料药的杂质限度,更新固体分散体的质量标准,但是这些问题不会影响现阶段产品的获益风险平衡。
Xalkori®是克唑替尼胶囊剂,有200 和250 mg 两种规格,由辉瑞公司于2011年7 月通过集中审评程序提出上市许可申请,申请适应证为间变性淋巴瘤激酶(ALK)阳性的晚期非小细胞肺癌(NSCLC)。EMA 审评认为,应当进一步收严克唑替尼原料药的金属钯残留限度,但考虑拟定的限度不会影响临床获益大于风险的评估结论,因此要求申请人在上市后继续积累商业批次的金属钯的分析数据,严格制定钯的限度[13]。
2.3 综合分析
美国自1992 年实施加速批准上市,通过FDA 公开的最近20 年加速批准药学审评信息,可以看出,美国FDA 对于影响药品安全性的关键质量要素,如起始物料的指定与质控、工艺过程控制、有关物质与遗传毒性杂质研究等需要在批准前完成,满足批准上市的要求;因上市后还需要继续完成临床研究,对于稳定性数据更新、分析方法优化和限度制定等质量提升要求可在上市后继续优化完善。与美国相比,欧盟附条件批准上市化药的药学研究基本全面,上市后需要继续完善药学研究的药品相对较少,可能与欧盟对附条件批准上市的相关法规与指南要求有关,仅有个别药品需要在上市后完善药学研究,内容多为收紧杂质限度等,但整体上不会影响药品的安全有效。
3 对我国附条件批准上市化药药学技术要求的思考
2018 年以来,我国已有多个全球原创新药获得附条件批准上市,为临床治疗提供了新的手段,更好地满足了患者用药可及性。随着鼓励创新与药品审评审批制度改革的不断深入,我国创新药的申请量不断呈攀升趋势,相信未来会有一定数量的创新药申请附条件批准上市。与欧美相比,我国实施附条件批准的时间较短,此类药物的研发与技术审评都处于探索阶段。与常规批准的新药相比,附条件批准上市药品的研发时间短,积累的研发、生产及质量控制数据有限,药学审评面临更严峻的挑战。如何在保证附条件批准药品尽早上市,更好地满足临床急需患者用药可及性的同时,有效地开展药学审评,确保药品的质量可控,是我国药品审评机构当前亟需解决的问题。欧美地区实施附条件批准/加速批准已经多年,吸收借鉴欧美监管机构的审评经验,对我国开展附条件批准化药药学技术审评具有重要的现实意义。
质量可控是保证药品安全有效的前提之一。从生产与质量控制的角度看,批准上市的药品应当确保生产工艺可持续、稳定地生产质量均一的产品,因此附条件批准上市与常规批准上市的药学的技术要求没有根本区别,药品的批准上市原则上不应附带上市后的药学研究要求,只有公共卫生方面急需的药品或应对重大突发公共卫生事件药品的药学要求可根据实际情况结合获益-风险进行评价。在法规与指南方面,我国附条件批准上市化药药学的要求与欧美基本相同,说明监管机构对于上市药品的药学要求是一致的;在技术要求方面,欧美附条件批准化药的药学研究较完整,上市后继续完善的内容均不涉及重大的药学研究缺陷。按照我国附条件批准药物的技术要求,通过借鉴欧美附条件/加速批准上市药品的审评经验,结合国内近期附条件批准上市创新化药的药学审评实践,对我国附条件批准化药的药学技术审评,本研究认为:(1)应当以现行的药学技术要求为基础,对于影响药品有效性与安全性的关键药学问题,如起始物料的指定与质控、处方与工艺过程控制、杂质研究与方法验证、溶出度等方面均应满足获批上市的要求,可在上市后进行质量提升的内容不应对药品的质量控制产生根本的影响;(2)加快国内药学通用技术指南的起草与修订,为附条件批准上市的药学研究提供充足的技术保障,更好地服务药学研究与技术审评工作;(3)加强附条件批准上市申请前以及审评过程的药学沟通交流,针对重大的药学研究内容进行充分的沟通交流,确保药学研究满足批准上市的要求。申请人也应当重视审评机构的沟通交流意见,确保满足上市要求的重要药学问题在批准前得以解决。
笔者在附条件批准上市化药的药学审评实践中,发现绝大多数申报药品在首轮审评的重大药学研究问题较多,需要通过书面补充资料的形式提交充分的研究内容,在一定程度上增加了技术审评的周期,也推迟了药品获批上市的时间。结合欧美地区附条件批准/加速批准化药的公开审评信息以及审评工作实践,笔者认为对于我国附条件批准上市化药药学的具体技术要求,总体应符合我国已发布相关药学指导原则的要求,重点应关注以下内容:
3.1 生产工艺的稳健可控
药品的质量可控是保证其安全、有效的基础,而药品质量的稳定可控只有通过良好的生产工艺与过程控制来保证。要获得良好的生产工艺与过程控制,需要通过系统而深入的工艺研究,建立一个能够持续生产出预期质量的商业化生产工艺。审评工艺资料的目的,是为了确认拟上市药品是如何生产并控制其质量的;申报工艺是否具备商业规模生产的合理性与可行性;通过对药品生产工艺与过程控制信息,综合评价药品的质量控制体系是否能够全面、有效地控制拟上市药品的质量。
3.1.1 原料药生产工艺
原料药的合成路线应具有理论或试验依据,商业化生产指定的起始物料应符合ICH Q11 的有关要求,对原料药质量产生重大影响的工艺步骤应纳入注册工艺;根据起始物料生产商的制备工艺以及物料自身的稳定性,对起始物料的潜在杂质进行全面分析,优选对杂质分离与检出能力强的方法,系统地考察起始物料杂质在原料药生产工艺中的转化与清除,根据生产工艺对杂质(包括转化产物)的清除能力,结合中间体与原料药的杂质控制,合理制定起始物料的杂质限度。
工艺开发阶段应当对各反应步骤进行全面深入的研究,确定影响产品质量(如杂质、晶型、粒度等)的关键工艺要素(如物料配比、反应参数等),鼓励通过DoE 设计等系统的研究加深对工艺的理解;伴随工艺研究的进展与生产规模的放大,对工艺参数的控制范围进行必要的调整优化,重点针对生产规模的放大可能引起关键步骤或关键工艺参数的调整进行针对性研究,确定影响关键质量属性的工艺参数控制范围,按照工艺验证方案在商业化生产线上进行工艺验证,进一步确认生产工艺的持续稳定。
3.1.2 制剂处方工艺
剂型的选择应综合考虑原料药的理化性质与生物学特性、临床适应证、用药人群等因素。根据ICH Q8 对药品的研发的要求,对于制剂的处方工艺研究,首先应明确目标药品的质量概况(QTPP),基于剂型、规格、给药途径特征,确定影响目标药品有效性与安全性的关键质量属性(CQA,如有关物质、溶出度、含量均匀度等),结合剂型特点、原辅料理化性质对处方工艺进行研究,通过试验研究确定对制剂质量起到关键作用的处方因素并加以控制,加深对影响药品CQA 与稳定性的关键工艺参数的理解,确认影响产品质量的工艺参数及可接受的操作范围,进行批量放大的质量风险分析,固定商业化生产的生产工艺。
3.2 质量研究与质量标准
质量标准的项目设置既要参考标准要素设置常规项目,也要充分考虑品种具体特点,制定针对性的质控项目,注重检测项目的互补性、原料药与制剂标准的关联性。对影响安全有效性的质控项目研究要充分,随着工艺开发过程的知识和数据的积累,对制备工艺以及降解途径所涉及反应机制的深入理解,分析药品可能存在的杂质概况,筛选验证杂质分析方法对已知杂质、含适量杂质样品(粗品/结晶母液、强制降解产物、原辅料相互作用产物等)的分离能力,选择专属性强、灵敏度高的方法,根据动物安全性试验支持的杂质水平以及ICH Q3A/B 合理制定杂质控制限度,按照ICH M7 进行致突变杂质的控制;溶出度条件和限度应具备区分不同质量的能力,溶出曲线的对比符合《普通口服固体制剂溶出度试验技术指导原则》的要求,积累临床前、临床试验以及商业规模生产的质量分析数据,根据不同阶段制备样品的研究数据不断修订完善质量标准,有效地控制产品的质量。
药品自研发直至上市,与药品有效性、安全性相关的重要质量属性是否保持稳定,是评价药品是否具备上市条件的重要考量。通过临床批次与商业生产的处方工艺、生产规模、质量数据等比较,建立临床批次与商业生产批次的质量联接。由于创新药的开发通常伴随处方工艺、生产地址、质量标准、包装材料等变更,需要充分评估变更对药品重要质量属性的影响并开展相应的桥接研究,全面对比变更前后的药品质量,确保商业生产批次与临床批次质量的一致性。
3.3 稳定性
稳定性试验的最终目的是确定药品的包装材料、贮藏条件和有效期,试验样品要能够代表商业化产品,试验条件的设置符合ICH Q1 的要求,重点考察影响原料药与制剂特性的关键质量属性,分析方法应当经过验证,关注加速与长期试验过程中的关键项目变化趋势,对于注射剂还要注意包装材料成分在稳定性考察时间范围内的迁移水平不得高于可接受的安全阈值,容器密封性应确保产品的无菌,保证上市药品在拟定贮藏条件和有效期内的安全有效。
4 结语
我国自实施附条件批准上市制度至今,已有多个原创新药获得附条件批准上市。通过比较国内外附条件批准上市的法规与技术要求,可以看出我国附条件批准上市的药学技术要求与美国加速批准、欧盟附条件批准上市并无本质区别。我国已加入国际人用药品注册技术协调会(ICH),并于2021 年连任ICH 管理委员会成员,我国对创新药的监管正逐步与国际接轨,急需加快药学通用技术指南的起草与修订,更好地支持附条件批准上市的药学研究与技术审评。




来源:中国药科大学学报


