您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-04-14 14:12
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
复宏汉霖阿达木单抗葡萄膜炎适应症获批。国家药监局批准复宏汉霖阿达木单抗注射液(汉达远®)新增适应症,用于治疗成人非感染性中间、后和全葡萄膜炎。这也是汉达远继类风湿关节炎、强直性脊柱炎和银屑病三项适应症之后获批的第四项适应症。在中国,除原研产品艾伯维的修美乐外,还有海正药业的安健宁、百奥泰的格乐立同类产品获批上市。2020年度,阿达木单抗国内销售金额约为人民币1.90亿元。
国内药讯
1.君实PD-1尿路上皮癌适应症获批。君实生物「特瑞普利单抗」第3个适应症获 NMPA批准,用于治疗既往接受过治疗的局部进展或转移性尿路上皮癌(UC)。今年3月,君实已与阿斯利康达成推广协议,授予阿斯利康特瑞普利单抗在中国大陆地区非核心市场的推广权以及尿路上皮癌适应症的全国独家推广权。此外,特瑞普利单抗联合化疗一线治疗复发或转移性鼻咽癌新适应症已申报上市,联合化疗一线治疗晚期非小细胞肺癌(NSCLC)也达到临床终点,预计很快将提交上市申请。
2.信达PD-1二线治疗非小细胞肺癌III期数据公布。信达生物与礼来在AACR-2021年会上公布双方联合开发的PD-1达伯舒®(信迪利单抗注射液)用于二线治疗晚期鳞状非小细胞肺癌的III期临床ORIENT-3积极结果。与多西他赛相比,达伯舒®显著延长总生存期(OS),两组中位OS分别为11.79和8.25个月(HR=0.74, 95% CI: 0.56-0.96, P=0.02489),由研究者评估的中位PFS分别为4.30和2.79个月(HR=0.52, 95% CI: 0.39-0.68, P<0.00001),确认的客观缓解率(ORR)分别为25.5%和2.2%(P<0.00001)。安全性特征与既往研究结果一致,无新的安全性信号。
3.康宁杰瑞PD-L1/CTLA-4双抗最新研究数据公布。康宁杰瑞在AACR 2021年会上公布PD-L1/CTLA-4双抗KN046联合白蛋白结合型紫杉醇治疗晚期三阴乳腺癌的Ⅰb/Ⅱ期临床研究数据(KN046-203)。截至3月8日,25例可评估患者中的ORR为40.0%,DCR为96.0%;中位随访时间13.7个月时,中位PFS为7.3个月(95%CI:3.7~NE),中位OS未达到,15个月OS率为73.4% (95% CI:46.1~88.4%);在PD-L1阳性 (IC PD-L1≥1%) 患者中,中位PFS为13.8个月 (95% CI:1.6~NE),15个月的OS率为77.1% (95% CI:34.5~93.9%);KN046总体耐受性良好。
4.德琪双靶点抑制剂ATG-008 II期临床进展。德琪医药宣布引进品种ATG-008(onatasertib)在中国开展的II期临床 (BUNCH)完成首例患者给药。该项研究旨在评估ATG-008用于治疗NFE2L2、STK11、RICTOR或其他特异性基因变异的晚期实体肿瘤的疗效。ATG-008是新基(已被BMS收购)开发的一款第二代mTORC1/2双靶点抑制剂,德琪医药正在中国和其他亚太国家及地区开展了ATG-008治疗晚期肝细胞癌(HCC)、晚期非小细胞肺癌(NSCLC)以及与抗PD-1抗体联合治疗晚期实体瘤及肝细胞癌的多项临床试验。
5.凌腾医药启动卡妥索双抗治疗膀胱癌临床研究。凌腾医药卡妥索双抗(Catumaxomab)登记启动一项治疗非肌层浸润性膀胱癌(NMIBC)的I/II期临床(NCT04799847)。该研究旨在评估膀胱内灌注卡妥索双抗对卡介苗(BCG)治疗失败或不耐受的NMIBC复发患者的安全性与有效性。据悉,这是卡妥索双抗在国内开展的第二项临床研究。去年7月,Catumaxomab用于伴腹膜转移胃癌的国际III期临床已在国内启动,目前已完成首例患者给药。
6.以岭药业1类创新药启动Ⅲ期临床。以岭药业1类创新药苯胺洛芬注射液登记启动一项用于治疗术后中、重度疼痛的Ⅲ期临床。该项临床计划招募306例受试者,评估这款非甾体类镇痛药治疗术后中、重度疼痛的有效性及安全性。研究项目组长单位是中南大学湘雅三医院,中国约27家研究中心将加入本研究。
国际药讯
1.再生元新冠中和抗体疗法达Ⅲ期主要终点。再生元(Regeneron)新冠中和抗体组合疗法REGEN-COV(casirivimab+imdevimab)在预防新冠感染的Ⅲ期临床中获积极结果。在接受一剂皮下注射中和抗体疗法的志愿者中,患上出现症状的COVID-19的风险下降81%。此外,REGEN-COV在治疗无症状新冠病毒感染者的Ⅲ期临床中也达到主要终点,将无症状患者转变为出现症状的COVID-19患者的风险降低31%,将患者症状持续时间平均缩短45%,并且显著降低患者的病毒水平。
2.神经活性类固醇GABAA别构调节剂临床结果积极。Sage/渤健口服GABAA别构调节剂SAGE-324治疗特发性震颤(ET)患者的Ⅱ期临床KINETIC到达主要终点。与安慰剂相比,SAGE-324治疗组29天后患者的基本震颤评定量表(TETRAS)绩效子量表第4项的上肢震颤评分显著降低(p=0.049),两组上肢震颤幅度比基线水平降低分别为36%和21%;患者日常生活活动(ADL)评分均与上肢震颤评分展现出显著的统计学相关性;SAGE-324的安全性特征与之前研究一致。
3.默克公布berzosertib治疗小细胞肺癌疗效数据。默克ATR抑制剂berzosertib(M6620)治疗复发性小细胞肺癌(SCLC)的关键II期概念验证研究(NCT02487095)结果积极。berzosertib联合拓扑替康(topotecan)治疗的客观缓解率(ORR)为36%(95%CI:18.0-57.5;全部为部分缓解);铂敏感(60.0%)和铂耐药(30.0%)患者均观察到缓解;中位缓解持续时间(DOR)为6.4个月,中位无进展生存期(PFS)为4.8个月,中位总生存期(OS)为8.5个月。
4.创新乙肝免疫疗法即将启动Ⅱ期临床。VBI Vaccines公司免疫疗法VBI-2601(BRII-179)即将联合Vir公司siRNAi疗法BRII-835(VIR-2218)在新西兰开展用于治疗慢性乙肝的Ⅱ期临床。在一项Ⅰb /Ⅱa期临床中,与核苷类似物(NUC)相比,VBI-2601伴随或不伴随干扰素-α(IFN-α)与NUC联合治疗使超过50%的患者(50%-78%)产生针对乙肝病毒表面抗原的T细胞免疫反应(vs0%),而且VBI-2601耐受性良好。2018年12月,腾盛博药签署协议引进了VBI-2601和VIR-2218两款乙肝功能性治愈创新疗法,预计今年将在中国、澳大利亚、新加坡、泰国、韩国等同步启动这一研究。
5.特发性嗜睡症创新疗法Xywav获FDA优先审查。FDA受理Jazz公司Xywav口服溶液治疗特发性嗜睡症成人患者的补充新药申请,并授予其优先审查资格,PDUFA日期为2021年8月2日。如果获批,Xywav将成为美国首款也是唯一一款治疗这类成人患者的药物。去年7月,Xywav已获FDA批准上市,用于治疗7岁及以上发作性睡病(嗜睡症)患者的猝倒或过度日间嗜睡。
6.阿斯利康达格列净治疗COVID-19 Ⅲ期研究失败。阿斯利康评估SGLT2抑制剂达格列净(Farxiga)治疗有发生严重并发症危险因素的COVID-19住院患者的III期临床DARE-19未达到主要终点。在30天治疗期间,该试验在衡量器官功能障碍和全因死亡率的主要预防终点、衡量临床状态变化(从早期康复到死亡)的主要恢复终点方面均没有达到统计学意义;Farxiga的安全性和耐受性与已知研究一致。完整试验结果将于ACC2021科学会议上公布。
医药热点
1.我国已向43国出口新冠疫苗。4月10日~11日,2021全国疫苗与健康大会在四川省成都市举行,本次会议的主题为“推进新冠疫苗接种,维护国家公共安全”。据悉,截至目前,全球已有140余个国家开始接种新冠疫苗,总接种剂次达6亿;我国已加入世卫组织新冠疫苗实施计划,目前已向43个国家出口新冠疫苗。
2.财政部给19家药企开出罚单。财政部日前发布《医药企业会计信息质量检查公告》,这是 2019 年针对 77 家医药企业公开查账的检查报告,有19家医药企业面临行政处罚 。经查,部分医药企业存在以下问题:一是使用虚假发票、票据套取资金体外使用,二是虚构业务事项或利用医药推广公司套取资金,三是账簿设置不规范等其他会计核算问题。上述行为,违反《中华人民共和国会计法》第九条等规定。
3.印度新冠疫情严重程度超越巴西成为全球第二。当地时间4月12日,据路透社新德里报道,印度卫生部当日的数据显示,印度一夜之间报告新增新冠肺炎病例168912例,刷新纪录,超过巴西,成为新冠疫情全球第二严重程度的国家。路透社数据显示,印度累计新冠肺炎病例达到1353万例,超过巴西的1345万例。美国累计新冠肺炎病例3120万例,居全球之首。
审评动向
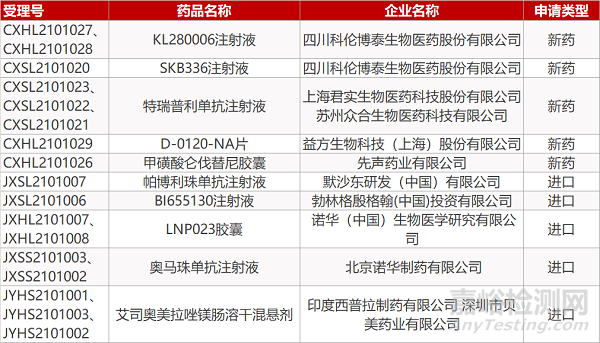
四川科伦的KL280006注射液(2个规格)和SKB336注射液、上海君实/苏州众合的特瑞普利单抗注射液(3个规格)、益方生物的D-0120-NA片、先声药业的甲磺酸仑伐替尼胶囊、默沙东的帕博利珠单抗注射液、勃林格殷格翰的BI655130注射液、诺华的LNP023胶囊(2个规格)。

来源:药研发


