您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-10-22 08:53
免疫原性是指能够刺激机体免疫系统引起免疫应答的特性。免疫原性是抗原的特点之一,它能作用于T淋巴细胞和B淋巴细胞的抗原识别受体,使其增殖、分化,从而产生免疫效应物质,如特异性抗体和致敏淋巴细胞。免疫原性的强弱通常与分子量大小大小、化学结构相关。
具有免疫原性的物质,通常来说,分子量越大,免疫原性越强,分子量低于4000,一般不具有免疫原性,分子量在4000和10000之间,呈若免疫原性,分子量高于10000者,具有较强的免疫原性。但是有例外,比如比如明胶,分子量可达10万,但是呈弱免疫原性,因为它是容易降解的直链氨基酸结构。
免疫原性检测是抗体药物研发过程中必不可少的一步,需要在临床前和临床阶段均开展。具有免疫原性的药物可能诱发机体产生有害的免疫反应,能形成抗药抗体(anti-drug antibody, ADAs)和中和抗体(neutralizing antibody, NAbs)。前者会引起患者强烈的免疫反应,甚至危害病人生命安全,后者能够中和能力,能够抑制生物药的生物活性而减弱其药效。
因此,考虑到免疫原性会严重影响药物的有效性和安全性,FDA等药监部门要求对所有生物药都要进行免疫原性的检测。但是现在的预测手段不好,很多药物直到临床III期才发现ADA问题。对企业来说,这无疑增加了研发风险和资本投入。
01、生物药免疫原性来源
生物药的免疫原性主要有两个来源:内源和外源。内源免疫原性来自非人源的氨基酸序列、不同人的氨基酸序列和为了加强功效或者延长半衰期而进行的一些修饰(如点突变、糖基改动、去海藻糖、加脂肪酸、PEG化、Fc融合,双特异性抗体和多功能抗体等),这在药物研发早期时就应该考虑进去。
外源免疫原性主要来源于CMC(CMC主要是指生产工艺,杂质研究和质量研究)、物料和运输等相关。比如,提高抗体表达量的同时糖基化没有跟上,导致了多聚体的产生,多聚体是免疫原性的重要起因之一。再比如,常见的表面活性剂能引起强烈的机体免疫反应。另外,给药途径、给药频率和给药时间也可能影响蛋白质的免疫原性。
02、如何检测生物药免疫原性
FDA建议对免疫原性风险检测最好在IND阶段和临床I期开展。对于高免疫原性风险的生物药,药企应在早期进行预验证,并在样本冻存前,进行实时检测分析。通过FDA药物认证的条件之一是,有完全的蛋白免疫原性检测报告。根据FDA指南,生物药的免疫原性检测主要包含以下3个步骤:
1、免疫原性筛选:检测识别抗体蛋白药的ADA。常用方法包括ELISA、ECL和RIA。
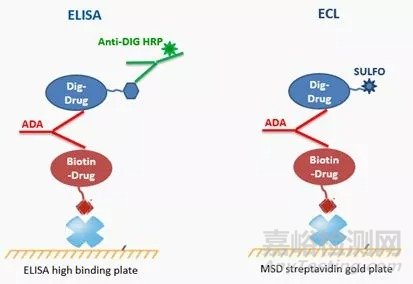
利用ELISA和ECL检测ADA
2、ADA确认:通过蛋白药竞争来验证ADA是否特异,排除假阳性结果。
3、ADA表征:竞争性配体结合分析、亚型分析、结合稳定性分析、抗原表位特异性分析、结合稳定性、中和能力分析。中和能力分析又被称为中和检测,常用方法为竞争性配基结合(competitive ligand binding, CBL)。CBL是中和检测的首选方法。
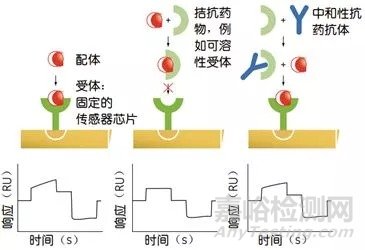
CLB检测法检测中和抗体
常用的免疫原性检测方法
1、ELISA-桥法
对抗体药物进行免疫原性检测是生物技术药物申请临床试验和注册的重要内容,尽管已有的动物试验显示免疫原性不一定会在人体内产生预期的免疫反应,但对药物免疫反应的评价仍显得十分重要。将抗原或抗体固定的过程称为包被,换言之,包被即是抗原或抗体结合到固相载体表面的过程。ELISA-桥法包被药物,用标记的药物检测。此法的优点是能检测各类抗体亚型,无种属特异性,可高通量检测,缺点是不易检测到低亲和力的抗体,包被或标记时可能会掩盖或改变药物的抗原表位,易受药物本身的干扰。
2、ELISA-直接法
抗体的包被一般均采用直接吸附法,蛋白质抗原大多也可采用与抗体相似的方法包被。ELISA-直接法包被药物,用标记抗体检测。ELISA-直接法用于免疫原性检测的优点是可能会增加检测低亲和力抗体的能力,且高通量。然而当抗原决定簇存在于或邻近于疏水区域时,抗原与固相载体的直接吸附可使抗原决定簇不能充分暴露,在这种情况下,直接包被效果不佳,可以采用间接的捕获包被法。而且直接包被时可能会掩盖或改变药物的表位,仅检测单一亚型,有种属特异性,多次洗涤时丢失低亲和力抗体,参考品与样本之间试剂可能不同。
3、ELISA-间接法
ELISA-间接法包被单抗或生物素,再加药物,即先将针对该抗原的特异抗体作预包被,其后通过抗原抗体反应使抗原固相化。此间接结合在固相上的抗原远离载体表面,其抗原决定簇也得以充分暴露。间接包被的抗原经固相抗体的亲和层析作用,包被在固相上的抗原纯度大大提高,因此含杂质较多的抗原也可采用捕获包被法,试验的特异性、敏感性均由此得以改善,重复性亦佳。间接包被的另一优点是抗原用量少,仅为直接包被的1/10乃至于/100。不易吸附在聚苯乙烯载体上的非蛋白质抗原可采用特殊的包被方式。
4、放射免疫分析法(RIA)
RIA 是一种微量分析法,就是利用放射性核素标记抗原或抗体,然后与被测的抗体或抗原结合,形成抗原抗体复合物的原理来进行分析的。它兼有放射性同位素的灵敏性和抗原、抗体反应的特异性两大特点。该法还具有准确性高和精密度好,便于标准化以及操作简便、经济等优点。由于RIA具有灵敏度高、特异性强、测量简单和成本低等优点,RIA在应用方面具有一定的生命力。但是,又因为它最致命的弱点就是使用放射性核素,此外标记物有效使用时间短,难以实现操作和测量的自动化等,它的进一步发展受到一些局限。现在免疫分析技术都在朝着非同位素标记免疫分析的方向发展。
5、电化学发光法(ECL)
电化学发光法(ECL)源于电化学法和化学发光法,不仅可以应用于所有的免疫测定,而且还可用于DNA/RNA探针检测。它的优点是液相法,可检测各种抗体亚型,无种属特异性、高通量,可使用高浓度基质,检测表面积大和信号稳定。缺点是需制备2种标记物(生物素和TAG),标记物分子的表位可能会变化或标记过程会改变分子,所用试剂通用性差。
6、表面等离子体共振
表面等离子体共振法的优点是液相法,不需结合物(酶标记抗体),能检测到不同亲和力的抗体和各亚型抗体,无种属特异性。缺点是化学连接可能会影响分子,与葡聚糖连接影响表位的暴露,复性可能会使分子降解,所用试剂通用性差,低通量,如果产生的抗体是药物同种亚型的抗体,要证实一种人源化抗体的抗抗体反应比较困难,灵敏度低。
7、酶联免疫斑点法(ELISpot)
酶联免疫斑点法(ELISpot)的原理与ELISA类似,也是检测细胞产生的细胞因子或其他可溶性蛋白的方法,它不仅能测定细胞因子量,还可通过计数检测分泌此细胞因子的细胞频率,灵敏度高于ELISA,而且实验采用的捕获抗体不会影响活化细胞分泌细胞因子。缺点是比ELISA技术复杂而费时,需严密控制实验条件,操作人员需技术熟练,并能对实验结果进行分析,以减少实验偏差;属半定量方法。
8、免疫PCR法(IPCR)
免疫PCR法(IPCR)是在ELISA的基础上建立起来的,用PCR扩增代替ELISA的酶催化底物显色。PCR具有很强的放大能力,可以定量地检测DNA和RNA,具有非常高的灵敏度和特异性,因此,将与抗原结合的特异抗体通过连接分子与DNA结合,再经PCR扩增定量检测抗原使得IPCR的灵敏性高于ELISA。与对应的ELISA比较,IPCR至少可使抗体检测的灵敏度提高1000倍,而且该法中仅仅采用稀释的方法就可以消除生物样品中基质的干扰。
目前报道的IPCR均采用待检抗原直接吸附固相,因此固相的均质性对结果有很大的影响;同时检测的样品中其他成分也可以吸附固相,极易产生背景过高或精确度下降。有些难于吸附固相的抗原也就不能用免疫PCR检测,连接分子的特异性和均质性对PCR影响很大,PCR扩增过程相对简单,如用微量板作为固相需选用配套的PCR仪,否则需将其移入反应管内,这必然导致很大的误差,经放大可产生显著差异。IPCR具有广泛的应用前景,但有必要进一步完善IPCR的实验过程和配套试剂的研制。
抗体类药物免疫原性检测不仅仅是药物治疗效果的问题,更是药物安全性的问题,人们对抗抗体的副作用目前仍不明确。但抗抗体产生对药物本身的影响以及潜在的过敏反应不容忽视,因此对抗体类药物免疫原性检测的工作需要不断研究。

来源:Internet


