您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-07-08 10:46
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
国际药讯
1.再生元抗体鸡尾酒疗法COVID-19Ⅲ期临床启动。再生元宣布启动一项Ⅲ期临床试验,评估其开发的新冠病毒双抗体鸡尾酒疗法RGEN-COV2,在未感染人群中预防新冠病毒感染的能力。这些人曾经在近距离接触过COVID-19患者。再生元将与美国国立卫生研究院(NIH)下属的国家过敏和传染病研究所(NIAID)合作进行这一临床试验。同时,REGN-COV2治疗住院和非住院COVID-19患者的适应性临床试验也进入了Ⅱ/Ⅲ期部分, 将评价病毒学和临床终点,预计在今年夏天晚些时候获得初步数据。
2.Immunomedics创新抗体偶联药物达Ⅲ期临床终点。Immunomedics公司Trop-2靶向抗体偶联药物Trodelvy(sacituzumab govitecan-hziy)在治疗转移性三阴性乳腺癌(mTNBC)患者的确认性Ⅲ期ASCENT临床试验中达到无进展生存期(PFS)的主要终点,将患者疾病进展或死亡风险降低59%。Trodelvy此前基于一项单臂Ⅱ期临床中的客观缓解率和缓解持续时间数据,已获FDA加速批准。该公司计划基于这一Ⅲ期临床数据向FDA递交补充生物制品许可申请,寻求对Trodelvy的完全批准。云顶新耀拥有该新药在大中华区的开发、注册和商业化权益。
3.CPP-1X/sul治疗家族性腺瘤性息肉美欧申请上市。Cancer Prevention公司宣布已向FDA提交了一份新药申请,寻求加速批准其固定剂量组合产品CPP-1X/sul(依氟鸟氨酸/舒林酸)用于治疗成人家族性腺瘤性息肉病(FAP)。CPP-1X/sul用于相同适应症的营销授权申请也已向欧盟提交。一项III期试验CPP FAP-310针对下消化道解剖(结肠完整、直肠保留或囊状袋的患者)数据显示:CPP-1X/sul与两种单一药物(p≤0.02)相比,在延迟下消化道手术事件方面具有长达4年的显著统计学意义。如果获批,预计很快将作为一种辅助疗法,用于面临大肠手术的FAP患者的管理。
4.子宫肌瘤药物linzagolix两项Ⅲ期临床结果积极。ObsEva SA公司新型口服GnRH受体拮抗剂Yselty®(linzagolix)治疗子宫肌瘤的两项Ⅲ期临床(PRIMROSE 1和PRIMROSE 2)结果积极。在PRIMROSE 1试验中,与安慰剂相比,linzagolix治疗组患者经血减少量具有统计学意义的显著降低(≤80mL,比基线降低≥50%),200mg linzagolix联合反向添加疗法(ABT)治疗组缓解率达75.5%(P<0.001),100mg linzagolix组缓解率达56.4%(P=0.003)。PRIMROSE 2的数据显示,使用linzagolix持续治疗52周可给患者提供持续的疗效,并且患者的耐受性良好。ObsEva计划在2020年第四季度和2021年1月向欧洲和美国监管机构提交监管申请。
5.ViiV抗HIV药Cabenuva临床调查结果积极。ViiV Healthcare公司将在AIDS 2020年会上公布调查每月一次长效注射方案Cabenuva(卡博特韦/利匹韦林)成功应用于临床实践的CUSTOMIZE研究的阳性初步结果。4个月的调查结果显示,大多数临床参与者继续认为这款Cabenuva对HIV感染者来说是可接受的、可行的和合适的,并且他们认为实施注射疗法的障碍大为减少。今年3月,Cabenuva已在加拿大获批,成为唯一一个每月一次、完整的长效方案,用于治疗已实现病毒学抑制(HIV RNA<50拷贝/毫升)的HIV-1成人感染者,取代其当前的抗逆转录病毒(ARV)方案。
6.通用型CAR-T治疗MM的临床试验被FDA叫停。专注于开发基于基因编辑的同种异体CAR-T细胞(UCART)免疫疗法的Cellectis公司宣布,其同种异体CAR-T细胞疗法UCARTCS1A用于治疗复发/难治多发性骨髓瘤(MM)患者的临床试验MELANI-01已被FDA叫停。一例先前已接受过多种疗法且治疗失败的MM患者在接受了2级剂量(DL2)的UCARTCS1A治疗后,死于治疗相关的心脏骤停。目前对该病例的临床评估仍在进行,有关该事件的更多细节也在收集中。
医药热点
1.国家发改委安排456.6亿元加强公共卫生补短板。近日,国家发展改革委下达了2020年卫生领域中央预算内投资,共安排456.6亿元,支持全国31个省(自治区、直辖市)和新疆生产建设兵团加强公共卫生防控救治能力建设。投资计划突出“一钱多用”,在满足防疫需求的同时,着力补齐县城城镇化建设短板,推动大城市大医院“瘦身健体”。下一步,国家发展改革委将会同相关部门加快推动项目实施,积极调整自身财政支出和投资结构,确保疫情防控设施建设资金足额到位。
2.部分医学生可免试申请注册村医。7月6日,国家卫健委发布的《关于允许医学专业高校毕业生免试申请乡村医生执业注册的意见》提出,允许不具备执业(助理)医师资格人员申请乡村医生执业注册的省份,应于7月31日前修订相关管理办法,允许具有全日制大专以上学历的临床医学、中医学类、中西医结合类等相关专业应届毕业生(含尚在择业期内未落实工作单位的毕业生),免试申请乡村医生执业注册。
3.基层医院要多招高校毕业生。人社部、国家卫健委联合发布《关于做好2020年县级及基层医疗卫生机构公开招聘高校毕业生工作的通知》,要求县级及基层医疗卫生机构要统筹用好现有空编资源,提高空缺岗位专项招聘高校毕业生的比例,在去年招聘数量基础上,再扩大招聘一定数量的高校毕业生。《通知》指出,要积极鼓励和引导高校毕业生到艰苦边远地区县级及基层医疗卫生机构就业。公开招聘时,可根据情况适当放宽年龄、学历等招聘条件。
股市资讯
【珍宝岛】获得盐酸氨溴索注射液的生产注册申请《受理通知书》
【华仁药业】(1)发布2020年半年度业绩预告。归母净利润:3200万-3800万元(+146.81% - +193.09%)(2)全资子公司华仁医疗收到医用一次性防护服《医疗器械注册证》
【海正药业】正在筹划重组事项,拟通过发行股份、可转换公司债券及支付现金向HPPC购买瀚晖制药49%股权,并募集配套资金
审评动向
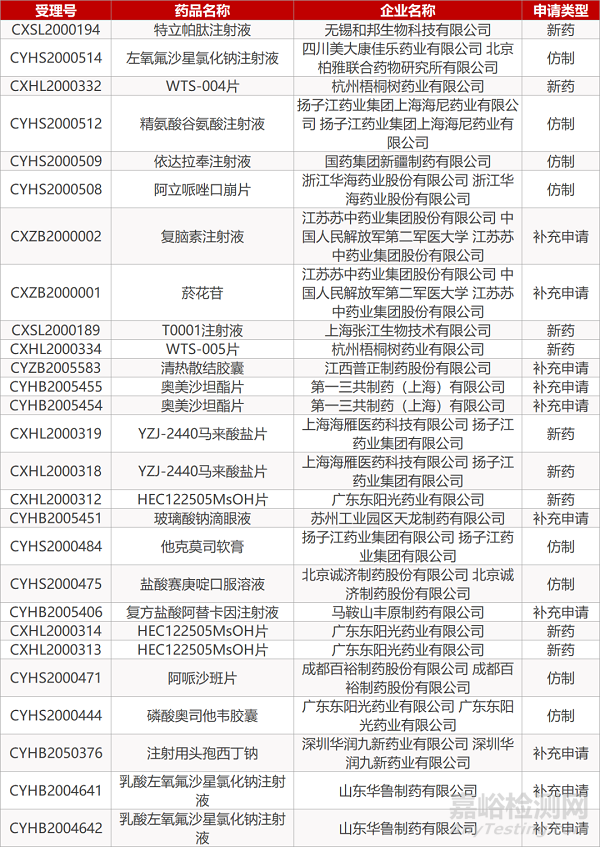
1. CDE最新受理情况(07月07日)
- The End -

来源:药研发


