您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-05-28 10:19
手术电极根据结构和工作原理的不同,分为单极手术电极、双极手术电极和中性电极,该产品与高频手术设备配套,供临床各类外科手术中分别用于组织切割、分离、血管夹闭止血、组织凝固等。
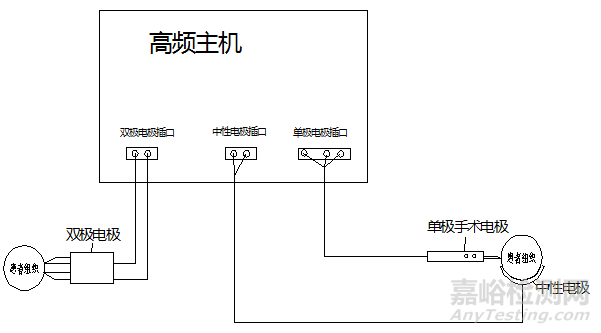
手术电极的工作原理和电气连接图
手术电极产品研发实验要求
根据手术电极的主要功能和预期用途,产品的技术指标主要包括产品的外观、尺寸、机械性能及接口要求、电气安全性能和电磁兼容性能。
1.单/双极手术电极
1.1单/双极手术电极性能指标
1.1.1外观及尺寸
单极手术电极:插入部外径(或插入部尺寸,如直径、宽度等)、有效长度(工作部长度)、电极电缆长度
双极手术电极:有效长度(工作部长度)、电极电缆长度
上述内容应符合企业规定要求。
1.1.2物理指标
手术电极应用部分的硬度、电极表面粗糙度应符合企业规定要求。
1.1.3接口电气可靠性要求
电极导通性:手术电极与高频连接线应导通良好,其阻抗值应小于企业规定值。
1.1.4材料
应明确产品的材料,尤其是直接接触人体的材料(金属材料、高分子材料等),应规定材料耐腐蚀性指标。
2.中性电极
2.1中性电极性能指标
2.1.1外观及尺寸
中性电极电缆长度、电极板尺寸应符合企业规定要求。
3.其他性能指标
3.1一次性使用产品要求
3.1.1无菌产品
应无菌;采用环氧乙烷灭菌的产品,要求产品出厂时环氧乙烷残留量不得大于10μg/g。
3.1.2以非无菌状态使用的产品,其初始污染菌应不得大于100cfu/件,并不得检出致病菌。
3.2重复使用产品要求(应在说明书中明确符合重复使用产品材料特性的灭菌方法及灭菌方法耐受性要求)
3.3耐腐蚀性要求
采用马氏体或奥氏体不锈钢材料制成的手术电极产品,其耐腐蚀性应能达到YY/T 0149-2006中沸水试验法规定的b级要求;若采用其他材料制成的手术电极产品,其耐腐蚀性应满足在常规条件下,经消毒灭菌不得产生锈蚀现象(检验用消毒灭菌方式应与说明书规定的消毒灭菌方式一致)。
3.4附加功能
产品如有附加功能,应满足企业规定要求。
3.5电气安全
单极手术电极、双极手术电极和中性电极自体是无源产品,然而该产品必须配合高频发生器设备使用,因此需满足GB 9706.1-2007和GB 9706.4-2009的互连要求以及相适应条款的要求。
3.6电磁兼容性(如包含线缆)
应符合YY 0505-2012及GB 9706.4-2009第36章的要求。产品的试验方法应根据技术性能指标设定,试验方法一般应采用已颁布的标准试验方法,如果没有现行的标准试验方法可采用时,规定的试验方法应具有可操作性和可再现性。电气安全性能的检测主要参照GB 9706.1-2007和GB9706.4-2009。电磁兼容性的检测参照YY 0505-2012。
手术电极产品研发要求
1.产品性能研究
应当提供产品性能研究资料以及产品技术要求的研究和编制说明,包括功能性、安全性指标以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。如:手术电极头部的硬度、电极表面粗糙度参数确定的研究资料。
2.生物相容性评价研究
(1)产品生物相容性评价依据为GB/T 16886.1-2011、GB/T 16886.5-2003、GB/T 16886.10-2005标准。
(2)电极工作部与患者人体组织短期接触,接触的部位一般采用不锈钢材料制成,部分产品如对不锈钢材料进行镀层,需对镀层进行生物相容性评价。
(3)实施或豁免生物学试验的理由和论证可参照《医疗器械生物学评价和审查指南》中相关要求。
(4)根据生物学试验结果或已有信息(包括材料、文献资料、体外和体内试验数据、临床经验)判断与人体接触部分材料是否具有安全的生物学特性。
3.灭菌/消毒工艺研究
以无菌方式提供的手术电极,企业应明确相应的灭菌工艺(包括灭菌方式和相关参数)和无菌保证水平(SAL),提交灭菌确认报告。以非无菌方式提供的手术电极,企业应向终端用户明确产品的灭菌工艺(包括灭菌方式和相关参数及确定依据)
4.产品有效期和包装研究
(1)企业应提交产品有效期研究确认资料,如:可参考国标《无菌医疗器械包装试验方法第1部分:加速老化试验指南》(YYT 0681.1-2009)对产品外包装,产品本身或电子器件等关键物料采用加速寿命试验和实时老化试验的方式验证其有效期。
(2)以非无菌状态提供,并允许重复使用的完全采用不锈钢制造的手术电极应提供使用次数验证资料,如:依据产品工作条件、金属材料特性及疲劳程度分析等方面进行验证。
(3)企业应提交包装研究资料,应明确包装形式、包装材质、研究确认方案、试验结果及结论。
手术电极产品的主要风险及成因
|
危害类型 |
形成因素 |
|
|---|---|---|
|
能量危害 |
电能 |
手术电极外部绝缘/隔离不够,可能引起过量漏电流或电气击穿,伤害使用者或患者 |
|
热能 |
可触及的外壳温度过高,可能引起使用者或患者烫伤 |
|
|
机械能 |
电极前端部位尖锐,造成使用者或患者刺伤。 |
|
|
生物学危害 |
产品生物不相容性 |
设备若有直接与患者接触的组件,接触材料应进行生物相容性评价 |
|
环境危害 |
废物处置 |
使用过的手术电极任意丢弃 |
|
不适当的能量供应 |
高频发生器输出电压不稳定,导致产品不能正常工作 |
|
|
与医疗器械使用有关的危害 |
不适当的操作说明 |
与高频发生器上功能插座不匹配 |
|
消毒袋/无菌包装破损 |
||
|
对非无菌产品使用前未进行消毒/灭菌说明 |
||
|
中性电极板使用时未与人体粘贴可靠 |
||
|
重复使用的电极产品消毒不当引发的风险,如:灭菌液未干而投入使用,可能引起操作者被电击 |
||
|
由未经培训的人员使用 |
对一次性产品重复使用的警告不恰当 |
|
|
对手术电极使用方法不熟悉 |
||
|
信息危害 |
不适当的标记 |
电极外部标记不全面、标记不正确或不能够清楚易认,以及标记不能够永久贴牢 |
|
不完整的说明书 |
说明书中对产品预期用途、禁忌症、副作用等描述不规范、不完整,导致电极的非预期或超范围使用 |
|
|
不适当的操作说明 |
手术间歇存放位置不正确 |
|
|
过于复杂的操作说明 |
||
|
人机工程 |
复杂的控制系统 |
单极电极手控按钮开关有颜色区分其功能,标示不清,导致不适当的操作,不能满足预期要求 |
|
功能失效老化 |
电极寿命终止 |
电极使用寿命规定不明确,电极主要元件失效可能导致产品失控给患者造成危害 |
|
储存、运输不当 |
运输、储存环境条件规定不明确,或未按规定条件运输储存,可能导致电极损坏或不能正常工作 |
|

来源:嘉峪检测网


