您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-05-13 15:06
超声软组织切割止血器械简介
超声软组织切割止血系统通常由主机和附件组成,附件通常包括换能器、超声刀头(包含手柄、波导杆、套管等)和脚踏开关。主机为换能器及刀头提供能量,脚踏开关、刀头上的手动控制装置用以控制主机输出能量。
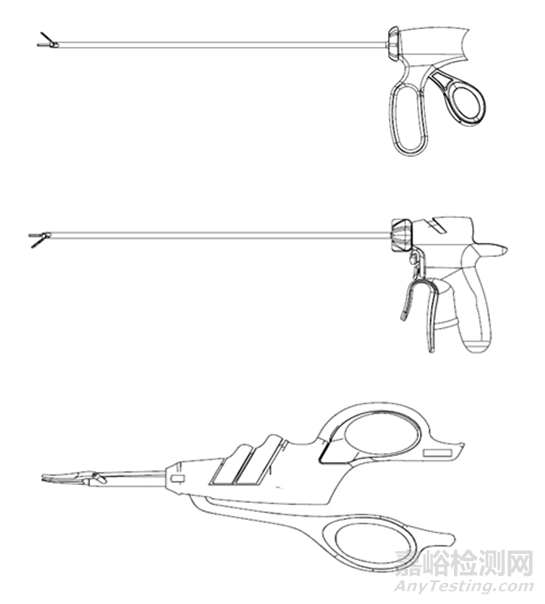
超声软组织切割止血系统用于需要控制出血及期望热损伤最小时的软组织切割,临床上多用于闭合血管直径为3mm及以下血管。超声软组织切割止血系统主机可适配多种型号的刀头,根据手柄形状不同有夹钳式、握式、剪式等,如图1所示。
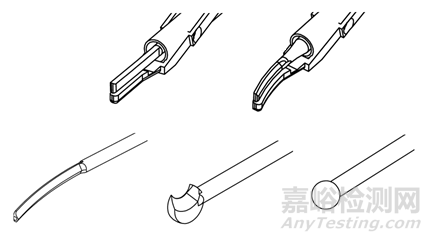
根据刀头尖端形态结构不同有多用剪、弯型多用剪、弯型剥离刀、分离钩、止血球等,如图2所示。医生根据手术具体情况,选择适合的刀头。
超声软组织切割止血系统通过设置不同的输出功率档位,可同时切割和凝闭组织。高功率档位可更快速地切割组织,低功率档位可更好地凝闭组织。主机中超声频率的电流传导至换能器,换能器将电能转化为前后振动的机械能,通过刀头的传递和放大使刀头末端以一定频率(例如55.5kHz)振动,摩擦产生的热量导致与刀头接触的组织细胞内水汽化,蛋白质氢键断裂,细胞崩解重新融合,组织凝固后被切开;在切割血管时,刀头与组织蛋白接触,通过机械振动产生热量,导致组织内胶原蛋白结构被破坏,造成蛋白凝固,进而封闭血管,达到止血目的。
超声软组织切割止血器械主要风险
|
序号 |
主要风险 |
可能原因 |
控制方式 |
|---|---|---|---|
|
1 |
凝血不良,继发性出血(大血管、毛细血管) |
1.产品原因:夹持力不良。 2.产品质量:如夹嘴变形、组织垫变形。 3.参数设置:如输出功率、输出频率不稳定。 4.操作原因:如未按要求设定工作模式、输出能量之前未能充分处理周边组织。使用前未培训、对使用人员培训不当。 |
合理设计产品。提高产品质量。在用户手册中进行说明,并增加相关的培训。如: 1.要求术前对超声刀夹嘴、组织垫、手柄、按键等进行常规测试。 2.要求术前对附件进行目测检查。 3.要求术前充分评估患者状态,由手术外科专业人员依据使用说明及患者情况,选择个体化的手术参数和恰当的手术操作。 |
|
2 |
切口处软组织热损伤,不能正常闭合切割/断刀、切不动 |
1.产品原因:如安规、性能、软件、标识、元器件老化、设计不合理、套筒发热、手柄断裂变形、按键失灵。 2.产品质量:如刀头表面有毛刺。 3.参数设置:如输出功率、输出频率不稳定。 4.操作原因:如未按要求设定工作模式、使用能量之前未能充分处理周边组织。使用前未培训、对使用人员培训不当。 |
合理设计产品。提高产品质量。在用户手册中进行说明,并增加相关的培训。如: 1.要求术前对超声换能器、超声刀刀头进行常规测试。 2.要求术前对附件进行目测检查。 3.要求术前充分评估患者状态,由手术外科专业人员依据使用说明及患者情况,选择个体化的手术参数和恰当的手术操作。 |
|
3 |
异物遗留体内 |
1.产品质量:设备损坏,如:组织垫脱落、产品内脱落。 2.操作原因:如未按要求设定工作模式、使用能量之前未能充分处理周边组织。使用前未培训、对使用人员培训不当。 |
合理设计产品。提高产品质量。在用户手册中进行说明,并增加相关的培训。如: 1. 要求术后对超声换能器、超声刀刀头进行常规测试。 2. 要求术前充分评估患者状态,由手术外科专业人员依据使用说明及患者情况,选择个体化的手术参数和恰当的手术操作。 |
|
4 |
切口处软组织感染 |
1.产品原因:如刀头热损伤控制不良、包装破损、生产环境。 2.产品质量:如刀头表面有毛刺。 3.参数设置:如灭菌过程失效。 4.操作原因:如超期使用、重复使用一次性使用产品、清洗消毒灭菌不规范。 |
合理设计产品。提高产品质量。在用户手册中进行说明,并增加相关的培训。如: 1. 术前对产品标识进行确认。 2. 对包装设计进行充分验证,对灭菌过程进行确认并定期再确认。 |
|
5 |
病人中毒,刺激过敏等症状、可能延误治疗 |
1.产品原因:如与人体接触材料。 2.操作原因:不会使用、可重复使用刀头清洗不完全。 |
合理设计产品。提高产品质量。在用户手册中进行说明,并增加相关的培训。如: 1.对与人体接触的材料进行控制。 2.对与使用人员进行有效培训。 3.对重复使用刀头的加强清洗质控。 |
超声软组织切割止血器械临床前研发实验
一、超声软组织切割止血器械性能要求及试验方法
1.超声软组织切割止血器械适用的国家、行业标准
(1)GB 9706.1《医用电气设备第一部分:安全通用要求》和GB 9706.15《医用电气设备第一部分:安全通用要求1.并列标准:医用电气系统安全要求》(若适用)。
(2)YY 0505《医用电气设备第1—2部分安全通用要求并列标准电磁兼容要求和试验》。
(3)YY 1057《医用脚踏开关通用技术条件》(若包含脚踏开关)。
(4)应按照YY/T 0644《超声外科手术系统基本输出特性的测量和公布》第7章的要求公布下列参数:尖端主振幅及其误差、频率控制的类型、功率储备指数。
2.超声软组织切割止血器械主要性能指标
(1)各超声刀头的最大夹紧力及误差、最大抓持力及误差。
(2)各换能器配合各超声刀头时的各个工作模式(能量档位)的性能指标:尖端主振幅及其误差、尖端横向振幅上限值、尖端振动频率及其误差、静态电功率及其误差、最大电功率及其误差。
试验方法应参照YY/T 0644《超声外科手术系统基本输出特性的测量和公布》的要求。
3.超声软组织切割止血器械生物学、化学要求
(1)无菌
无菌包装的附件应无菌,无菌检查法参考GB/T 14233.2《医用输液、输血、注射器具检验方法第2部分:生物学试验方法》的试验方法。
(2)环氧乙烷残留量
对于环氧乙烷灭菌的产品,应参考GB/T 16886.7的环氧乙烷残留量要求制定相关参数要求。
(3)化学要求
预期于患者接触部分包含高分子材料的附件(聚四氟乙烯等),建议参考GB/T 14233.1《医用输液、输血、注射器具检验方法第1部分:化学分析方法》制定适宜的检验项目和试验方法,如还原物质、金属离子、酸碱度滴定、蒸发残渣。并根据实际情况参照相关标准确定具体指标要求。
二、超声软组织切割止血器械动物实验要求
1.超声软组织切割止血器械体外爆破压实验
建议对于每一种换能器与刀头组合,根据血管情况选择最适合的档位,进行体外爆破压实验。建议选择已在中国获准上市、具有相同或更宽的适用范围、市场反应良好的超声软组织切割止血系统进行对照,分别在同样的血管上进行实验,并形成报告。
每一种换能器与刀头组合和对照产品均应至少进行20根血管的爆破压力测试,应选择直径不小于3mm的动脉血管、静脉血管进行实验,动脉血管、静脉血管的试验数量应相同。
2.超声软组织切割止血器械急性动物实验
对于每一种新开发的换能器与有代表性刀头的组合,均应进行急性动物实验。
代表性刀头的选择原因,应进行详细的论证。所选择刀头与其所代表刀头应有相同的尖端设计,性能指标(产品技术要求中所载明的指标)应基本相同。被代表的刀头爆破压力测试的结果应不劣于所选择的代表刀头。
3.超声软组织切割止血器械慢性动物实验要求
对于每一种新开发的换能器与有代表性刀头的组合,均应进行慢性动物实验。
代表性刀头选择原则及要求同急性动物实验。
三、超声软组织切割止血器械检测单元划分要求
检测单元的划分应建立在技术要求中所规定的安全、性能指标基础上,即对各安全要求、性能指标要求,分别挑选典型的附件/附件组合。
(一)超声软组织切割止血器械涉及生物、化学性能检测时
无菌检测应根据灭菌方法不同,各选取一套最难灭菌的附件进行检测。
环氧乙烷残留量检测应选取一套解析时间最短、最难解析灭菌的附件。
(二)超声软组织切割止血器械涉及电气安全、电性能指标和功能核查检测时
1.主机按照下列原则划分检测单元:
在注册单元划分的基础上,设备电源组件完全相同,软件平台相同,硬件平台相似,外形结构相似,仅在外观布局上存在一定差异的系列产品,可划分为同一检测单元。
2.附件按照下列原则划分检测单元:
(1)检测单元应能包含所有的换能器和刀头。
(2)脚踏开关可选取一个功能最复杂的型号。
(三)超声软组织切割止血器械电磁兼容检测时
电磁兼容检测应送检所有型号的主机、所有型号的换能器及其他所有涉及电磁兼容性的附件。电磁兼容试验按照预期最不利/最大发射的试验条件设置样机的运行模式。

来源:嘉峪检测网


