您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-07 09:03
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:17条资讯,阅读时长约:3分钟 」
今日头条
北海康成乳腺癌靶向药物在香港获批上市。北海康成制药引进品种马来酸奈拉替尼(Nerlynx®)在香港获批上市,用于HER2过表达/扩增的、早期激素受体阳性的成年乳腺癌患者在完成曲妥珠单抗治疗之后不到一年的强化辅助治疗。奈拉替尼是由Puma Biotechnology开发的一种强效的不可逆的酪氨酸激酶抑制剂,该药物已于2017年获FDA批准用于HER2阳性早期乳腺癌曲妥珠单抗辅助治疗后的强化辅助治疗,北海康成拥有其在大中华地区的独占许可授权。目前该药物的上市申请也已获国家药监局受理。
国内药讯
1.乐普医疗苯磺酸氨氯地平片通过一致性评价。乐普医疗旗下乐普药业仿制药苯磺酸氨氯地平片(5mg,鑫平)通过一致性评价并获《药品补充申请批件》。苯磺酸氨氯地平片临床适应症为高血压、慢性稳定性心绞痛等,其原研制剂为辉瑞“络活喜”。米内网数据显示,目前苯磺酸氨氯地平片国内通过一致性评价的企业共有13家,包括东阳光药、复星医药子公司重庆药友、华润赛科、京新药业、辰欣药业等。
2.千红制药ZHB202注射液获批临床。千红制药旗下1类新药ZHB202注射液获国家药监局临床批件,即将开展用于治疗急性淋巴细胞白血病、NK/T细胞淋巴瘤患者的临床试验。ZHB202注射液是千红制药及其控股子公司众红生物联合开发的、具有自主知识产权的化学药品1类创新药,目前ZHB202相关核心技术已申请PCT专利和中国发明专利。
3.亚盛医药与复宏汉霖就一新联合疗法达成合作。亚盛医药在研创新药APG-2575将联合复宏汉霖的汉利康(利妥昔单抗注射液)开展治疗慢性淋巴细胞白血病(CLL)的临床研究。APG-2575是首个进入临床的国产Bcl-2选择性小分子抑制剂,拟用于治疗多种血液恶性肿瘤。其正在进行的I期临床中,已有一例CLL患者肿瘤体积缩小超过60%,达到部分缓解,另有3例接受400mg剂量组的CLL患者在治疗第一周期内即达到完全缓解(CR)标准,迄今未观察到肿瘤溶解综合征(TLS)。汉利康是中国首个获批的生物类似药,主要用于非霍奇金淋巴瘤的治疗。
4.百济神州与Seattle Genetics达成合作协议。百济神州与Seattle Genetics公司就后者的一款临床前肿瘤候选药物达成许可协议。该药物预计2020年上半年进入临床阶段。根据协议,百济神州获得在亚洲(除日本以外)以及世界其他国家的独家开发与商业化权利;Seattle Genetics将保留该候选药物在美洲(美国、加拿大以及拉丁美洲国家)、欧洲以及日本的权利;Seattle Genetics将带领在全球范围内的开发,百济神州将负责为上述所属国家和地区范围内开展的临床试验提供资金并开展运营,临床开发以及注册申报;Seattle Genetics将获得授权许可首付款,可高达1.6亿美元的里程碑付款以及产品销售分成。
5.阿斯利康引进太阳药业肿瘤产品中国区权益。阿斯利康与印度太阳药业签署合作协议,将负责太阳药业多款新型ready to-use(RTU)输注肿瘤产品在中国的引进与推广工作。根据协议,太阳药业将负责本协议所涵盖产品的开发、监管备案和制造,而阿斯利康将在中国独家推广和分销这些产品。协议的初始有效期为10年,自上述产品在中国首次商业销售之日起计算。协议财务条款尚未公开。
国际药讯
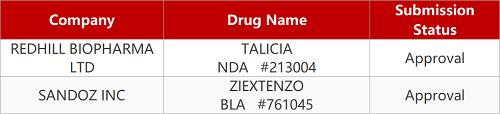
1.诺华Neulasta生物仿制药获FDA批准。诺华旗下山德士的生物仿制药Ziextenzo获FDA批准,并计划于年内上市销售。2016年7月FDA曾拒绝批准Ziextenzo,今年4月,山德士重新提交了新药申请,并补充了来自关键药物动力学研究的其他试验数据。该药原研药是安进的重磅产品Neulasta,Neulasta(pegfilgrastim)是一种重组的人粒细胞巨噬细胞集落刺激因子,是一种“升白”药,用于提升患者体内的白细胞数量。其临床主要用于预防和治疗肿瘤放疗或化疗后引起的白细胞减少症、治疗骨髓造血机能障碍及骨髓增生异常综合征等。2017年该药的全球销售额为45.6亿美元,其中87%来自美国市场。
2.NextCure将更新抗siglec-15单抗最新临床结果。由陈列平教授创建的NextCure公司将在第34届癌症免疫疗法学会年会上,公布其具first-in-class潜质的抗siglec-15单抗NC318在Ⅰ/Ⅱ期临床中的最新结果。截至2019年8月,43例患者接受了不同剂量NC318的治疗,其中32例患者的肿瘤反应可以被评估(其中11例患者尚未接受第一次评估,他们的疗效数据将在大会上公布);7例NSCLC患者中有1例患者达完全缓解、1例患者达部分缓解、1例患者达疾病稳定同时肿瘤体积减小、2例患者达到疾病稳定;NSCLC患者的缓解率达29%,疾病控制率达71%;研究中NC318具良好的安全性和耐受性。
3.Inovio创新组合疗法Ⅰ/Ⅱ期临床数据积极。Inovio公司在研T细胞激活免疫疗法INO-5401,与编码IL-12的免疫激活剂INO-9012,联合PD-1抑制剂Libtayo构成的组合疗法,在治疗新确诊的胶质母细胞瘤(GBM)患者的Ⅰ/Ⅱ期临床中,使80%具有甲基化MGMT基因的患者达到6个月的无进展生存期(PFS),使75%携带非甲基化MGMT基因的患者达到6个月的PFS。这一数据显著优于接受标准疗法的同类患者的历史表现。最终数据预计将于2020年第四季度获得。INO-5401是一种合成DNA免疫疗法,可编码hTERT,WT1和PSMA等多种癌症抗原,旨在激活多种人类癌症患者中的T细胞。
4.武田与MD安德森癌症中心达成合作。武田与德克萨斯大学MD安德森癌症中心将共同开发脐带血衍生的嵌合抗原受体天然杀伤细胞疗法(CAR-NK),加速其治疗B细胞恶性肿瘤和其他癌症的临床开发。据悉,该疗法有望成为首款被批准治疗门诊患者的CAR细胞疗法。目前,靶向CD19的CAR-NK疗法正处于治疗B细胞恶性肿瘤的Ⅰ/Ⅱa期临床阶段。根据协议,武田将获MD安德森癌症中心专有CAR-NK平台的使用权,并负责产品的开发,制造和商业化发展,其中包括靶向CD19和B细胞成熟抗原(BCMA)的CAR-NK细胞疗法。MD安德森癌症中心将获得相应的预付款、潜在的里程碑付款以及产品的销售额分成。
5.卫材转让表观遗传药物Tazemetostat全球版权。专门从事药品专利许可收益投资的机构Royalty Pharma以3.3亿美元从卫材购买tazemetostat在日本以外地区的全球版权,包括1.1亿美元首付款和2.2亿美元基于特定适应症获得FDA批准的里程金。Tazemetostat是卫材合作公司Epizyme研发的一款first in class的口服EZH2(Zeste 基因增强子同源物 2)抑制剂,目前已获FDA优先审评资格,用于不适合进行治愈手术的转移性或局部晚期上皮样肉瘤。一项II期研究结果显示,截止2018年9月17日,62例上皮样肉瘤患者的ORR为15%、中位缓解持续时间(DoR)尚未达到、疾病控制率(DCR)为26%、中位OS为82.4个月。
6.赛诺菲2019年Q3业绩出炉。赛诺菲发布2019年前3季度业绩报告,Q3全球业绩为94.99亿欧元,同比下降1.1%;前3季度业绩为265.18亿欧元,同比增长2.2%。中国市场,2019年Q3业绩为7.44亿欧元,同比增长13.7%;其中,中国区波立维(Plavix,硫酸氯吡格雷)业绩为2.09亿欧元(约合16.4亿人民币),增幅缩小为3.5%;安博维 (Aprovel,厄贝沙坦)/安博诺(Coaprovel,厄贝沙坦氢氯噻嗪)业绩为0.74亿欧元,增幅1.4%。由于4+7药品集中带量采购和集采扩面的影响,预计在2019年Q4中国业绩将下滑,预计2020年中国波立维、安博诺将下滑50%。
7.FDA发布医疗器械一级召回通知。本周,FDA发布了3项医疗器械I类召回通知,涉及产品分别来自雅培、飞利浦医疗和美敦力。涉及产品分别为:雅培于2017年11月22日至2019年8月6日发行的381台CentriMag急性循环支持系统(批号:L05333-0001-L06608-0024);飞利浦医疗于1998年1月1日至2008年12月31日生产的852台Forte Gamma摄像系统(包括Forte (882020)、Forte Jetstream (882290)等7个型号);美敦力于1999年8月6日至2018年7月24日发行的1117台MiniMed 500型遥控器和503型远程变送器(MMT-500和MMT-503)。
医药热点
1.我国器官移植年手术量超两万。首届国际肺移植论坛暨第十届全国心肺移植高级研讨会在江苏无锡市举办,国家卫健委相关负责人在会上介绍了我国器官移植新进展。截至2019年10月,我国已累计完成器官捐献2.67万例,捐献大器官超过7.5万例,年移植手术量超过2万例,器官捐献移植数量、质量和技术能力不断提升,国际上能开展的器官移植技术我国均能开展,有的实现了国际领跑。在肺移植领域,2018年我国18个移植中心全年完成403例肺移植,其中,无锡市人民医院肺移植团队完成150例。该团队连续4年年均完成肺移植超过100例,已跻身全球三大肺移植中心。
2.区域医疗中心建设试点方案发布。为推动分级诊疗制度,大幅减少跨省、跨区域就医,大幅缩小相关地区重点病种治疗水平与京、沪等地差距,国家发改委等多部门联合发布《区域医疗中心建设试点工作方案》。《方案》明确,试点工作将在河北、山西、辽宁、安徽、福建、河南、云南、新疆8个省区开展;将重点建设肿瘤科、神经科、心血管科、儿科、呼吸科和创伤科6个专科;30家试点输出医院主要从北京、上海两地选取,少量从武汉、长沙、广州、成都、西安5个优质医疗资源集中地方选取。
3.上海新建10个医疗急救分站。上海市嘉定区医疗急救中心江桥北急救分站近日建成启用,这标志着上海市计划在今年新建10个医疗急救分站的工作目标提前完成。据了解,“十三五”期间,上海连续4年落实“新建急救分站”市政府实事项目,已建成急救分站175个,急救站点平均服务半径为3.4公里,急救车辆配置达到每3万人1辆,急救平均反应时间缩短至13分钟,全市院前急救网络不断完善。江桥北急救分站是嘉定区的第13个急救分站。投入使用后,江桥地区的急救站点平均服务半径从3.69公里缩短至2.61公里。
4.巴西2019年登革热死亡病例已达689例。据南美侨报网4日报道,巴西卫生部最新发布的流行病学公告指出,截至10月12日,2019年巴西共报告1489457例登革热病例,与2018年同期相比增幅达到690%;已有689例登革热死亡病例,是2018年同期的5.4倍;每10万名巴西人中,登革热患者的数量约为708人;发病率最高的地区是中西部地区,每10万居民中的病患数量约为1235人;其中米纳斯吉拉斯州的登革热患者人数为482739人,154人确认死亡;圣保罗州病例数量为442014人,死亡人数为247人。
股市资讯
.
【复星医药】控股子公司复星弘创研制的ORIN1001片用于晚期实体瘤治疗获药品临床试验申请受理。
【海利生物】2019年11月6日,公司股东章建平及其一致行动人方文艳、方德基、方章乐本次增持计划实施期限届满,增持计划实施完毕。在增持计划实施期间,共增持计4264.63万股(总股本6.622%),增持总金额5.50亿元。
【泰格医药】董事、高级管理人员ZHUAN YIN于2019年10月31日至2019年11月4日期间减持43.86万股(总股本0.0586%),减持股份数量累计已经过半。
审评动向
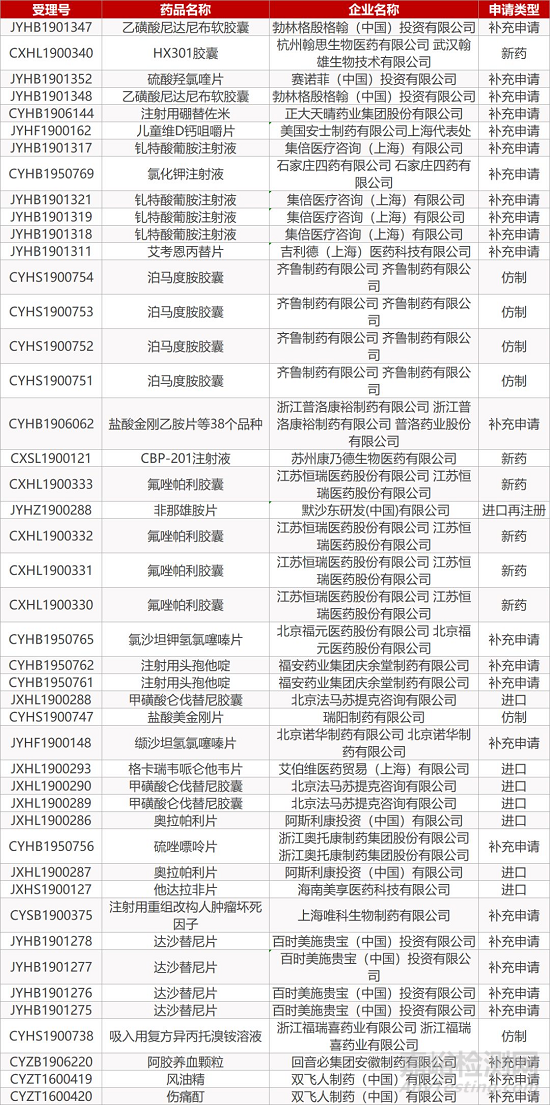
1. CDE最新受理情况(11月06日)
2. FDA最新获批情况(北美11月05日)

来源:药研发


