您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-10 10:52
摘要:本文在梳理国际人用药品注册技术协调会(ICH)发布的《化学药品的研发与生产》(Q11)及其问答文件(阶段4)相关要求的基础上,结合日常药学审评工作以及具体案例分析,就化学合成原料药中起始原料的选择问题及质控要求展开初步探讨。
关键词:化学合成原料药 起始原料 ICH Q11 案例分析
起始原料(Starting Material)既是原料药注册申请通用技术文件(CTD格式)中工艺描述的出发点,也是药品生产质量管理规范(Good Manufacturing Practice,GMP)第一次实施的引入点,还是今后药品生命周期管理(Lifecycle Management,ICH Q12)的起始点。对于化学合成原料药而言,起始原料的选择是一个首要的问题,也是原料药药学审评的重点及难点。
丁恩峰等总结了2006-2011年欧洲药品质量理事会(EDQM)公布的化学实体原料药首次申请欧洲药典适应性(CEP)证书的十大缺陷,结果起始原料及其相关问题在所有缺陷问题中所占比例约为三分之一[1]。EDQM还曾于2016年12月公布了2015年下半年至2016年上半年20份首次申请化学实体原料药CEP证书的十大缺陷[2],其中,起始原料不被监管机构所接受位列缺陷第四条,而缺陷第二条和缺陷第三条也和起始原料有关(杂质谱、制备工艺等)。由此可见,起始原料的选择需引起申请人足够的重视。
随着国际人用药品注册技术要求协调会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)发布的《原料药开发与制造》(Q11)的正式实施,ICH国家/地区对于起始原料的选择原则基本达成了共识。考虑到我国已正式加入ICH,药品监管理念和技术要求也有待和国际现行通用技术要求接轨。笔者尝试在进一步梳理ICH Q11问答文件正式稿(Questions and Answers, Step 4,2017-08- 23)[3]和原国家食品药品监督管理总局(以下简称总局)“关于发布化学药品新注册分类申报资料要求(试行)的通告”(2016年第80号)[4]的相关要求的基础上,结合日常药学审评工作,就化学合成原料药中起始原料的选择问题及质控要求展开初步探讨,以期为国内原料药注册申报提供一定的借鉴和帮助。
1 国内外相关要求
鉴于起始原料选择的重要性和复杂性,各国及ICH均出台了一系列的指导原则,国内已有文献进行了相应的归纳与总结[5-8]。同时,总局发布的“关于发布化学药品新注册分类申报资料要求(试行)的通告”(2016年第80号)及其解读[9],也进一步明确了我国化学仿制药申报资料中对于起始原料的相关要求。其中以4、5.2类申报资料为例,要求提供起始原料的选择依据,明确对终产品质量有明显影响的关键步骤均应纳入本品的生产工艺中。应根据从源头开始全程控制药品质量的要求,选择合适的起始原料,起始原料的选择应符合ICH Q11及欧盟的相关技术要求。对于外购的起始原料,需要提供起始原料生产商出具的制备工艺,并根据相关技术指导原则、技术要求对杂质进行全面的分析和控制,制订合理的内控标准,说明内控标准(尤其是杂质限度与含量)的制定依据,并提供数批外购起始原料的质检报告与相关图谱等。对外购的关键起始原料应制定供应商审计计划,并提供审计报告。
根据ICH Q7[10],起始原料是用于合成原料药的原材料、中间体或本身即是原料药。起始原料应是原料药的重要结构片段,其可以是商品,外包定制或是自行合成,通常应有明确的化学性质和结构。需要指出的是ICH Q7强调了起始原料的监管地位,明确了起始原料是GMP开始正式实施的引入点,但并没有明确起始原料的选择依据。ICH Q11[11]进一步明确了起始原料选择的6条原则,体现了基于科学和风险的监管思考,ICH Q11同时强调应综合考虑所有的原则,还要求进一步论述起始原料选择的合理性。ICH Q11虽没有明确拟定工艺应包含几步化学合成步骤,但提出通常应包含对原料药杂质谱产生影响的步骤。同时,ICH Q11还明确若采用市售化学品作为起始原料,则可以不必额外论述选择依据,但并未进一步明确市售化学品和定制化学品的区别。
考虑到ICH Q11指导原则的概况性以及实际情况的复杂性,ICH于2017年8月发布了ICH Q11问答文件正式稿[3],就起始原料的选择问题及质控要求细化为16个系列问答,进一步阐述了相关原则。笔者现节选部分重要内容概况如下。
重要的结构片断仅用于区分起始原料和一般试剂、溶剂、催化剂或其他原材料,仅单独将重要结构片断作为选择起始原料的依据不被官方接受。
明确了杂质含量水平对原料药杂质谱有影响的定义,以及ICH Q11例4中“持续存在”杂质的定义。说明对于工艺上游中早期形成的,经多步步骤后仍“持续存在”的杂质,可以基于一定的科学认知和风险评估,制订相应的控制策略,并非必需要将此杂质的形成步骤纳入生产工艺中。
明确了如何确定哪些工艺步骤会影响原料药的致突变性杂质谱。同时,并不建议将涉及致突变性杂质的所有步骤、或涉及区域选择性/立体选择性的所有步骤均包括在工艺描述中。
明确了评估是否包括足够工艺步骤所应考虑的事项,同时建议应保证在GMP条件下能有足够的工艺步骤,以降低潜在交叉污染或是今后起始原料相应变更(如,合成路线、供应商)所带来的风险。
明确了市售化学品(Commercially Available Chemical)和定制化学品(Custom Synthesized Chemical)的区别,已有多个供应商不能作为判断市售化学品的唯一依据,并进一步就市售化学品的生产规模和结构特点进行了相关阐述。若起始原料不是市售化学品,则应提供其制备路线,以及起始原料中实际/潜在存在的杂质信息。明确应提供起始原料的质量标准,并论述拟定起始原料内控标准在原料药整体控制策略中所起的作用。同时强调,申请人应对所有的起始原料进行适当的质量控制。
ICH Q11问答文件还阐述了关于起始原料的生命周期管理,以及起始原料的批准后变更管理,并提供了起始原料选择的决策树。
2 案例分析
笔者尝试结合具体案例分析,进一步就ICH Q11的相关原则进行阐述,但需要指出的是,本研究观点仅代表作者个人的现有认知,不代表任何监管机构的法规要求,同时也欢迎业界同仁的批评指正。另外,同ICH Q11所声明的事项一致,本研究所列举案例并不暗示其中涉及的起始原料或反应步骤(数目)可被接受。
2.1 关键结构单元
ICH Q11明确了起始原料应包括原料药重要的结构片段。但是,重要的结构片断仅用于区分起始原料和一般试剂、溶剂和催化剂,仅依据重要的结构片断作为起始原料的选择依据不被接受。
如图 1所示,已有文献公开了塞来昔布(Ⅴ,Celecoxib)的一种合成方法[12-14]。资料显示,对甲基苯乙酮(Ⅰ)和三氟乙酸乙酯(Ⅳ)在碱性条件下经克莱森缩合(Claisen Condensation)得1,3-二酮(Ⅱ)中间体,后与对磺酰胺基苯肼(Ⅲ)经环合反应而得塞来昔布。
图 1 塞来昔布案例分析-关键结构单元
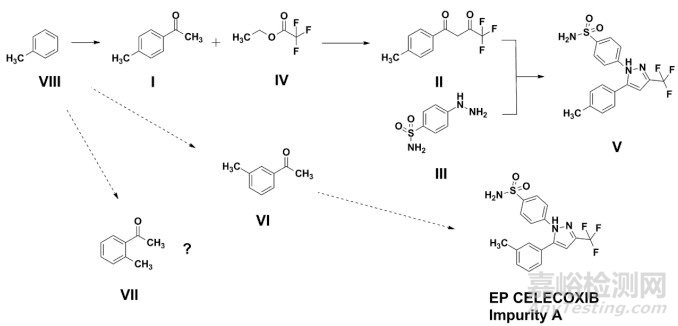
部分申请人仅依据原料药重要的结构片段作为选择依据,拟以1, 3-二酮(Ⅱ)为起始原料,并仅在成品中对杂质A进行控制。考虑到1, 3-二酮仅经一步化学合成即得塞来昔布,工艺步骤过短,则对于潜在杂质的清除能力可能有限,同时仅通过成品放行检验不利于药品整体质量控制,故建议基于生产工艺的理解和风险评估的结果,综合考虑ICH Q11相关原则,合理选择起始原料。同时,对甲基苯乙酮中还可能潜在残留邻甲基苯乙酮(Ⅶ),也应关注其相应的衍化及去除。需要指出的是,塞来昔布EP标准中并未收载邻甲基苯乙酮的相应衍生物。若申请人参照欧洲药典标准拟定成品有关物质检查法,未考察邻甲基苯乙酮及其衍生物的残留情况,考虑到尚不明确欧洲药典方法对于该杂质的检出能力,故认为申报资料的杂质谱分析尚不全面。
2.2 工艺步骤涉及致突变性或异构体杂质
ICH Q11在申报资料3.2.S.2.2部分的工艺描述中,通常应该包括对原料药的杂质谱产生影响的工艺步骤,但是,并不建议将涉及致突变性杂质的所有步骤、或涉及区域选择性/立体选择性的所有步骤均包括在生产工艺中。
如图 2所示,结合文献报道[15-16],塞来昔布合成工艺中涉及潜在致突变性杂质的步骤包括对磺酰胺基苯肼(Ⅲ)的合成步骤(对磺酰胺基苯肼本身即为潜在致突变性杂质)和三氟乙酸乙酯(Ⅳ)的合成步骤。其中,对磺酰胺基苯肼(Ⅲ)一般是由对氨基苯磺酰胺经亚硝酸钠氧化后,酸性还原而得。经进一步检索(如Scifinder),对氨基苯磺酰胺主要有两条制备路线:硝基苯途径和氯苯途径。同时,三氟乙酸乙酯一般由乙醇和三氟乙酸/三氟乙酸酐经酯化反应而得,反应的催化剂包括浓硫酸或对甲苯磺酸等,可能潜在生成硫酸二烷基酯或对甲苯磺酸二烷基酯。一般认为,硝基苯、氯苯、硫酸二烷基酯和对甲苯磺酸二烷基酯均为含有警示结构的潜在致突变性杂质。
图 2 塞来昔布案例分析-潜在致突变性杂质
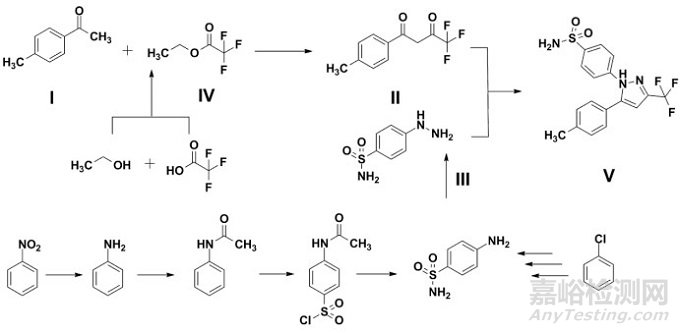
ICH Q11虽未强制要求将所有涉及产生致突变性杂质的步骤均包括在拟定工艺中,但是,建议结合ICH Q11和ICH M7[17](Genotoxic Impurities)指导原则的相关要求,全面评估原料药的合成过程中所用的试剂、溶剂、中间体(包括合成原材料)以及潜在衍生物等的致突变性,基于对合成工艺的研究(包括已有文献报道、研发数据积累等),明确工艺中实际/潜在存在的致突变性杂质,评估其形成步骤对于原料药致突变性杂质谱是否存在影响,对于各潜在致突变性杂质建立相应的控制策略,同时保证在GMP条件下应有足够的反应步骤,在此基础上,合理选择起始原料,以保证患者用药安全。另需要指出的是,图 2中塞来昔布采用汇聚型合成路线,根据ICH Q11的相关要求,则每个分支均应包含一个或多个起始原料。
如图 3所示,全国原料药工艺汇编公开了可的松醋酸酯(Ⅳ,又名醋酸可的松)的制备路线[18]。资料显示,薯蓣皂素(Ⅰ)经三步化学合成得双烯醇酮醋酸酯(Ⅱ),其再经八步化学合成得可的松醋酸酯。经分析,可的松醋酸酯分子中含有六个手性碳原子,其中8、9、10、13、14位手性碳的构型均来源于薯蓣皂素分子,且后续化学反应不涉及上述手性中心,同时考虑到其均为甾体母核的桥联碳原子,因为螺环分子的刚性结构,难以发生消旋化,除反应涉及桥联碳原子外,一般认为上述手性构型较为稳定。但是,相比薯蓣皂素,双烯醇酮醋酸酯在双氧水/氢氧化钠的作用下,立体选择性地生成α构型的环氧化物中间体(Ⅲ),其经后续化学转化,新引入了可的松醋酸酯分子中17位的手性碳构型。
图 3 可的松醋酸酯案例分析-异构体杂质
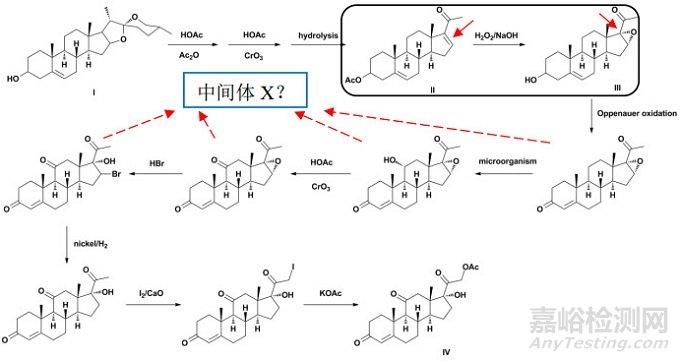
笔者认为,若不能证明中间体II经环氧化反应,立体专一地生成α构型的环氧化物,则应对潜在的β构型异构体进行研究与控制,但和ICH Q11中例4所述的事项一致,并非一定要选择中间体Ⅱ作为合成可的松醋酸酯的起始原料。若申请人能提供相应的支持性研究数据,证明:(1)中间体Ⅱ至中间体Ⅲ中所生成的β构型异构体为“持续存在”的杂质,其构型在后续的化学转化中是稳定的,或为定量转化,而非部分消旋化。(2)中间体III至可的松醋酸酯中的某个已分离的中间体(Ⅹ)中,可以建立适当的(必要时,应进行规范验证)分析方法对β构型异构体(或其衍生物)进行检测,拟定了可接受的内控标准,提供了制订依据,并作为原料药质量控制策略的一部分。(3)中间体(Ⅹ)之前的工艺步骤中没有对可的松醋酸酯杂质谱(致突变性杂质谱)有影响的杂质,也没有经评估认为难以控制的工艺步骤。(4)同时应保证在GMP条件下有足够的反应步骤。则可能会接受将上述工艺中稍下游的某个中间体(Ⅹ)作为起始原料,但所拟定的起始原料也应符合ICH Q11的其他相关要求。
2.3 市售化学品
ICH Q11明确若选择市售化学品作为起始原料,考虑到其已在非药用领域有了较为广泛的应用,则不必论述起始原料的选择依据。同时,ICH Q11问答文件还进一步明确了市售化学品和定制化学品的区别,不能仅依据已有稳定的市场供应(比如多个来源),就据此判断为市售化学品。例如,本研究图 1所示的1,3-二酮(Ⅱ)中间体,可能已有多个供应商,但基于现有认知,其仅能应用于医药领域,且对于制备工艺中相关杂质的来源、衍化及去除尚不十分了解,故认为其不为市售化学品。又例如,水杨酸是一种重要的有机合成原料,本身可作为原料药用来制备多种外用皮科制剂,还可以用来合成对氨基水杨酸(4-Aminosalicylic Acid)、乙酰水杨酸(Aspirin)等药用分子,同时也已经广泛应用于农药、橡胶、染料、食品及香料工业。如若选择水杨酸作为拟定的起始原料,一般不必进行选择依据的论述。
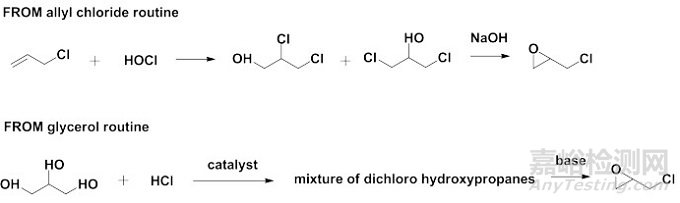
需要指出的是,虽然选择市售化学品作为起始原料可被接受,但并不意味着就可以减免相关的质量研究。例如,硝呋太尔(Nifuratel)为硝基呋喃衍生物,为抗原虫、抗真菌及抑制真菌生长繁殖的抗真菌药,主要用于治疗阴道炎及泌尿系统感染。如图 4所示,根据Stuart Warren等提出的反向合成理论(Retrosynthetic Analysis, the Disconnection Approach)[19],硝呋太尔(Ⅰ)分子的一个潜在的合成子(Synthon)为中间体Ⅱ,并可进一步逆向分解为环氧氯丙烷(Ⅲ)。众所周知,环氧氯丙烷是一种重要的有机化工原料和精细化工产品,主要应用于制备环氧树脂。若申请人基于环氧氯丙烷为市售化学品,拟以其作为起始原料用于合成硝呋太尔,可能会被接受。但是,已有文献表明[20],如图 5所示,环氧氯丙烷主要有两条制备路线:氯丙烯途径和甘油途径。其既可能作为石化产业下游产品,由氯丙烯经两步化学合成制备,也可能作为生物柴油产业下游产品,由甘油经两步化学合成制备。考虑到环氧氯丙烷存在不同的制备路线,反应体系(取代反应)较为复杂,且对于反应的区域选择性尚不了解,同时部分潜在杂质为含有警示结构的潜在致突变性杂质(如氯丙烯等),若申请人不基于环氧氯丙烷生产商所提供的生产工艺,对于各实际/潜在存在杂质进行相应的研究与控制,则认为难以科学合理地制订原料药整体的控制策略。
图 4 硝呋太尔反向合成分析
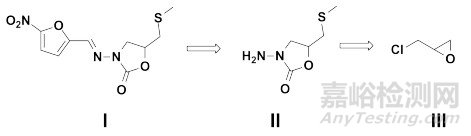
图 5 硝呋太尔案例分析-市售化学品
3 讨论
对于特定的原料药,监管机构从未规定不同申请人应采用“相近”的合成工艺,也未要求应选择“相同”的起始原料。起始原料的选择应是一个具体问题具体分析(Case by Case)的过程,应根据起始原料供应商所提供的制备路线,基于申请人对于生产工艺的理解,厘清工艺的关键步骤及工艺参数,在全面杂质研究的基础上,制订相应的控制策略,从而保证原料药的质量。
3.1 存在问题
笔者在日常审评工作中发现,部分国内注册申报资料存在如下问题:(1)在原料药首次注册申报时,拟定的工艺路线仅包括一步化学合成步骤;或在原料药批准后的生产工艺变更申请中,拟缩短原工艺路线;但均未进一步论述拟定起始原料的选择依据;(2)未结合起始原料的合成路线,对起始原料中实际/潜在存在杂质进行相关的质量研究;(3)未明确起始原料质量标准的拟定依据;(4)未提供针对起始原料供应商详细的审计报告,未明确是否同供应商签订质量保证协议和变更管理协议。上述问题反映出起始原料的选择及其质控尚未引起足够的重视,部分申请人尚未充分认识到起始原料在保证原料药的质量中所起的重要作用。
另外,起始原料的选择若不被监管机构所接受,将可能严重影响原料药的审评进程。若最终重新定义起始原料,将拟定工艺前移,原拟定起始原料作为更新后的工艺路线的中间体,则需要重新提供起始原料的相关信息,包括但不限于制备路线(如,详细的工艺流程图)、质量标准及质量研究等,还需要根据对生产工艺的研究及理解,评估原制订的原料药控制策略,比如有关物质(有机杂质、无机杂质、残留溶剂、元素杂质、潜在致突变性杂质等),是否需要进行相应的调整。值得关注的是,在今后的原料药和制剂关联申报过程中,还需要评估原料药变更起始原料后对于关联制剂的潜在影响。如若制剂已经进行了临床试验,则应评估相关差异是否会影响产品的质量,并提供支持性资料。
3.2 建议关注
笔者认为,ICH Q11及其问答文件所明确的起始原料选择的原则是一个不可分割的整体,应综合考虑所有的原则,若仅进行起始原料选择的文字表述或是非判断,而缺乏对于工艺的研究与理解,脱离整体风险评估及相应的控制策略,也是不恰当的。为合理地选择起始原料,建议关注:首先,申请人是第一责任主体。结合总局第80号文的要求及其相关解读[9],申请人应明确其既是药品研发过程的主体,也是药品整个生命周期中保证药品质量的主体。申请人有义务和责任进行全面而深入的系统研发,并不断进行多学科的自我评价,真正做到基于科学认知和研究结果,合理地选择起始原料,而绝非仅依据日后的生产成本或变更难易。其次,应基于风险管理、并结合控制策略。为避免引入不可控的因素,进一步确保用药安全,应从源头开始全程控制药品的质量。申请人应根据相关技术指导原则的要求,对杂质进行全面的分析和控制,明确可能对后续反应产生影响的杂质或可能潜在引入成品的杂质,并在此基础上,采用适当的分析方法进行控制,制订科学合理的内控标准。另外,考虑到起始原料选择的复杂性,指导原则难以涵盖各种实际问题。借鉴国外新药上市时,监管机构和申请人会定期进行阶段性讨论。如有可能,建议申请人就起始原料选择的合理性问题进行沟通交流。
参考文献
[1] 丁恩峰, 高海燕. 原料药国际注册常见缺陷深度分析[J]. 医药工程设计, 2012, 33(6): 37-40.
[2] Top Ten Deficiencies New Applications for Certificates of Suitability for Chemical Purity[EB/OL].(2016-12)[2019-01-29]. https://www.edqm.eu/sites/default/files/cep_to_monographs_of_pheur_march2017.pdf.
[3] ICHQ11 Questions and Answers[EB/OL]. (2016-10-13)[2019-01-29]. https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q11/Q11IWG_Step4_QA_2017_0823.pdf.
[4] 国家食品药品监督管理总局. 2016年第80号国家食品药品监督管理总局关于发布化学药品新注册分类申报资料要求(试行)的通告[S]. 2016.
[5] 王宏亮, 陈震. 化学合成原料药起始物料国内外相关要求的比较[J]. 中国新药杂志, 2014, 23(9): 998-1003.
[6] 杜爽, 梁毅. 化学合成原料药申报过程中起始物料的选择与控制[J]. 中国医药工业杂志, 2018, 49(8): 1172-1176.
[7] 顾文平, 徐敏. 化学合成原料药申报中起始物料选择的探讨[J]. 科技创新与应用, 2016(17): 66.
[8] 操锋, 马玉楠. 化药原料药当前药学审评技术要求初探[J]. 中国药科大学学报, 2014, 45(3): 278-280.
[9] 黄晓龙. 化学仿制药新申报资料要求简介[J]. 中国新药杂志, 2016, 25(18): 2103-2108.
[10] ICHQ7[EB/OL]. (2000-11-10)[2019-01-29]. https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q7/Step4/Q7_Guideline.pdf.
[11] ICHQ11[EB/OL]. (2012-05-01)[2019-01-29]. https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Quality/Q11/Q11_Step_4.pdf.
[12] G.D. Searle &Co..Substituted Pyrazolyl Benzenesulfonamide for the Treatment of Inflammation: US5521207[P].1996-05-28.
[13] AUROBINDO PHARMA LTD, AMBATI V RAGHAVA REDDY, GARAGA SRINIVAS, MALLELA SAMBHU PRASAD SARMA, MEENAKSHISUNDERAM SIVAKUMARAN. AN IMPROVED PROCESS FOR THE PREPARATION OF CELECOXIB全球专利: WO2010095024(A2)[P]. 2010-08-26.
[14] 张邦乐, 梅其炳, 何炜, 等. 塞来昔布的合成[J]. 中国新药杂志, 2002, 11(11): 859-861. DOI:10.3321/j.issn:1003-3734.2002.11.010
[15] EPAR-Scientificdiscussion[EB/OL].(2011-04-06)[2019-01-29]. https://www.ema.europa.eu/documents/scientific-discussion/onsenal-epar-scientific-discussion_en.pdf.
[16] AmbavaramVijayaBhaskar Reddy, NandigamVenugopal, GajulapalleMadhavi. A Selective and Sensitive LC-MS/MS Method for the Simultaneous Determination of Two Potential GenotoxicImpurities in Celecoxib[J]. Journal of Analytical Science and Technology, 2014, 5: 18. DOI:10.1186/s40543-014-0018-1
[17] ICH M7[EB/OL].(2017-03-31)[2019-01-29].https://www.ich.org.
[18] 《全国原料药工艺汇编》编委会. 全国原料药工艺汇编[M]. 北京: 国家医药管理总局, 1980: 530-535.
[19] Stuart Warren, Paul Wyatt.有机合成: 切断法(原书第2版)[M].药明康德新药开发有限公司, 译.北京: 科学出版社, 2010.
[20] Epichlorohydrin[EB/OL]. (2018-11-29)[2019-01-12]. https://en.wikipedia.org/wiki/Epichlorohydrin.
龚青, 仲宣惟, 田洁, 孙桂霞
1. 国家药品监督管理局药品审评中心, 北京 100022
2. 中国食品药品检定研究院, 北京 100050

来源:xml-data


