您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-07-15 10:15
01
引言
任何先天性或后天性的因素,引起晶状体透明度降低或者颜色改变所导致的光学质量下降的退行性改变称为白内障。其中年龄相关性白内障是指中老年人的晶状体发生浑浊现象的一种致盲性疾病,是白内障中最常见的疾病类型,随着年龄的增加,发病率明显增高。
白内障在临床上通常表现为无痛性、渐进性的视力下降,裂隙灯检查可见晶体皮质、晶体核或晶体后囊下明显混浊,随着疾病的进展,病人的视力逐渐丧失。白内障的治疗方式包括药物治疗及手术治疗,其中手术治疗是目前最有效的治疗方式。
早期的白内障手术只摘除浑浊的晶状体而不植入人工晶体,虽然患者术后视力获得明显改善,但晶状体缺乏将导致的屈光不足使患者处于高度远视的状态,此时患者需要佩戴高度的远视镜对视力进行矫正。随着科学技术的发展,晶状体摘除联合人工晶体植入术因其优异的视力改善而受到临床工作者的青睐,其已成为当今主流的白内障手术方式。
人工晶体为由人工合成材料制成的一种代替人眼晶状体的特殊透镜。常见的材料有硅胶、聚甲基丙烯酸甲酯(PMMA)、水凝胶等,其通常由光学透镜和周边的支撑襻组成,光学部分的口径一般为6mm左右,与人瞳孔的口径相当,支撑襻的作用为固定人工晶体[1]。
人工晶体从光学设计上可分为单焦点和多焦点设计,目前国内注册的产品多为单焦点球面或非球面人工晶体。单焦点人工晶体顾名思义只有一个焦点,其光学部分为一个简单的透镜,无自身调节能力,因此其只能将一定距离的物体成像在视网膜上,大部分患者使用单焦点人工晶体时会选择看远,故患者术后看近物时(如读书、看报纸)需要佩戴老花眼镜进行矫正[1]。
为克服单焦点人工晶体只能提供单程视力的缺点,多焦点人工晶体应运而生,其在单个透镜上设计出多个焦点,使远、中、近距的物体均能成像,多焦点人工晶体能提供较好的全程视力。
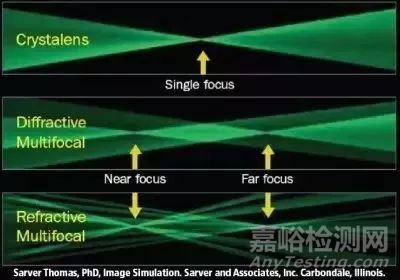
上图由上到下依次为:单焦点设计、衍射多焦点设计、折射多焦点设计。
可以看出,多焦点设计能对远、中、近的物体同时成像,提供较好的全程视力。
02
临床试验简介
我国对于人工晶状体的临床试验有专门的指导原则,虽然指导原则中阐述其适用范围为用于无晶状体眼植入的单焦点人工晶体,但无论哪一种人工晶体,其临床目的都是相同的——即替换患者病变的晶状体,从而改善患者的视力。因此,该指导原则对在境内开展的人工晶体类产品临床试验均具有一定的指导意义。以下就人工晶体类产品的临床试验要点展开介绍。
2.1 试验设计与对照选择
对于已有同类产品的人工晶体,应优先选择平行阳性对照设计。平行设计可确保临床试验的影响因素在试验组和对照组的分布中趋于相似,具有试验质量易于控制的优点。
在对照产品选择方面,应优先选择结构、材料、植入位置、光学设计相同或相近,适用范围相同的产品,尤其应选择光学设计相同的产品作为对照产品,因为光学设计不同的产品,其临床试验评价的重点可能有所不同。
若试验产品在设置对照方面不可行(如申报产品具有目前人工晶体所不具有的新适应症),则可考虑单组目标值设计,需要注意的是,目标值应的制定应有充分的考量,且需保证适应症为非自愈性疾病以及目前无有效的治疗手段,必要时可进行小样本临床试验,以探索试验产品的临床性能是否符合临床预期。
2.2 主要评价指标
无论哪一种人工晶体,其主要的临床目标均为改善患者的视力,因此,对患者进行视力测量是评价产品最直接、最客观的评价方式。根据《人工晶状体临床试验指导原则》的要求,用于无晶状体眼植入的单焦点人工晶体应使用“治疗有效率”作为主要评价指标,治疗有效的定义为:术后6个月术眼的最佳矫正视力达到4.7(20/40)或以上。值得一提的是,无论对于何种人工晶体,若其注册临床研究使用平行阳性对照设计,相比起“最佳矫正视力”,更推荐使用“治疗有效率(即最佳矫正视力达标率)”作为主要评价指标。这是因为“最佳矫正视力”为定量指标,其量值易受试验中各种因素的影响,在制定界值的时候除了考虑界值本身的临床意义外还需考虑指标本身的波动性,因此,采用定量指标作为主要评价指标时,往往意味着更高的试验质量要求,同时,因定量指标波动性往往较定性指标要大,因此采用“最佳矫正视力”作为主要评价指标时需要更大的样本量,试验难度也较使用“最佳矫正视力达标率”要高。
当采用“最佳矫正视力达标率”作为主要评价指标时,达标标准的制定尤为关键,对于主要针对年龄相关性白内障的人工晶体产品,达标标准建议定在4.7(20/40),若产品主要针对有晶状体眼的植入,则达标标准可以相应提高,如定在4.9(20/25)。无论采用何种达标标准,在标准制定时均应与研究者进行充分的讨论。
2.3 随访周期
人工晶体的随访周期应至少为植入术后的12个月。具体的访视频率可参考《人工晶状体临床试验指导原则》进行制定。从既往的研究来看,人工晶体类临床试验的失访率较低,这可能与该试验不涉及侵入性的有创检查有关。较低的失访率可在一定程度上降低试验的样本量,但为保险起见,试验的预计脱落率不建议低于15%。
2.4 样本量的考虑
对于单焦点设计的人工晶体,由于产品只有一个焦平面,对应只矫正远距或近距视力,故单焦点设计的人工晶体仅有一个“最佳矫正视力达标率”(即一个主要指标),在样本量估算的过程中,应同时考虑我国指导原则对单焦点设计的人工晶体产品界值及样本量的最低要求。考虑到FDA对此类产品的要求为术后12个月最佳矫正视力达标率不低于92.7%(达标标准与我国指导原则相同)[2],因此样本量估算时,界值的设置不宜过大。
对于多焦点设计的人工晶体,如混合型设计的多焦点人工晶体,其一般有两个或三个焦平面,对应矫正远距、中距与近距视力,此时产品将有两个或三个“最佳矫正视力达标率”(即两个或三个主要指标)。多个主要指标将涉及多重比较的问题,故在样本量估算时需要对II类错误进行调整。需要注意的是,多焦点人工晶体在进行样本量估算时需明确评价“最佳矫正视力达标率”时的矫正状态,一般可选取最佳矫正远视力(CDVA)达标率、远距矫正下的中距视力(DCIVA)达标率及远距矫正下的近视力(DCNVA)达标率作为主要评价指标,以全面评价多焦点人工晶体的临床性能。
2.5 其他需要注意的问题
(1) 出于对受试者保护的考虑,此类产品的临床试验建议纳入仅需对单眼进行干预的受试者。
(2) 产品的植入操作对产品有效性及安全性均有较大的影响,在进行临床试验前需对研究者进行充分的操作培训。
(3) 临床试验应覆盖产品的使用规格。
(4) 对于用于无晶状体眼的人工晶体产品,为排除基线疾病的影响,应选择I期植入手术的患者进行临床试验。
参考文献
[1] 李湘宁,李晓云. 人工晶状体的发展趋势及展望[J].光学仪器, 2017, 39(6):77-83.
[2] StarkWJ, Worthen DM, Holladay JT. The FDA report on IOLs[J]. Ophthalmology.1983_90_311-17

来源:奥咨达


