您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2018-04-18 19:11

主要内容
1. CNAS‐RL01《实验室认可规则》的实施安排及主要变化
2. CNAS‐CL01《检测和校准实验室能力认可准 则》的转换政策
3. CNAS‐CL01‐G001~G004的主要变化
主要修订原因
ISO/IEC 17011:2017标准发布
ISO/IEC 17025:2017标准发布
CNAS-RL01:2018《实验室认可规则》发布实施安排
发布时间
• 2018年3月1日发布
• 2018年3月1日实施
替代版本
• 替代CNAS‐RL01:2016
证书换发
• 认可证书有效期6年:执行CNAS‐RL01:2018• 认可证书有效期3年:执行CNAS‐RL01:2015
CNAS-RL01:2018《实验室认可规则》主要变化
1. 术语和定义中删除复评审和换证复评审定义
复评审采用ISO/IEC 17011:2017的定义,因此在文件中不再重复引用。
复评审:为更新认可周期而实施的评审。
【源自ISO/IEC 17011:2017 3.23】
不再使用“换证复评审”的术语。
2. 明确区分认可周期与认可证书有效期
认可周期开始于做出初次认可决定或复评决定之日或之
后,最长不应超过5年。
【源自ISO/IEC 17011:2017 7.9.1】
文件原文:
5.1.7 发证与公布
3.取消换证复评审的概念
【依据:CNAS-RL01:2018 5.1.7、5.4】
文件原文:
5.1.7 发证与公布
期一般为6年。认可证书有效期到期前,如果获准认可实验室需继续保持认可资格,应至少提前1个月向CNAS秘书处表达保持认可资格的意向。
5.1.7.3 CNAS秘书处根据实验室维持认可资格的意向,以及在认可证书有效期内历次评审的结果和历次认可决定,换发认可证书。
5.4.2 复评审不需要获准认可实验室提出申请。
实施安排认可委(秘)[2018]34号
对于已获认可证书有效期为3年的实验室(即证书有效期到
2019年3月1日前),境内实验室应在认可证书有效期到期前6个月向CNAS秘书处提出复评审申请,境外机构应在认可证书有效期到期前9个月向CNAS秘书处提出复评审申请(均需在“实验室/检验机构业务系统”中填写认可申请),交纳申请费。CNAS秘书处在认可有效期到期前根据获准认可实验室的申请组织复评审。复评审通过后,换发有效期为6年的认可证书。
【依据:CNAS-RL01:2015 5.4】
4. 进一步明确诚信问题的含义
文件原文:
6 申请受理要求
故意违反认可要求的行为。
注:违反申请资料真实可靠的行为包括但不限于:
—— 申请资料与事实不符;
—— 提交的申请资料有不真实的情况;
—— 同一材料内或材料与材料之间多处出现自相矛盾或时
间逻辑错误;
5. 增加权利和义务
文件原文:
11.1 CNAS的权利和义务
11.2 实验室的权利和义务
11.2.2 获准认可实验室的权利和义务
11.2.2.17 实验室有义务及时将认可资格的暂停、缩小、撤销及相关后果告知其受影响的客户,不得有不当延误。
CNAS-CL01:2018《检测和校准实验室能力认可准则》发布实施安排
发布时间
• 2018年3月1日发布
• 2018年9月1日实施
替代版本
• 替代CNAS-CL01:2006
转化政策
CNAS-CL01-G001:2018《CNAS-CL01<检测和校准实验室能力认可准则>应用要求》主要变化
1. 根据CNAS‐CL01:2018,对内容进行调整。
2. 对授权签字人“同等能力”的解释变化。
文件原文:
6.2.2 c) 授权签字人的任职资格要求
注1:“同等能力”指需满足以下条件:
a)大专毕业后,从事专业技术工作8年及以上;
b)大学本科毕业,从事相关专业5年及以上;
c)硕士学位以上(含),从事相关专业3年及以上;
d)博士学位以上(含),从事相关专业1年及以上。
(红色字体为变化内容,与资质认定要求取得一致。)
3. 明确对设施租赁年限
文件原文:
6.3.1 实验室的设施应为自有设施,并拥有设施的全部使用权和支配权;应有充足的设施和场地实施检测或校准活动,包括样品储存空间;对相互干扰的设备必须进行有效的隔离。
注1:“自有设施”是指购买或长期租赁(至少2年)并拥有完全使用权和支配权的设施。......
(2年,明确租赁年限。)
4. 明确“用于支持实验室运作”的服务内容
文件原文:
6.6 外部提供的产品和服务
(6.6.1 c为新增内容。)
5. 增加“抽样”的解释
文件原文:
7.3 抽样
续的检测或校准活动时,......
(新增“注”解释“抽样”)
6. 减化“结果报告”的内容
文件原文:
7.8.7 报告意见和解释
注1:根据检测或校准结果,与规范可客户的规定限量做出的符合性判断,不属于本准则所规定的“意见和解释”。“意见和解释”的示例:......
7. 管理体系内容的变化
文件原文:
8.1 方式
(8.1.3为新增内容。)
8. 修改记录保存期限
文件原文:
8.4 记录控制(方式A)
8.4.2 除特殊情况外,所有技术记录,包括检测或校准的原
始记录,应至少保存6年。......人员或设备记录应随同人员工作期间或设备使用时限全程保留,在人员调
离或设备停止使用后,人员或设备技术记录应再保存6年。......
(其中“6年”与资质认定要求一致。)
9. 给出内审和管理评审周期的建议
文件原文:
8.8 内部审核(方式A)
注:建议内部审核每12个月进行一次。内部审核的周期和覆盖范围应当基于风险分析。CNAS-GL011......。
8.9 管理评审(方式A)
8.9.1 ......
注1:建议管理评审每12个月进行一次。CNAS-GL012......
10. 表述调整,例如:
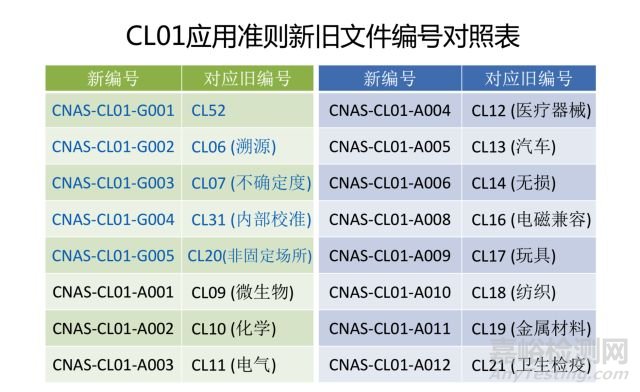
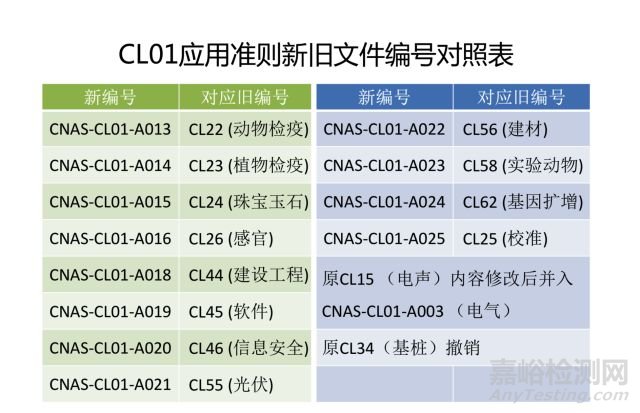
培训活动有效性验证( CL52中5.2.3) → 6.2.5f) 人员监控
设备校准要求(CL52中5.6.1)→6.4.6判断设备是否需校准及对不需校准设备的核查要求+6.4.7校准方案要求
分包要求(CL52中4.5.1→6.6.2b)当实验室需从外部获得实验室服务时,.......
CL52中删除:5.4.3实验室应制定程序来控制检测或校准方法的设计、开发和确认过程。
CL52中5.4.1 → 7.2.1.1方法的控制和管理要求+7.2.1.3标准跟踪及使用要求......
CNAS-CL01-G002:2018《测量结果的计量溯源性要求》主要变化
1. 根据CNAS‐CL01:2018,对内容进行调整。其中4.1~4.4为CL01的相关内容,4.6(原4.4)根据CL01调整表述。
2. 增加文件确认的要求
文件原文:
4.9 合格评定机构应对作为计量溯源性证据的文件(如校准证书)进行确认。确认应至少包含以下几个方面(以校准证书为例):
a)校准证书的完整性和规范性;b)根据校准结果作出与预期使用要求的符合性判定;c)适用时,根据校准结果对相关设备进行调整、导入校准因子或在使用中修正。
CNAS-CL01-G003:2018《测量不确定度的要求》主要变化
1. 根据CNAS‐CL01:2018,对内容进行调整。其中新增的4.4、4.5、8.10条款内容来源于CL01的相关内容。
2. 修改4.3条款,增加“测量不确定度的表示和使用”也应符合GUM及其补充文件的规定。
3. 4.5条款,“当做出与规范或标准的符合性声明时,实验室应考虑测量不确定度的影响,明确判定规则,所用判定规则应考虑到相关的风险水平(如错误接受、错误拒绝以及统计假设)。应将所使用的判定规则制定成文件,并加以应用。
注:判定规则的制定可参考ISO/IEC 指南98-4《测量不确定度在合格评定活动中的应用》和RB/T 197《检测和校准结果及与规范符合性的报告指南》。”
4. 修改5.1条款,要求校准实验室即使对自己的设备的校准,也要对测量结果评定测量不确定度。
5. 新增6.6条款,“不确定度的量纲应与对应的测量范围或测量结果的量纲相同,或使用相对不确定度表示,否则应给出必要的说明。”
6. 修改8.2条款,用“需要时,应评估这些测量结果的不确定度。”来代替原CL07中“当不确定度与检测结果的有效性或应用有关”、或在用户有要求时、或当不确定度影响到对规范限度的符合性时、当测试方法中有规定时和CNAS有要求时(如认可准则在特殊领域的应用说明中有规定),检测报告必须提供测量结果的不确定度。”
CNAS-CL01-G004:2018《内部校准要求》主要变化
1. 新增4.2条款“实验室的管理体系应覆盖开展的内部校准活动,并对内部校准活动的范围建立文件清单。”
2. 调整原CL31的4.6条款为4.7条款,用“实验室应对全部内部校准的测量结果评定测量不确定度,适用时,应在校准证书中报告测量不确定度。”代替原CL31“4.6内部校准活动应满足CNAS对校准领域测量不确定度的要求。”。
3. 修改5.1.1条款,当申请认可的检测能力存在内部校准活动时,增加“实验室应在申请时在相关设备的溯源方式栏注明,并提交内部校准清单”的要求。
• CNAS‐RL01:2015有效期至2019年3月1日
5.1.7.1 CNAS认可周期通常为2年,即每2年实施一次复评审,做出认可决定。
5.1.7.2 CNAS秘书处向获准认可实验室颁发认可证书,认可证书有效期一般为6年。......
对于已获认可证书有效期为6年的实验室(即2016年3月1日后颁发的认可证书),CNAS每2年对已获认可的实验室安排一次复评审,复评审均采用现场评审的方式,评审范围涉及认可准则的全部要素和已获认可的全部技术能力。认可证书到期后,已获认可实验室不必再填写和提交认可申请书,只需表达维持认可的意愿后,CNAS根据实验室在证书有效期内的表现,直接换发认可证书。
5.1.7.2 CNAS秘书处向获准认可实验室颁发认可证书,认可证书有效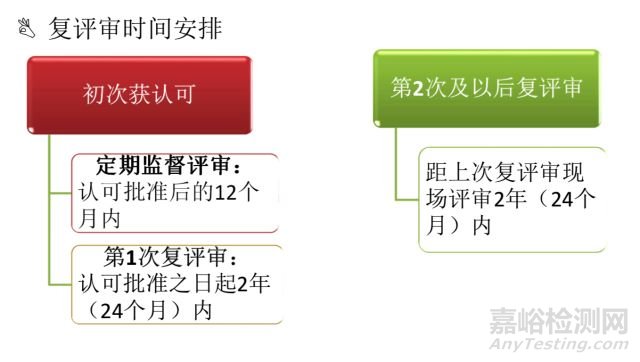
6.1 提交的申请资料应真实可靠,申请人不存在欺诈、隐瞒信息或
—— 与其他申请人资料雷同等。
11.1.11 除需要公开的信息外,CNAS有义务对在实验室认可活动中获得或产生的其他信息,如商业、技术等信息保密。
• 2006版于2020年11月30日废止
6.6.1 c) 可能影响实验室活动的用于支持实验室运作的产品和服务主要包括 :能力验证、审核或评审服务。
7.3.1b) 实验室如需从客户提供的样品中取出部分样品进行后
注: 抽样除包含从一个批次抽取样品的活动外,还包含检测领域常用的概念“采样”和“取样”。
删除CL52中5.10.2 检测报告和校准证书
删除CL52中5.10.5 意见和解释b) 、 c)
CL52中5.10.5 意见和解释a)中“根据检测或校准结果,与规范或客户的规定限量做出的符合性判断,不属于本准则所规定的 ‘意见和解释’”变更为7.8.7.1的注1。即:
7.8.7.1 实验室可以选择是否作出意见和解释,并在管理体系中予以明确,并对其进行有效控制,包括合同评审。
CL52中4.2.1 → CL01‐G001中8.1.1
8.1.3 如果实验室采用方式B建立和运行管理体系,实验室也应提供证据证明实验室活动的管理和运作满足CNAS‐CL01中第8.2条款至第8.9条款中规定的管理体系要求。
8.8.2b) ......
技术管理者(CL52中4.1.5h))→5.2实验室应明确对实验室活动全面负责的人员,......

来源:CNAS


