您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-05-09 20:42
【问】免临床评价目录中的产品,应如何提交评价资料?
【答】根据《医疗器械注册与备案管理办法》第三十四条,有下列情形之一的,可以免于进行临床评价:
(一)工作机理明确、设计定型,生产工艺成熟,已上市的同品种医疗器械临床应用多年且无严重不良事件记录,不改变常规用途的;
(二)其他通过非临床评价能够证明该医疗器械安全、有效的。
那么对于那些被列入免于临床评价医疗器械目录中的产品来说,应如何提交评价资料呢?
依据《列入免于临床评价医疗器械目录产品对比说明技术指导原则》,对于列入《免于临床评价医疗器械目录》(以下简称《目录》)产品,注册申请人需提交申报产品相关信息与《目录》所述内容的对比资料和申报产品与已获准境内注册的《目录》中医疗器械的对比说明。具体需提交的资料要求如下:
(一)提交申报产品相关信息与《目录》所述内容的对比资料;
(二)提交申报产品与《目录》中已获准境内注册医疗器械的对比说明,对比说明应当包括《申报产品与目录中已获准境内注册医疗器械对比表》和相应支持性资料。若经对比,申报产品与对比产品存在差异,还应提交差异部分对安全有效性影响的分析研究资料。二者的差异不应引起不同的安全有效性问题,即申报产品未出现对比产品不存在的且可能引发重大风险和/或引起显著影响有效性的问题。
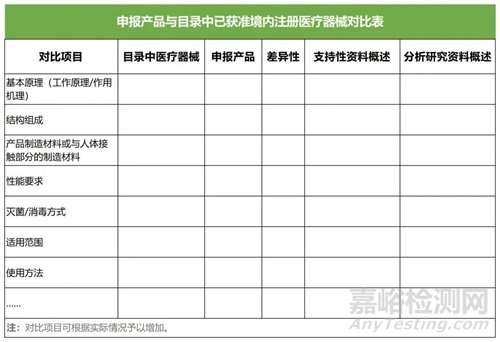
提交的上述资料应能证明申报产品与《目录》所述的产品具有基本等同性。若无法证明申报产品与《目录》所述的产品具有基本等同性,则应开展临床评价。

来源:Internet


