由于口腔环境复杂,如潮湿、细菌和动态力学等,口腔伤口治疗面临挑战,因此,快速密封伤口成为十分必要的需求。虽然一些材料已经实现了粘附和抗菌功能,但如何有效解决强粘附和按需清除之间的矛盾仍是一个难题。
来自四川大学的Weifeng Zhao和赵长生团队通过阳离子单体[2-(丙烯酰氧基)乙基]三甲基氯化铵(ATAC)、疏水性单体乙二醇苯醚丙烯酸酯(PEA)和 N-异丙基丙烯酰胺(NIPAAm)的自由基共聚,设计了一种可逆粘附性水凝胶。阳离子季铵盐起静电作用,疏水基团起疏水作用,PNIPAAm 链段起氢键作用,从而产生强大的粘附力。此外,与纯 PNIPAAm 不同的是,由于 ATAC 和 PEA 的作用,该水凝胶的 LCST 为 40.3 ℃,因此处理后可以用 40 ℃ 的水快速去除。此外,该水凝胶还具有出色的消肿率(80%∼)和抗菌效率(90% 以上)。动物实验证明,水凝胶能有效减少炎症浸润,促进胶原蛋白沉积和血管再生。因此,水凝胶作为一种多功能敷料在口腔伤口处理方面具有广阔的应用前景。相关工作以题为“Reversibly Adhesive, Anti-Swelling and Antibacterial Hydrogels for Tooth-Extraction Wound Healing”的文章发表在2024年02月14日的国际顶级期刊《Advanced Healthcare Materials》。
1. 创新型研究内容
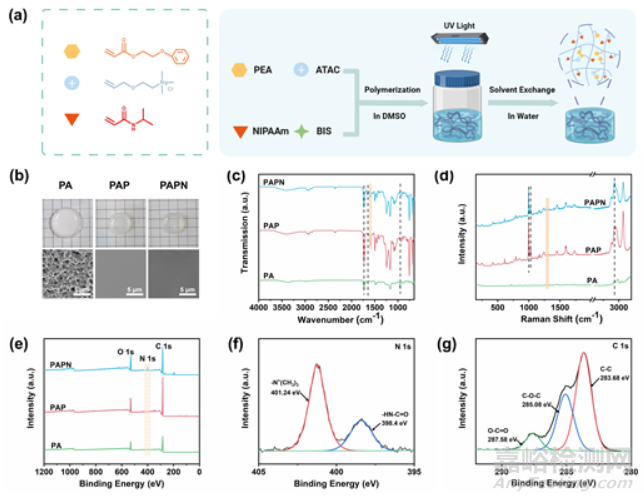
本研究开发了一种兼具消肿和抗菌特性的多功能水凝胶粘合剂,它能以可逆粘合的方式快速封闭伤口,可作为治疗拔牙窝的专用敷料。如图 1a 所示,水凝胶 PAPN 是由阳离子单体[2(丙烯酰氧基)乙基]三甲基氯化铵(ATAC)、疏水性乙二醇苯醚丙烯酸酯(PEA)和 N-异丙基丙烯酰胺(NIPAAm)通过自由基共聚,然后进行溶剂交换制备而成。阳离子季铵盐不仅能杀菌,还能通过静电作用提供粘附力;疏水基团提供疏水粘附力,增强相邻阳离子基团的静电作用,限制水凝胶的膨胀;聚(N-异丙基丙烯酰胺)(PNIPAAm)链段通过调节氢键实现温度可调的可逆粘附。PAPN 水凝胶显著的抗溶胀特性可使其在口腔治疗过程中保持稳定的机械和粘附性能。此外,PAPN 的按需脱落特性使其可以用温水无痛去除,避免了因更换敷料而造成的二次伤害。本研究还验证了水凝胶的温度响应,并探索了可逆粘附的机理。体外实验证明了水凝胶的抗菌特性和细胞相容性。此外,本研究还进行了动物实验,以验证水凝胶在伤口密封和组织愈合方面的性能。
【水凝胶的制备和表征】
本研究通过自由基共聚合成了 PAPN 水凝胶,合成过程如图 1a 所示。以二甲基亚砜(DMSO)为溶剂,用 ATAC、PEA 和 NIPAAm 三种单体制备水凝胶,并通过紫外线交联,然后用水进行溶剂交换。此外,只用 ATAC 制备的水凝胶被命名为 PA,而 PAP 水凝胶是用 ATAC 和 PEA 单体制备的。如图 1b所示,在与水交换溶剂后,PA 水凝胶的尺寸明显增大。这可能是由于季铵盐的亲水性和水凝胶网络的多孔性促进了 PA 水凝胶的溶胀。对于 PAP 和 PAPN 水凝胶来说,水是一种劣质溶剂。因此,在替换了良好的溶剂二甲基亚砜后,分子链会从拉伸变为团聚,水凝胶的体积也会缩小,凝胶的颜色也会从透明变为半透明。图 1c 显示了 PA、PAP 和 PAPN 水凝胶的傅立叶变换红外光谱。所有水凝胶都在 951 cm-1 处有 -CH2-N+(CH3)3 吸收峰,在 1731 cm-1 处有 C=O 羰基峰。此外,PAP 和 PAPN 水凝胶都在 1599 cm-1 处含有苯环骨架振动, 而 1648 cm-1 处的酰胺羰基峰只在 PAPN 凝胶中观察到。根据拉曼光谱(图 1d),三种水凝胶样品都含有 2930 cm-1 处的 -CH3 对称振动峰。在引入苯环后,PAP 和 PAPN 中观察到了单取代苯环的 995 cm-1 处的 C-C 对称振动和 1027 cm-1 处的 C-H 振动。
图1 PAPN 水凝胶制备过程示意图
【水凝胶的粘附性能】
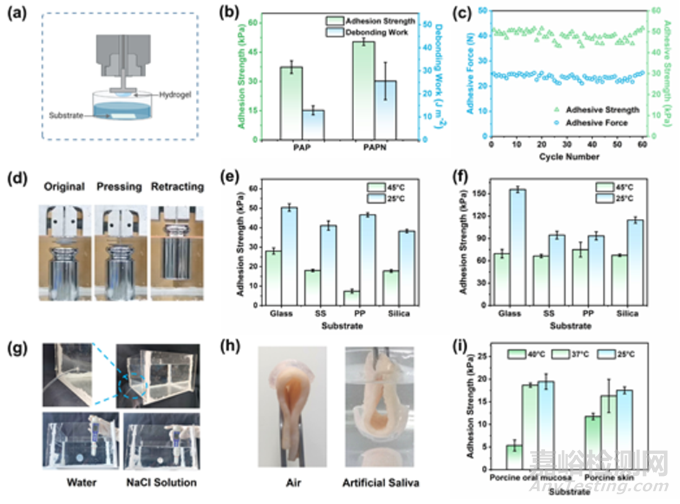
湿润条件下稳定而强大的粘附力对于在牙槽窝拔牙创中应用凝胶至关重要。本研究通过测量水凝胶脱离基底表面所需的力来确定粘附强度(图 2a)。与 PAP 凝胶相比,PAPN 凝胶在 25 ℃ 时与玻璃的粘附强度和粘附能量更高,分别为 50.4 kPa 和 25.56 J m-2(图 2b)。PAPN 的粘附性能可归因于三个方面:PEA 与基质之间的疏水作用、季铵盐与基质表面之间的静电作用以及 PNIPAAm 与基质之间的氢键作用。此外,反复粘附测试表明,PAPN 水凝胶在经过 60 次粘附-脱粘循环后仍能保持原有的强大水下粘附力(图 2c)。图 2d 表明,直径为 25 毫米、厚度为 1.0 毫米的 PAPN 水凝胶可在水中快速粘附 500 克重物 10 秒钟,然后将其从水中提升到空气中。
图2 粘附试验示意图以及水凝胶在水中(25 ℃)与玻璃基底的粘附强度
【PAPN水凝胶的可逆粘附机制】
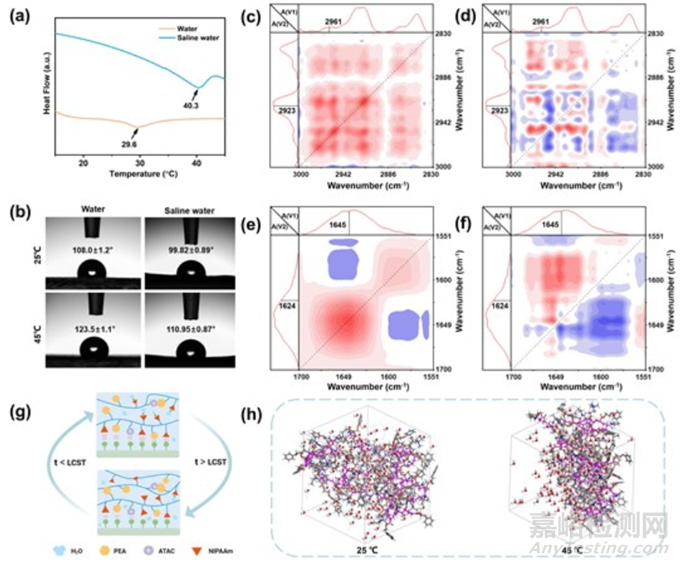
众所周知,PNIPAAm 是一种典型的热收缩聚合物,在 32 ℃ 左右会发生亲水-疏水转变,导致体积突变。差示扫描量热仪(DSC)证实,PAPN 水凝胶在水和 NaCl 溶液中的 LCST 分别为 40.3 ℃ 和 29.6 ℃(图 3a)。当温度从 25 ℃ 升高到 45 ℃ 时,PAPN 水凝胶与水和 NaCl 溶液的接触角增加了 10° 以上(图 3b),这表明当温度超过 LCST 时水凝胶的疏水性增加了。为了进一步探讨可逆粘附机理,本研究使用傅立叶变换红外光谱结合广义二维相关光谱(2DCS)在 25-45 ℃下详细分析了 PAPN 中的氢键相互作用。通过合并 3000-2830 cm-1 的同步和非同步光谱,可以确定基团的响应顺序(2DCS 中的红色和蓝色区域代表正交叉峰和负交叉峰)。根据野田定律(Noda’s rule),对于两个给定的吸收峰,如果同步光谱和异步光谱的符号相同,则文波数较大的吸收峰会先发生变化;相反,如果符号相反,则文波数较小的吸收峰会先发生变化。从图 3c 和 d 中可以看出,(2961,2923)cm-1 在同步图中有一个正交叉峰,而在异步图中有一个负交叉峰。推断加热过程中 2923 cm-1 波段的强度先于 2961 cm-1 波段发生变化。这表明在加热过程中,PAPN 水凝胶首先沿着主链塌缩聚集,然后在侧链上脱水,水分子从水凝胶网络中排出。
图3 PAPN 凝胶在水和 0.7 mol L-1 NaCl 溶液中的 LCST以及不同温度下水凝胶与水和 0.7 mol L-1 NaCl 溶液的接触角。
【水凝胶的抗膨胀和机械性能】
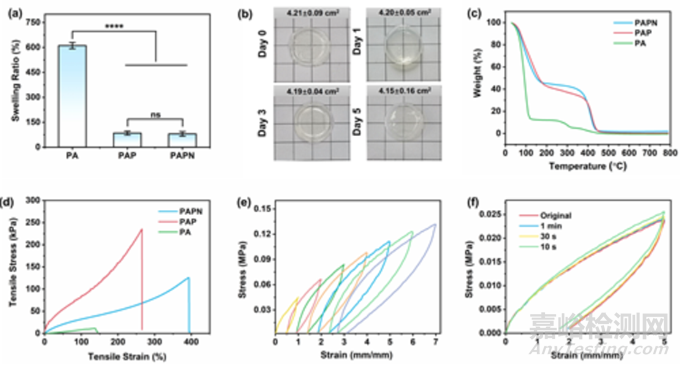
为了评估水凝胶在真实口腔条件下的实际性能,本研究将水凝胶浸泡在人工唾液中测试其溶胀率。图 4a 显示 PA 水凝胶的溶胀率最大,约为 611%。相比之下,PAP 和 PAPN 水凝胶的膨胀率明显下降,几乎只有 PA 水凝胶的八分之一。其中,PAPN 凝胶的膨胀率仅为 80% 左右。为了更好地量化水凝胶在溶胀过程中的面积变化,本研究计算了 PAPN 水凝胶在第 0、1、3 和 5 天的平均溶胀面积,结果显示几乎没有差异(图 4b)。低膨胀率表明 PAPN 水凝胶能更好地适应复杂的口腔环境,保持形态和机械性能的稳定,并能长期牢固地粘附在拔牙窝的创面上。此外,PAPN 水凝胶在降解 3 天后显示出较低的降解率(6.2%)。这些结果表明,PAPN 水凝胶在复杂的口腔环境中具有广阔的应用前景。图 4c 中的热重分析(TGA)曲线显示,三种水凝胶都在 80-100 ℃ 之间首次失重,这是由于水分的损失。第二次分解是由于聚合物分子的降解,PAP 和 PAPN 水凝胶的热分解温度明显高于 PA 水凝胶近 110 ℃。拉伸应力-应变测试评估了这些水凝胶的机械强度和稳定性。如图 4d 所示,与脆弱的 PA 水凝胶相比,PAP 和 PAPN 水凝胶表现出更好的机械性能。例如,PAPN 水凝胶的拉伸强度和伸长率分别约为 126 kPa 和 400%,而 PA 水凝胶的拉伸强度和伸长率分别约为 11 kPa 和 138%。这可能是由于引入苯环后链刚度和链间相互作用增强的缘故。
图4 水凝胶在人工唾液中的膨胀率
【PAPN水凝胶的抗菌性能和细胞相容性】
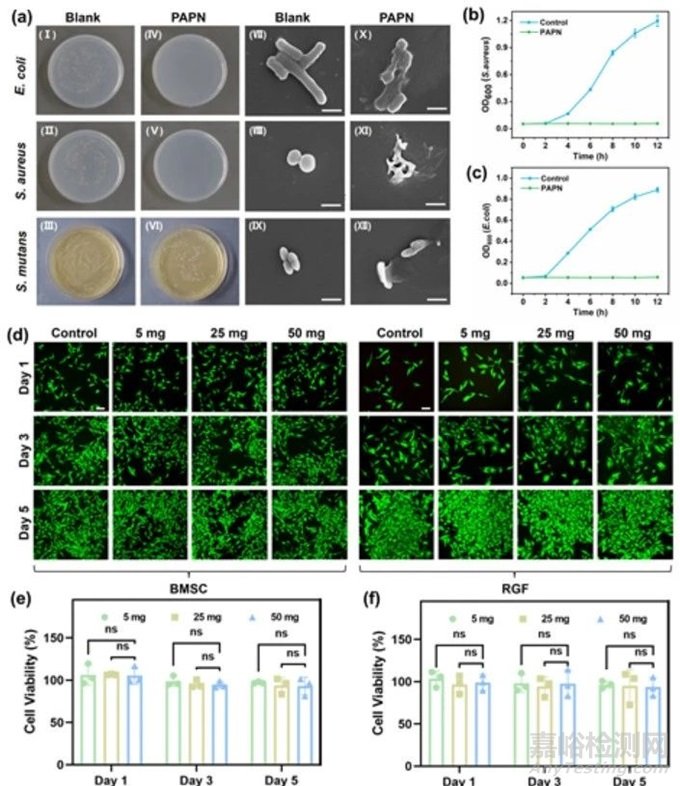
细菌感染对拔牙窝的伤口愈合有很大的威胁。为了探讨PAPN水凝胶的抗菌性能,本研究以革兰氏阳性金黄色葡萄球菌(S. aureus)、革兰氏阴性大肠杆菌(E. coli)和变异链球菌(S. mutans)为代表病原体进行了分析。与对照组相比,与水凝胶共培养后琼脂平板上的细菌数量急剧下降(图 5a Ⅰ-Ⅵ),抗菌效率均超过 90%(图 S10)。用扫描电镜观察金黄色葡萄球菌、大肠杆菌和变异杆菌经 PAPN 处理后的形态变化。对照组细菌形态正常,表面光滑,边缘清晰(图 5a Ⅶ-Ⅸ)。相比之下,用 PAPN 水凝胶处理后细菌的形态发生了变化,可以观察到细菌膜明显凹陷和破裂(图 5a Ⅹ-Ⅻ)。然后还测量了经 PAPN 处理的细菌悬浮液在 600 纳米波长处的吸光度,以进一步揭示 PAPN 水凝胶的抗菌能力(图 5b、c)。
图5 水凝胶的抗菌性能
【拔牙窝的伤口愈合】
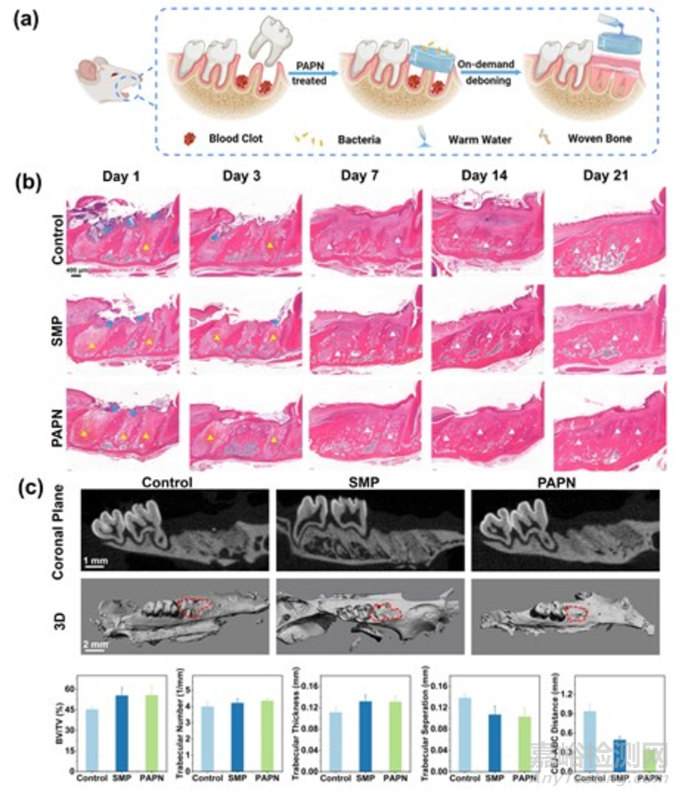
为了评估 PAPN 水凝胶对拔牙窝伤口愈合的治疗效果,本研究制作了大鼠上颌第一磨牙(M1)拔牙窝伤口模型。图 6a 显示了大鼠 M1 拔牙模型的构建过程。拔牙后,立即使用 PAPN 水凝胶处理拔牙伤口(PAPN 组)。处理后,可根据需要用温水简单地去除 PAPN。对照组则用棉花按压拔牙窝伤口,半小时后去除棉花(对照组)。此外,还选择了商用外科医用多肽(SMP)水凝胶作为阳性对照组。在固定时间(拔牙后 1、3、7、14 和 21 天)采集上颌骨,并对提取的伤口组织样本进行进一步处理和分析。首先,通过分析苏木精伊红(HE)染色的组织切片来评估拔牙窝的伤口愈合过程(图 6b)。可以观察到,拔牙后第一天,拔牙窝内充满血凝块,粘膜连续性中断。对照组的图像显示了典型的炎症,大量炎症细胞浸润牙龈区域,而血细胞则更多地分散在牙槽窝中。SMP 组和 PAPN 组的炎症浸润相对较少,而 PAPN 组的血凝块最多。血凝块中含有生长因子和细胞因子,可作为物理支架促进后续的血管生长和骨再生。在拔牙后的初期阶段,血凝块的部分或全部丢失是导致牙槽骨炎的主要原因。PAPN 组中血凝块的保护有利于拔牙窝的伤口重建。此外,拔牙后出血是不可避免的,因此要求伤口敷料具有良好的血液相容性。为了评估 PAPN 的血液相容性,本研究测试了凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)和纤维蛋白原(Fbg)。PAPN 水凝胶与空白无明显差异,表明 PAPN 对正常凝血过程影响不大。此外,PAPN 的溶血率远低于 ISO 标准(5%),表明没有发生溶血现象。
图6 大鼠上颌第一磨牙(M1)拔牙模型实验流程图
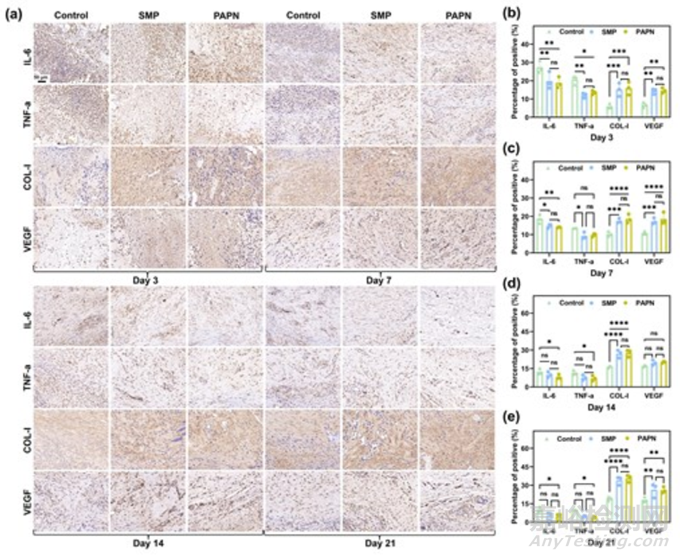
白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)是促炎细胞因子,通过调节免疫和炎症反应在伤口愈合过程中发挥重要作用。胶原蛋白Ⅰ(COL-Ⅰ)和血管内皮生长因子(VEGF)对伤口愈合过程有很大作用。COL-Ⅰ 以整合素信号依赖的方式介导几个关键步骤,如血小板聚集、炎症调节、血管生成、肉芽组织形成和再上皮化。血管内皮生长因子是评价伤口愈合的主要指标之一,它能促进早期血管生成,尤其是血管内皮细胞的迁移和增殖。因此,为了进一步评估 PAPN 水凝胶对拔牙伤口的治疗效果,本研究分析了伤口愈合过程中 IL-6、TNF-α、COL-Ⅰ 和血管内皮生长因子的表达情况。如图 7(a-e)所示,与对照组相比,PAPN 组 IL-6 和 TNF-α 的阳性染色强度明显降低,且 PAPN 组与 SMP 组之间无显著差异,表明炎症表达有所降低。此外,PAPN 组在愈合过程中还表现出高水平的 COL-Ⅰ 沉积和血管内皮生长因子。动物实验结果表明,PAPN 水凝胶具有缓解炎症、保护血凝块、促进胶原沉积、血管和骨再生的作用,因此可以加速拔牙伤口的愈合过程。
图7 第 3 天、第 7 天、第 14 天和第 21 天对 IL-6、TNF-α、COL-Ⅰ 和 VEGF 进行免疫组化染色
2. 总结与展望
总之,本研究成功地设计出了一种抗肿胀、抗菌水凝胶敷料,可快速封闭伤口,并具有可逆粘附性,可用于治疗拔牙窝。研究表明,PAPN 具有优异的机械性能(拉伸强度约为 126 kPa)和低肿胀性能(约为 80%),适合在复杂的口腔环境中应用。粘附性测试表明,PAPN 水凝胶在各种基底(玻璃、不锈钢、聚丙烯、二氧化硅、组织)上都表现出很强的粘附性。此外,PAPN 在温度控制下具有可逆的粘附性能,处理后可实现按需去除。本研究还验证了该敷料的抗菌性能,其对金黄色葡萄球菌、大肠杆菌和痢疾杆菌的抗菌效率均超过 90%。本研究还验证了敷料的抗菌性能,在体外对金黄色葡萄球菌、大肠杆菌和变异杆菌的抗菌率均超过 90%。在大鼠拔牙模型中,与传统的棉花加压治疗相比,这种敷料能更有效地缓解炎症、保护血凝块、促进胶原蛋白沉积、血管和骨再生。所有这些结果表明,PAPN 水凝胶敷料具有多种功能,可作为治疗拔牙窝伤口的一种新的替代疗法,在口腔伤口管理方面具有良好的应用前景。
文章来源:https://onlinelibrary.wiley.com/doi/10.1002/adhm.202400089