1、研究背景
与胃肠外途径相比,口服提供了一个安全、快速和简便的给药过程,并使患者更加舒适和依从。由于存在稳定性、剂量一致性和与赋形剂共同配制能力方面的优势,口服固体药物已成为主要制剂,始终占美国FDA批准新药的50%。然而,某些患者难以吞咽固体。50%以上儿童无法吞下标准尺寸的药丸或胶囊。吞咽障碍或吞咽困难的患者同样会与固体药物形式斗争。在成人中,吞咽困难的患病率可高达16%,超37%的人吞咽困难。这可能导致患者跳过或修改(如压碎)他们的药物,从而可导致药代动力学特征的改变和死亡。虽然液体制剂更容易摄入,但它们缺乏赋形剂定位治疗的能力,也不能起到控释装置的作用,这对口服生物药物提出了挑战。
2、研究成果
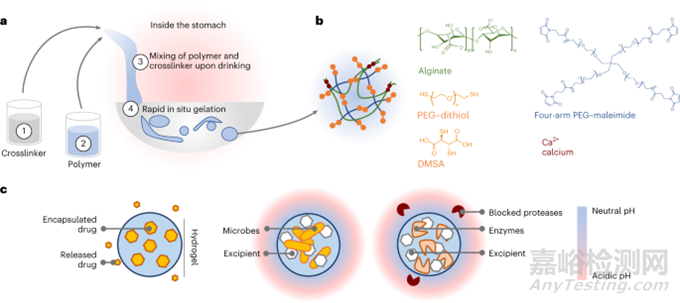
近日,美国麻省理工学院Giovanni Traverso团队报道了一种新策略,以实现可饮用的液体原位形成坚韧(LIFT)水凝胶的药物制剂,弥补了固体和液体剂型的优势。通过依次摄入钙和二硫醇交联剂的交联剂溶液,然后是藻酸盐和四臂聚(乙二醇)-马来酰亚胺的含药物聚合物溶液,LIFT水凝胶直接在胃中形成。研究表明,LIFT水凝胶在活大鼠和猪的胃中牢固地形成,具有机械韧性、生物相容性,24h后安全清除能力。LIFT水凝胶以可控的方式提供与未包封药物相当的总药物剂量,并保护包封的治疗酶和细菌免受胃酸介导的失活。总之,LIFT水凝胶可以扩大吞咽困难患者获得先进治疗的途径。
相关研究工作以“Drinkable in situ-forming tough hydrogels for gastrointestinal therapeutics”为题发表在国际顶级期刊《Nature Materials》上。
3、研究内容
1、LIFT水凝胶的设计与表征
由于停留时间相对较短(<30min)和胃液的复杂性,研究者开发了能够快速而有力地交联两个互穿聚合物网络的交联化学物质。最终确定方案:(1)摄入包含CaCl2和DMSA或PEG-二硫醇的交联剂溶液;(2)然后,摄入包含藻酸盐和四臂PEG-马来酰亚胺的聚合物溶液;(3)在胃中混合,聚合物溶液经历聚合物网络的交联和凝胶化;(4)形成LIFT水凝胶(图1a、b)。
图1. LIFT水凝胶概述
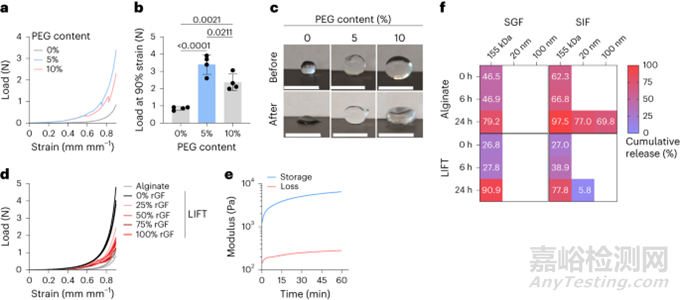
通过压缩测试对所得水凝胶进行了机械表征。与藻酸盐水凝胶相比,LIFT水凝胶承受的负载明显更大(图2a,b)。在90%应变后,LIFT水凝胶大部分保持球形,而藻酸盐水凝胶保持永久变形(图2c)。通过循环压缩测试对LIFT水凝胶进行了进一步的机械表征。LIFT水凝胶可以维持90%应变的至少五个循环,但藻酸盐水凝胶在一个循环后仍保持永久变形,无法维持随后的应变。为了测试LIFT水凝胶在体内形成的能力,在水中以各种稀释度在新鲜猪胃液中形成水凝胶。图2d显示,虽然胃液削弱了LIFT水凝胶的机械性能,但这些水凝胶比在理想条件下形成的藻酸盐水凝胶在机械上更坚韧。总之,这些数据表明,LIFT水凝胶即使在胃液中也能快速形成,所得水凝胶具有机械韧性,DMSA和PEG-二硫醇交联剂都能交联共价PEG网络,且水凝胶组分具有生物相容性。
图2. LIFT水凝胶的体外表征
2、LIFT水凝胶在大型动物中的表征
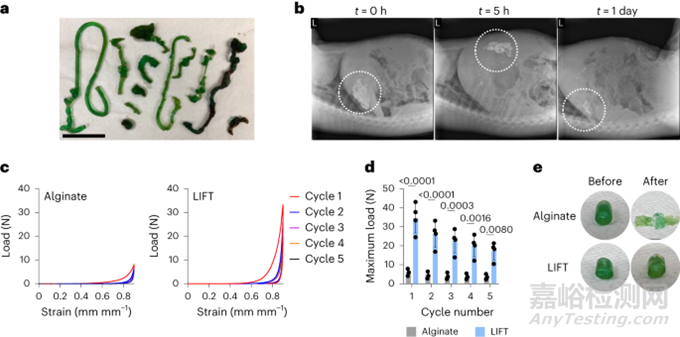
在体内测试LIFT水凝胶的形成、动力学和安全性。由于猪的胃肠道大小与人类相似,选择猪模型。通过内窥镜,将交联剂和聚合物溶液注入猪胃中,并观察到5-8h后水凝胶结构。无论给药顺序如何,水凝胶都会在胃里形成。先交联剂,后聚合物溶液,胃内可重复形成面条状水凝胶;顺序相反,则产生了更大但不太连续的块状水凝胶(图3a)。因此,选择先给药交联剂,再给药聚合物溶液,在体内形成LIFT水凝胶。然后通过X射线成像研究LIFT水凝胶的体内传输时间。一般来说,LIFT水凝胶给药后在胃内停留24h(图3b);相比之下,禁食和进食状态下0.4-1.4h从猪胃中排空液体。给药后48h,未观察到肝或肾功能变化。这些数据支持LIFT水凝胶及其成分被安全清除,不会造成阻塞,也不会造成毒性。在胃腔中形成后,通过循环压缩测试表征LIFT水凝胶的机械性能。图3c-e 显示,LIFT水凝胶更坚韧,能够维持至少五个90%的循环菌株,而藻酸盐水凝胶在一个循环后保持平坦。这些强调了LIFT水凝胶在人体胃肠道口服给药后在胃中牢固形成的能力。
图3. LIFT水凝胶的体内表征
3、LIFT水凝胶调节小分子释放
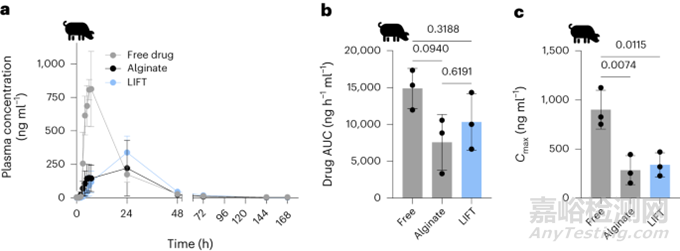
在确定LIFT水凝胶可以在体内形成后,又评估了它们封装和调节小分子释放的能力。选择流明三烯作为模型小分子药物,将形成药物悬浮液,后被封装在水凝胶内。游离流明三烯的血浆浓度峰值在给药后5-7h,水凝胶(藻酸盐和LIFT)制剂的血浆药物浓度峰值为~24h(图4a)。游离药物、藻酸盐和LIFT水凝胶的释放药物的曲线下面积(AUC)分别为14873.5±2719.2, 7568.4±3780.6和10337.5±3849.7ng▪h-1▪ml-1,并且没有统计学差异(图4b)。虽然药物AUCs没有差异,但最大药物浓度(Cmax)明显更高,游离药物(901.2±197.1ng▪h-1▪ml-1)、藻酸盐(283.8±147.3ng▪h-1▪ml-1)、LIFT水凝胶(338.7±122.6ng▪h-1▪ml-1)(图4c)。这些数据证明LIFT水凝胶在较低血浆浓度下提供与游离药物相当的总剂量药物的能力,可以降低药物毒性。
图4. 各种口服流明三烯制剂的药代动力学
4、LIFT水凝胶保护治疗酶活性
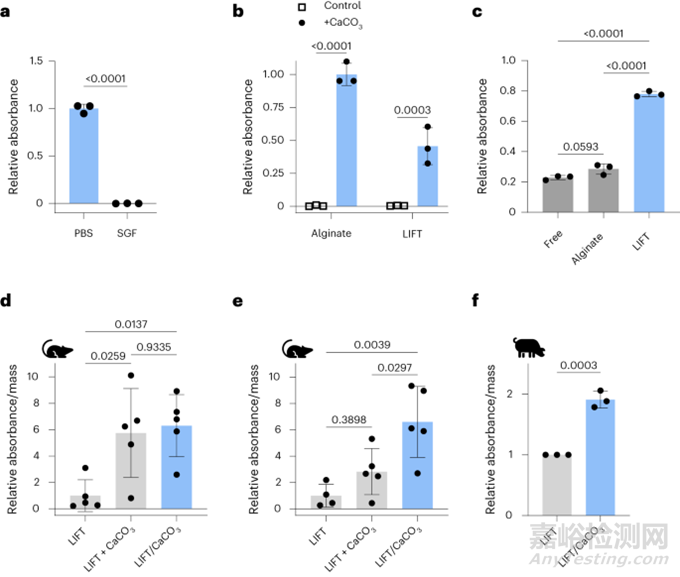
接下来,评估了LIFT水凝胶口服递送酶的能力,选择β-半乳糖苷酶(乳糖酶)。与磷酸盐缓冲盐水(PBS)相比,在SGF中孵育时乳糖酶活性显著降低(图5a);然后将乳糖酶与CaCO3一起包封在藻酸盐或LIFT水凝胶中作为赋形剂以中和酸性胃液。当用SGF攻击时,含有CaCO3的水凝胶保持了乳糖酶活性(图5b),强调了LIFT水凝胶与酶的兼容性。除了酸性胃液外,胃肠道中还富含可以降解酶的蛋白酶。与游离乳糖酶或藻酸盐水凝胶中包埋乳糖酶相比,LIFT水凝胶表现出最大的乳糖酶活性保护作用(图5c)。因此,除了共包封CaCO3外, LIFT水凝胶可能对蛋白酶表现出额外的屏障。
然后测试LIFT水凝胶在体内保护乳糖酶活性的能力。与在猪中进行的研究类似,首先给大鼠灌胃服用交联剂溶液,然后立即服用含有乳糖酶的聚合物溶液(含或不含CaCO3);值得注意的是,虽然1h后分离和共包封CaCO3都保护乳糖酶活性(图5d),2h后仅共包封CaCO3保护乳糖酶(图5e)。在体内6h孵育(图5f),猪模型中也观察到了共包封CaCO3的LIFT水凝胶的保护作用研究者在大鼠体内和体外进一步验证了LIFT与其他酶的更广泛兼容性。
图5. LIFT水凝胶共包封CaCO3保护口服后乳糖酶活性
5、LIFT水凝胶保护治疗细菌的生存能力
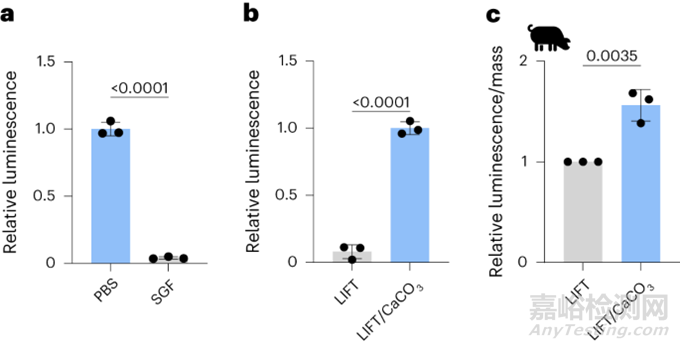
研究者使用发光ATP定量测定法以考察细菌(乳酸杆菌)的生存能力。乳酸杆菌在短时间暴露于SGF pH=1.77后表现出生存能力下降(图6a),当与CaCO3共封装在LIFT中时,这种情况得到了缓解(图6b)。在猪胃内给药6-7h后,与对照相比,在LIFT内与CaCO3共包封的乳酸杆菌表现出更大的活力(图6c)。用大肠杆菌Nissle 1917(EcN)进行了类似的实验,但没有表现出统计学意义。EcN和乳酸杆菌之间的差异可能是由于后者对与胃酸相关的pH范围更敏感。因此,当体内负载CaCO3时,LIFT水凝胶能够支持细菌活力并防止酸侵蚀。
图6. LIFT水凝胶共包封CaCO3保护细菌活性
4、结论与展望
吞咽障碍和吞咽困难是目前口服药物给药的主要障碍。这项研究开发了一种可饮用配方,称为LIFT水凝胶,能够在胃中混合后从液体转变为固体。LIFT水凝胶具有增强胃滞留、对胃肠道蛋白酶的保护、机械韧性、控制药物释放的能力,以及敏感疗法与赋形剂的共包封等优势。为了实现LIFT水凝胶,使用了FDA批准的或GRAS材料,采用藻酸盐和四臂PEG-马来酰亚胺作水凝胶网络,以及CaCl2和二甲基亚砜或PEG-二硫醇作交联剂。聚合物溶液保持为液体,直到与胃内的交联剂接触,触发从液体到坚韧水凝胶的转变。
研究者证明,在离体猪胃液以及猪和大鼠胃中,容易发生两种聚合物网络的交联,这强调了交联化学的稳健性。虽然马来酰亚胺硫醇反应很快,但藻酸盐的加入增强了LIFT水凝胶的机械性能。此外,它在钙中的直接交联起到了“支架”的作用,有助于较慢形成硫醚键的保持和交联。研究者表明,LIFT水凝胶通过延迟和降低最大药物血浆浓度来改变药代动力学,同时实现与游离药物相当的药物AUC。这一点很重要,因为高药物浓度会导致不良副作用并影响治疗耐受性,并且适用于疗效由AUC而非血液浓度决定的药物(如四环素类药物)。
通过克服"瓶中造船"问题,LIFT水凝胶可以扩大吞咽固体困难患者获得先进疗法的途径,并弥补固体和液体药物制剂的优势。研究者设想,LIFT水凝胶及其柔性化学物质可能是一种有用的策略,在胃药物调节和递送、减肥和胶囊生物制品的保护方面有着广泛的应用。
文献链接:https://www.nature.com/articles/s41563-024-01811-5