今日头条
诺宇创新核药获批前列腺癌临床。诺宇医药1类化药177Lu-NYM032注射液获国家药监局临床许可,拟开发用于治疗前列腺癌。177Lu-NY108是诺宇医药在研诊疗一体化核药NY108(NYM032)管线中、对前列腺特异性膜抗原(PSMA)具有高亲和力的一款治疗型核药,加载的诊断核素为68Ga,治疗核素为177Lu。在研究者发起的临床研究(IIT)中,该产品已显示出在肿瘤内滞留的时间更长和循环清除更快等治疗潜力。
国内药讯
1.K药联合用药中国获批治疗胆道癌。默沙东PD-1抑制剂帕博利珠单抗(可瑞达®)获国家药监局批准新适应症,联合吉西他滨和顺铂用于一线治疗局部晚期或转移性胆道癌(BTC)患者。在III期KEYNOTE-966研究中,Keytruda联合治疗较单独化疗显著改善患者总生存期(12.7vs10.9个月;P=0.0034)。这也是该新药在中国获批的第13个适应证。
2.GSK带状疱疹疫苗中国报新适应症。葛兰素史克重组带状疱疹疫苗Shingrix新适应症上市申请获CDE受理。Shingrix是一种非活重组亚单位佐剂疫苗,已于2019年5月获NMPA附条件批准上市,成为国内首个重组带状疱疹疫苗,用于50岁及以上成人带状疱疹的预防。在美国,FDA已于2021年7月批准该疫苗扩展适应范围,用于预防18岁及以上免疫缺陷或免疫抑制而患带状疱疹风险增加的人群。
3.康方PD-1单抗肺癌Ⅲ期临床见刊。康方生物PD-1抑制剂派安普利单抗在《柳叶刀· 呼吸医学》上发表联合化疗一线治疗晚期鳞状非小细胞肺癌(NSCLC)的Ⅲ期临床AK105-302研究成果。与单纯化疗相比,派安普利单抗联合化疗提高患者的无进展生存期(mPFS:7.6个月vs4.2个月;HR=0.40)和总缓解率(71%vs44%),30个月总生存期(OS)率为51.6%。此前,该产品上述适应症已获得CDE批准上市。
4.信达CLDN18.2靶向ADC上III期临床。信达生物靶向CLDN18.2(claudin18.2)的ADC药物IBI343在clinicaltrials.gov网站上注册一项III期G-HOPE-001研究,拟评估IBI343对比研究者选择方式用于Claudin 18.2阳性、HER2阴性胃或胃食管交界处腺癌患者的无进展生存期(PFS)和总生存期(OS)。IBI343可通过与表达CLDN18.2的肿瘤细胞结合后,发生CLDN18.2依赖性ADC内化,并释放毒素药物以杀死肿瘤细胞。IBI343也具有旁观者效应,也可通过质膜扩散并杀死相邻的肿瘤细胞。
5.强生眼科基因疗法拟纳入突破性疗法。强生AAV5-hRKp.RPGR眼内注射溶液(JNJ-5340,botaretigene sparoparvovec)获CDE拟纳入突破性疗法,用于治疗确诊为RPGR致病性变异相关X连锁型视网膜色素变性(RPGR-XLRP)的患者。JNJ-5340(bota-vec)是MeiraGTx公司开发的一款基因治疗药物,旨在通过AAV5载体递送RPGR基因的开放阅读框15(RPGR ORF15)功能基因,补充视网膜细胞中RPGR ORF15的表达量,恢复视网膜细胞功能。目前该新药正处于III期临床开发阶段。
6.AZ/第一三共HER2-ADC拟纳入优先审评。第一三共HER2靶向ADC注射用德曲妥珠单抗获CDE拟纳入优先审评,用于治疗存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除或转移性成人非小细胞肺(NSCLC)癌患者。在DESTINY-Lung02研究中,Enhertu达到58%的确认客观缓解率,中位缓解持续时间为8.7个月。2022年8月,该新药已获得FDA批准扩展适应症,成为治疗HER2突变NSCLC的首款药物。
国际药讯
1.再生元BCMA/CD3双抗在欧盟报产。再生元BCMA/CD3双抗linvoseltamab的上市申请(MAA)获欧洲药品管理局受理,用于治疗至少三种前期治疗后疾病进展的复发/难治性多发性骨髓瘤患者。在I/II期LINKER-MM1试验中,中位随访为11个月时,独立审查委员会评估的linvoseltamab(200mg)的客观缓解率为71%,完全缓解率为46%。去年12月,FDA已受理该新药递交的生物制品许可申请。
2.卫材超高剂量甲钴胺制剂日本报产。卫材宣布已向日本医药品和医疗器械管理局(PDMA)提交了超高剂量甲钴胺的新药申请(NDA),用于治疗肌萎缩性脊髓侧索硬化症(ALS)患者。ALS是一种难治性、进行性神经退行性疾病,由于运动神经元功能障碍而导致的肌肉严重萎缩和无力。卫材评估超高剂量甲钴胺用于治疗早期ALS患者的III期JETALS研究已公布于《JAMA Neurology》期刊上。
3.创新口服TTR稳定剂日本Ⅲ期临床积极。阿斯利康与BridgeBio Pharma在日本评估新型转甲状腺素蛋白(TTR)小分子稳定剂acoramidis治疗伴有心肌病的转甲状腺素蛋白介导的淀粉样变性(ATTR-CM)患者的Ⅲ期临床结果积极。30个月随访结果显示,acoramidis在患者生存、心脏相关住院、功能改善以及生活质量指标的改善,其疗效与全球性Ⅲ期临床ATTRibute-CM结果一致。详细结果将公布于医学会议上,并将递交给日本监管机构。
4.自闭症AAV基因疗法获批临床。Jaguar Gene Therapy公司基因疗法JAG201获FDA批准开展Ⅰ期临床,拟通过一次性单侧脑室注射给药,评估用于SHANK3突变或缺失的遗传性自闭症谱系障碍(ASD)或PMSPhelan-McDermid综合症(PMS)成人患者的安全性与初步疗效。JAG201旨在通过AAV9载体递送缩小版的功能性SHANK3基因,靶向中枢神经系统的神经细胞,以恢复SHANK3基因表达,从而有效改善神经发育以及维持认知、沟通、社交和运动等技能。
5.武田引进一款铁调素类似物。武田与Protagonist Therapeutics公司就后者临床后期铁调素(Hepcidin)类似物Rusfertide达成全球合作许可协议,联合开发和商业化Rusfertide,用于治疗真性红细胞增多症。根据协议,Protagonist将获得3亿美元预付款,开发和商业化里程碑后期付款以及产品美国外的销售分成;两家公司将在美国共同商业化Rusfertide,并50:50的利润分成;武田将获得Rusfertide在美国以外的全球权利。
6.Kyverna公司募资加速CD19 CAR-T开发。Kyverna公司宣布将通过IPO募集1.82亿美元的资金,以用于推进其靶向CD19的自体CAR-T疗法KYV-101的临床开发。KYV-101旨在深度诱导血液循环和组织实现B细胞完全耗竭,对B细胞驱动的自身免疫性疾病具有治疗潜力。目前,FDA已授予KYV-101快速通道资格,用于治疗难治性狼疮肾炎(LN)、重症肌无力(MG)和多发性硬化(MS)。
医药热点
1.我国最新癌症数据出炉。2月2日,国家癌症中心基于肿瘤登记及随访监测最新数据,在JNCC上发布2022年中国恶性肿瘤疾病负担情况,并形成《2022年中国癌症发病率和死亡率》报告。报告显示,在我国,肺癌仍是恶性肿瘤发病和死亡的首位原因。据估计,2022年中国约有482.47万新发癌症病例和257.42万新发癌症死亡病例。肺癌、结直肠癌、甲状腺癌、肝癌和胃癌是前五大癌症类型,占新发癌症病例的57.42%。肺癌、肝癌、胃癌、结肠直肠癌和食道癌是癌症死亡的五大原因,占癌症总死亡人数的67.50%。
2.北京拟加强布局细胞基因治疗。2月1日,北京市政府正式公布《2024年市政府工作报告重点任务清单》,明确将加强布局细胞基因治疗列为重点任务之一。通过加强细胞基因治疗领域的研发和应用,北京市有望在全球生物医药领域树立新的标杆,吸引更多国内外优秀人才和企业聚集,形成具有国际竞争力的生物医药产业集群。同时,这也将为北京市乃至全国的患者提供更多更好的治疗选择,助力健康中国建设。
3.广州又一医院项目封顶。2月2日,广州肾脏病医学中心项目迎来主体结构全面封顶,转入装饰装修和机电安装工程施工阶段,预计项目最快于今年底竣工投用。该项目是广东五大国际医学中心之一,致力打造国内最大、国际一流的肾脏病医学中心。该项目位于白云区,总规模6.5万平方米,其中地上共22层、建筑面积4.8万平方米,地下共4层、建筑面积1.69万平方米,建筑高度99.9米。
评审动态
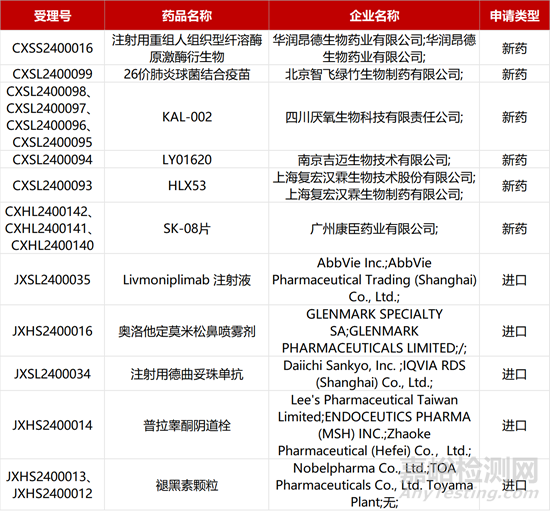
1. CDE新药受理情况(02月05日)
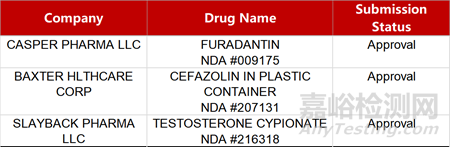
2. FDA新药获批情况(北美02月01日)