您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-09-13 15:13
摘 要
药品上市后变更管理作为药品监管体系的关键要素,其规则与实践伴随着医药产业的发展和监管目标的深化而不断演进。《药品上市后变更管理办法(试行)》由国家药监局于2021 年发布,首次在我国构建了药品上市后变更的规范化监管框架。其核心在于按风险等级分类管理,确保不同级别的变更在保障药品安全、有效和质量可控的前提下得到合理监管。对于符合相关技术指导原则要求的中等变更,可按规定进行备案管理。备案类变更作为药品上市后变更管理体系的重要组成部分,其制度设计充分体现了监管的科学性与灵活性。我国药品上市后备案类变更制度基于国内医药行业发展现状,融合国际成熟监管经验,在提升可操作性的同时,为后续优化预留了调整空间。本文分析我国药品上市后备案类变更制度发展历程、现状及面临的挑战,并提出相关思考和展望,以期为完善我国药品上市后备案类变更管理体系、提升管理效能提供参考,助力我国医药产业高质量发展。
关 键 词
药品上市后变更;备案类变更;监管体系;变更管理;备案管理
回顾我国药品上市后变更制度发展历程,1984 年颁布的《中华人民共和国药品管理法》( 以下简称《药品管理法》) 在此后一段时期难以适应新时代药品行业发展, 尤其在药品上市后监管等方面存在不足。从2015 年药品审评审批制度改革到2017 年原国家食品药品监督管理总局加入国际人用药品注册技术协调会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH),再到2019 年修订的《药品管理法》等法律法规的发布实施,我国药品上市后变更管理体系持续优化。经过不断的探索,2019 年修订的《药品管理法》确立了药品上市后变更分类管理制度,为之提供了法律保障[1]。2020 年《药品注册管理办法》的发布实施,以及2021 年《药品上市后变更管理办法(试行)》的出台,进一步完善了我国药品上市后变更管理的法律法规体系。目前,我国药品上市后变更管理体系已实现从“审批主导”向“基于风险管理”模式的转变,将变更事项分为审批类、备案类和报告类,显著优化了药品审评审批流程[2]。新法规明确规定,药品生产过程中的变更经充分研究、评估和必要验证确定为中等变更的,药品上市许可持有人(marketing authorization holder,MAH)可按备案类变更递交。该备案为告知性备案,MAH 对备案事项负主体责任,药品监管部门加强监管。这种模式转变给双方进行药品上市后变更管理均带来了新的挑战。本文梳理我国药品上市后备案类变更制度发展历程,分析监管现状并提出展望,以期促进构建更加科学、规范、高效的药品上市后备案类变更管理体系。
01我国药品上市后备案类变更制度
发展历程
1.1 早期阶段(2015 年以前)
早在2007 年以前,我国药品上市后监管制度处于逐步建立和完善的过程中,变更相关规定尚不成体系。针对已上市药品变更的管理缺乏统一的指导文件,部分药品质量标准中虽有对一些变更情况的简单要求,但整体缺乏系统性和明确的分类管理要求,由于变更因素的复杂性,难以全面评估药品上市后变更中存在的安全性和有效性风险。2007 年发布的《药品注册管理办法》将上市后变更分为3 大类:国家药品监管部门审批的补充申请事项、省级药品监管部门批准国家药品监管部门备案或国家药品监管部门直接备案的进口药品补充申请、省级药品监管部门备案的补充申请。上述分类使得我国药品上市后变更管理有了一定的规范框架,初步明确了申报路径。原国家食品药品监督管理局分别于2008年和2011 年出台《已上市化学药品变更研究的技术指导原则(一)》和《已上市中药变更研究技术指导原则(一)》,将药品上市后变更分为Ⅰ类(微小)、Ⅱ类(中度)和Ⅲ类(较大/ 重大)变更,为变更研究提供技术支撑[3]。
在这一阶段建立的分类管理体系为我国药品上市后变更制度的完善奠定了基础,促使相关企业建立变更评估的科学意识。当然,基于当时产业环境分类标准存在一定的局限性,同时,相应的变更管理基础较为薄弱,法律法规体系有待完善,药品上市后变更大多通过审批程序进行管理,一定程度上限制了变更的空间。
1.2 备案体系建立阶段(2015~2020 年)
2015 年,国务院印发《关于改革药品医疗器械审评审批制度的意见》,正式启动我国药品审评审批制度改革,引入MAH 制度试点、简化药品审批程序等创新机制,为完善药品监管法规体系奠定了基础。2017 年, 原国家食品药品监督管理总局正式成为ICH 成员,在促进我国药品监管体系与国际接轨方面取得重大突破,药品上市后变更管理等相关技术指导原则的制修订工作明显加快[4]。
2019 年修订的《药品管理法》新增了“药品上市后管理”章节,明确规定对药品上市后变更实行分类管理,依据对药品安全性、有效性和质量可控性的风险和产生影响的程度进行划分。其中,重大变更应当经国家药品监管部门批准,其他变更应当按照国家药品监管部门的规定备案或者报告。2020 年发布的《药品注册管理办法》深入贯彻落实“放管服”改革要求,创新药品监管理念,进一步细化药品上市后变更管理,根据变更风险等级划分为重大、中等和微小变更,分别按照审批、备案和报告途径申报。其中,境内生产药品中等变更在实施变更前应向省级药品监管部门备案,境外生产药品中等变更在实施变更前应向国家药品监督管理局(以下简称国家药监局)药品审评中心(以下简称药审中心)备案[5]。
此阶段是我国药品审评审批制度改革关键期,通过加入ICH、实施MAH 制度、优化药品审批流程等措施,药品上市后变更管理加速与国际接轨。特别是新修订《药品管理法》和《药品注册管理办法》及配套文件的实施,为药品上市后备案类变更制度提供了坚实的法律基础。
1.3 制度建设及持续落实阶段(2021 年至今)
2021 年,国家药监局出台《药品上市后变更管理办法(试行)》,这是首个专门针对药品上市后变更管理的系统性法规文件。该办法对药品上市后变更管理体系进行了系统性创新,主要体现为以下3 个方面:①将药品注册与监管融合,提出药品上市后变更包括注册管理事项变更和生产监管事项变更,以差异化监管提出不同变更要求。②明确备案为告知性备案,MAH 对备案事项负主体责任,并建立药品全流程监管机制,对于符合备案要求的向药品监管部门递交。③药品监管部门在备案完成之日起5 日内公示相关信息,并结合备案变更事项的风险特点和企业安全信用情况,在备案完成之日起30 日内完成备案资料审查。必要时可启动现场检查或检验,强化事中事后监管[6]。
近年来, 国家药监局围绕《药品上市后变更管理办法(试行)》相继发布多项配套文件,细化了技术标准和操作规范,提升了制度的可执行性,有效解决了早期监管缺乏系统性、规范性的问题,通过明确的变更路径、分类管理、备案审查等机制保障公众用药安全,推动药品质量升级。未来,随着医药科技的进步和监管经验的积累,相关制度将持续优化和完善。
02我国药品上市后备案类变更管理成效
2.1 完善药品上市后备案类变更制度
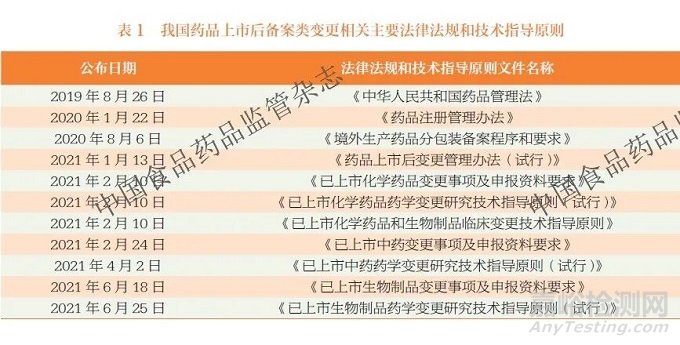
为有效落实《药品管理法》《药品注册管理办法》《药品上市后变更管理办法(试行)》等法律法规要求,规范药品上市后备案类变更技术要求,2021 年国家药监局及药审中心陆续制定发布了化学药品、中药及生物制品上市后变更事项及申报资料要求,并配套发布相关技术指导原则,见表1。上述文件针对不同类型药品的变更,从具体分类、研究验证标准、备案资料等方面作出详细规定,显著提升了药品上市后备案类变更的可操作性。后续,药审中心结合工作实际,逐步制定并优化药品上市后变更相关技术指导原则,细化不同药品上市后变更的技术标准,以更好地指导申请人开展药品上市后研究工作。同时,省级药品监管部门积极落实上述文件要求,结合各地实际情况,陆续出台了药品上市后备案类变更管理的相关工作程序和要求,细化了药品上市后备案类变更管理在各地的实操要求,从省级药品监管角度完善了药品上市后备案类变更管理体系,既确保了国家政策在地方的贯彻实施,又提升了药品上市后备案类变更的效率及质量[7]。
2.2 明确药品上市后备案类变更的范围
根据上述法律法规和技术指导原则,我国药品上市后备案类变更主要包括以下情形:①药品生产过程中涉及生产工艺、辅料、质量标准等的中等变更。②药品包装标签内容的变更。③境外生产药品分包装。④改变不涉及技术审评的药品制剂或原料药注册证书中载明事项,包括但不限于MAH 及生产企业名称和(或)地址描述性变更、注册代理机构变更等。⑤国家药品监管部门规定的其他备案类变更[8]。其中,化学药品、中药和生物制品上市后备案类变更细化事项见表2。

2.3 规范药品上市后备案类变更管理类别确认流程
首先,国家药监局已发布法规文件中明确变更管理类别的,MAH 应严格按照规定确定变更管理类别。其次,现有规定未明确变更管理类别的,MAH 可参考相关技术指导原则,结合药品特点并根据其变更分类的原则、工作程序和风险管理标准,开展充分的研究、评估和必要的验证后,科学确定变更管理类别。最后,MAH 拟将技术指导原则中规定的审批类变更降低为备案类变更的,应开展充分的研究、评估和必要的验证,按照药审中心和省级药品监管部门现有的沟通交流程序,与相关部门进行沟通,如达成一致意见,可按规定执行[9]。
2.4 统一药品上市后备案类变更的提交与审查流程
国家药监局建立了统一的药品上市后变更申报系统,对备案类变更实行全程网上办理。MAH通过国家药监局网上办事大厅提交备案类变更申请,并按照化学药品、中药或生物制品上市后相关变更事项及申报资料要求等,提交备案资料。境内生产药品的备案类变更由省级药品监管部门负责,境外生产药品的备案类变更由药审中心负责。备案部门在备案完成之日起5 日内通过国家药监局官方网站公示备案信息供公众查询。省级药品监管部门应当加强备案后监管,综合考虑变更事项的风险特点和企业安全信用状况,在备案完成之日起30日内完成备案资料的审查。必要时应当开展现场检查或抽样检验,确保变更实施符合要求[10]。
2.5 药品上市后备案类变更趋势
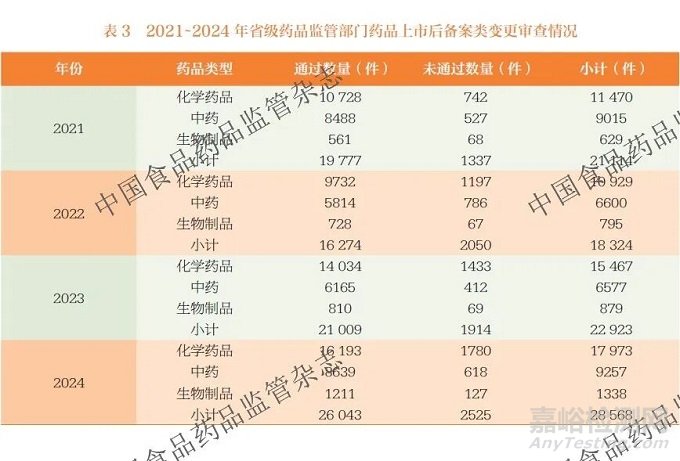
2021~2024 年国家药监局发布的《药品监督管理统计年度数据》[11-14] 显示,境内生产药品备案类变更的数量规模与审查通过率呈现持续增长态势,见表3。按药品上市后变更备案总量看,2021 年备案总量为21 114 件,备案通过率为93.7%。2022 年备案总量为18 324 件,同比下降13.2%,备案通过率为88.8%。2023 年备案总量回升至22 923件,同比增长25.1%,备案通过率为91.7%。2024 年备案总量为28 568 件,同比增长24.6%,备案通过率为91.2%。按药品类型看, 中药备案量2024 年较2023 年增长40.7%, 通过率稳定在93% 以上。化学药品备案量占比最高,近两年备案量占备案总量的比例均高于60%。2024 年化学药品备案量同比增长16.2%,通过率稳定在90% 以上。生物制品备案量占比最少但增速明显,2024 年备案量较2023年增长52.2%, 通过率稳定在90% 以上。可以看出,随着国家药监局发布的药品上市后变更管理政策的落地实施,以及省级药品监管部门备案类变更流程的持续优化,通过监管与产业的良性互动,我国药品上市后备案类变更管理工作取得显著成效。
03我国药品上市后备案类变更管理面临的挑战及展望
3.1 面临的挑战
药品上市后变更管理是药品全生命周期监管的关键环节,备案管理也是落实全生命周期监管的重要体现。近年来,我国已逐步建立较为完善的药品上市后备案类变更法律法规体系和管理机制,但在监管实践中仍面临若干挑战和优化空间。
(1)药品监管部门鼓励MAH采用新方法、新技术等对药品上市后变更主动开展研究,不断在变更中提升药品质量。部分MAH缺乏对变更风险等级的判断能力等,可能影响其对药品上市后变更管理的规范性和有效性。同时,部分MAH 在变更研究、评估和验证方面存在不规范操作,如未参照相关技术指导原则对药品安全性、有效性和质量可控性的影响开展充分研究、评估和必要的验证等[15],备案研究资料不足以支持备案类变更。
(2)虽然国家药监局已建立统一的药品上市后变更申报系统,但各地药品监管部门的备案细则和审查标准存在差异,对于需要药品监管部门研判的变更,相关企业在跨省备案时可能面临不同的要求。对于境外生产药品的变更,我国在备案类变更管理方面与国际监管机构有所不同,可能会导致药品上市后变更难以与全球同步。
(3)近年来备案数量的增加,可能加大药品监管部门的事后监管负担。例如,为提升监管效率,其对各药品监管部门和机构之间信息共享提出了更高要求。同时,备案类变更与审批类、报告类变更的衔接机制仍有待完善,需对监管资源进行合理分配,减少资源浪费。
(4)我国在药品上市后变更管理中引入了基于风险的分级管理理念,同时正在研究国际通行的变更管理工具和方法,如根据ICH《Q12 :药品生命周期管理的技术和监管考虑》,引入批准后变更管理方案(post-approval change management protocol,PACMP)等。新管理工具和方法的应用,在加强变更管理的灵活性和科学性的同时,其理念和实操的转变也为药品监管部门和MAH双方带来了新的挑战[16]。
3.2 思考与展望
总体来看,我国药品上市后备案类变更管理已呈现出政策逐步完善、流程日益规范、监管不断加强以及执行要求日趋严格等特点。面对挑战,可以考虑通过以下几个方面进行改进,如MAH应增强主体责任意识,加强对政策法规文件的学习,健全内部变更管理制度,提升团队专业能力和自主研究验证能力,实现药品全生命周期管理。药品监管部门可强化法律法规文件解读与指导,进一步完善变更管理标准,消除实际操作中的争议和模糊地带,实现监管尺度的统一。同时,进一步加强信息共享与监管联动,完善备案类变更与审批类、报告类变更的衔接机制,提高监管资源的利用效率。此外,积极引入国际先进的监管工具和方法,采用国际通行的变更管理标准,提升变更管理的科学性和灵活性。通过多方协同,联合发力,促进药品上市后备案类变更管理朝着更加科学、规范和高效的方向发展。展望未来,随着相关政策的进一步细化和监管的持续强化,我国药品上市后备案类变更管理将不断优化,更好地与国际监管体系接轨,从而促进相关企业从“被动合规”向“主动优化”转变,减少“备案依赖症”,为守护公众用药安全、助力医药产业高质量发展提供坚实可靠的保障与强劲支撑。

来源:中国食品药品监管杂志


