摘 要 / Abstract
目的:评价国内不同使用环节的人乳头瘤病毒核酸检测试剂盒(PCR-荧光探针法)的质量现状。方法:依据企业产品技术要求,对准确性、特异性、检测限、精密度4个项目进行检验。同时,以国家参考品和细胞质控品为样品,进行探索性研究。结果:本次国家监督抽检共抽检15批次产品,其中13批次的准确性、特异性、检测限和精密度检测结果均符合要求,2批次结果因质量控制不符合要求判定为不合格,抽检合格率为87%。探索性研究结果显示,以国家参考品为样品进行评价,6批次试剂盒未能满足检测限要求;以9种不同型别的高、低浓度细胞质控品为样品进行评价,各试剂检测高浓度样品符合率较高,检测低浓度样品符合率较低。结论:企业需进一步规范和完善产品技术要求,改进和完善企业参考品和产品的设计,建议采用国家参考品优化检测限标准。
Objective: To evaluate the quality of human papilloma virus nucleic acid detection kits(PCR fluorescence probe method) used in different application stages in China. Methods: According to enterprises' product technical requirements,we conduct tests on accuracy, specificity, limit of detection, and precision. In addition, an exploratory study is performed by evaluating the national reference standards and cell quality control products. Results: A total of 15 batches of kits are examined in the national supervision and sampling inspection. Among them, 13 batches meet the requirements for accuracy,specificity, limit of detection, and precision. The results of 2 batches are deemed unqualified due to non-compliance with quality control standards, resulting in an 87% pass rate. The results of the exploratory study show that 6 batches of kits fail to meet the detection limit requirements when evaluated against national reference standards. When assessing with 9 different types of high and low concentration cell line quality control samples, the coincidence rate of each reagent for detecting high concentration samples is higher, while the coincidence rate for detecting low concentration samples is lower. Conclusion:Enterprises should standardize and improve the technical requirements of products, improve the design of enterprise reference materials and products, and adopts the standards of national reference materials to optimize limit of detection performance.
关 键 词 / Key words
人乳头瘤病毒;核酸检测试剂盒;国家监督抽检;质量分析
human papilloma virus; nucleic acid detection kit; national supervision and sampling inspection; quality analysis
宫颈癌是全球女性第四大常见癌症。根据世界卫生组织(World Health Organization,WHO)数据统计,2020年全球约有60.4万例宫颈癌新发病例和34.2万例死亡病例,其中约90%的新发病例和死亡病例发生在低、中等收入国家[1]。高危型人乳头瘤病毒(human papilloma virus,HPV)的持续感染是引发宫颈癌的主要原因。由于HPV核酸检测试剂盒具有较高的灵敏度,逐渐替代细胞学或与细胞学联合检测用于宫颈癌的筛查[2]。2021年,WHO更新了《宫颈癌癌前病变筛查和治疗指南》,推荐HPV核酸检测作为宫颈癌初筛的首选方法[3]。目前,HPV核酸(分型)检测试剂盒众多,涉及的方法学较多,包括常见的PCR荧光法和PCR反向杂交法,以及其他方法,如基因芯片法、酶切信号放大法、杂交捕获法、测序法、飞行时间质谱法等[4-5]。PCR荧光法是检测HPV核酸应用最广的一种方法,通过设计针对扩增靶区的引物和标记不同荧光信号的特异性探针,对PCR产物进行检测。由于PCR荧光法不需要特殊的仪器设备,操作简单,医院及科研机构等单位广泛使用该类试剂盒。截至2023年8月,在国家药品监督管理局官网(https://www.nmpa.gov.cn/)上输入“人乳头瘤病毒,PCR荧光法”进行检索,统计检出13种高危型HPV核酸检测试剂盒,现有国产及进口注册证共46个,涉及生产企业34家,分别来自北京、上海、广州、杭州、厦门等多个城市。HPV核酸检测试剂盒为第三类医疗器械产品,其审评审批、生产监管及市场监管均按照我国第三类医疗器械产品的相关规定进行管理。目前,上市产品参照YY/T 1226—2022《人乳头瘤病毒核酸(分型)检测试剂盒》行业标准制定各自的产品技术要求[6]。由于产品检测范围不同,各企业的产品标准亦不相同。为加强HPV核酸检测试剂盒的监管,评价该类产品的质量现状,确保产品在临床使用中安全有效和质量可控,2022年2月,国家药品监督管理局组织开展了HPV核酸检测试剂盒抽检工作[7]。本文将对2022年度HPV核酸检测试剂盒抽检情况汇总如下。
1、材料与仪器
1.1 样品
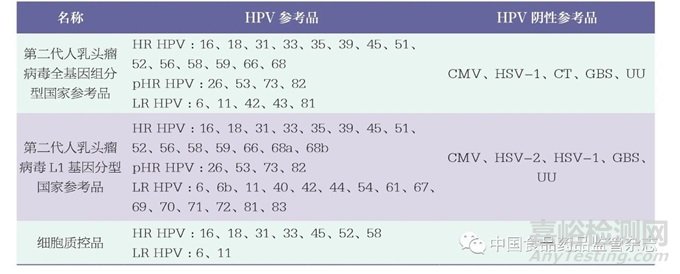
抽检相关产品的企业参考品和相关信息,由各生产企业提供。探索性研究评价用的国家参考品为第二代人乳头瘤病毒全基因组分型国家参考品(370060-201901)和第二代人乳头瘤病毒L1基因分型国家参考品(370110-202201),由中国食品药品检定研究院提供;细胞质控品为冻干样品,由广东凯普生物科技有限公司提供。国家参考品和细胞质控品的具体组成详见表1。其中,国家参考品覆盖试剂盒检测范围内的所有型别,细胞质控品覆盖试剂盒检测范围内的部分型别。
表1 国家参考品和细胞质控品的组成
注:HR HPV :高危型HPV ;pHR HPV :潜在高危型HPV ;LR HPV :低危型HPV ;CMV :巨细胞病毒;HSV :单纯疱疹病毒;CT :沙眼衣原体;GBS :B 族链球菌;UU :解脲支原体。
1.2 试剂
人乳头瘤病毒核酸检测试剂盒(PCR-荧光探针法)来自北京、上海、浙江、河南、江苏、广东、福建的不同企业及医疗机构,共15批次产品。其中,国产13批次、进口2批次。部分试剂盒为HPV16和HPV18分型,部分试剂盒为全分型,可分2~24种型别。其中,核酸提取或纯化试剂以及其他配套试剂均由企业及医疗机构自行提供。
1.3 仪器
ABI7500荧光定量PCR仪(美国赛默飞世尔科技公司);SLAN-96S全自动荧光定量PCR仪(上海宏石医疗科技有限公司);Gene Light 9820全自动医用PCR分析系统(厦门安普利生物工程有限公司);cobas x480全自动核酸分离纯化仪(瑞士罗氏诊断公司)。
2、方法与结果
2.1 有效样本分布统计
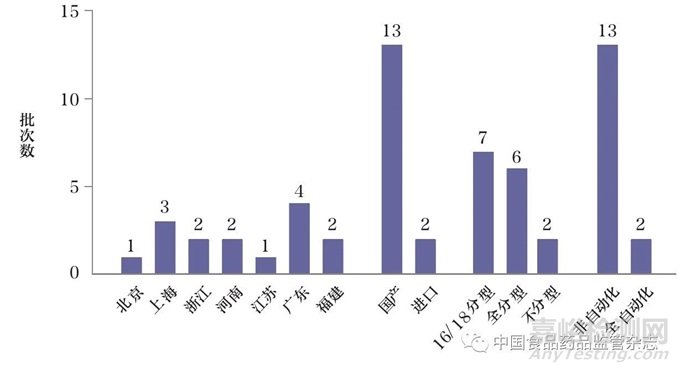
本次抽检的15批次HPV核酸检测试剂盒(PCR-荧光探针法)来自北京、上海、浙江、河南、江苏、广东和福建(图1)。涉及注册证共13张,占HPV核酸检测试剂盒注册证总数的28%。其中,国产注册证12张,进口注册证1张。涉及生产企业共12家,占HPV核酸检测试剂盒生产企业总数的35%。其中,国内生产企业11家(产品13批次),国外生产企业1家(产品2批次)。15批次试剂中8批次来自使用环节,7批次来自生产环节。上述结果显示,抽检覆盖率较低。抽检的试剂盒大多数可分型,为HPV16/HPV18分型和全分型。检测操作的自动化程度上,大多数试剂盒自动化程度较低。
图1 15批次HPV核酸检测试剂盒基本信息
2.2 性能检验
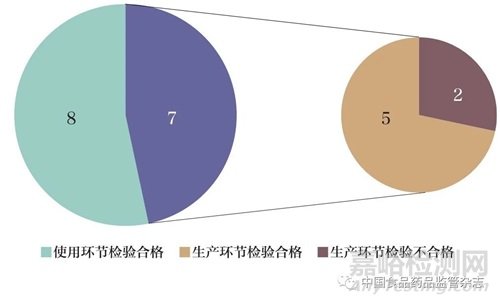
本次检验项目选择准确性、特异性、检测限和精密度4个关键性能指标评价,具体内容见表2。按照各生产企业的产品技术要求进行检测,其中12批次使用企业参考品检测,3批次使用国家参考品检测。结果合格产品数量为13批次,占比为87%;不合格产品数量为2批次,占比为13%,均来自生产环节(图2)。13批次试剂盒检测上述性能指标均符合相应标准,不同型别之间无交叉反应。2批次试剂盒检测结果不合格,其中1批次试剂盒的阴性对照不成立,检测内标通道无循环数阈值(cycle threshold,Ct值)或Ct值大于32,不符合试剂盒声称的质量控制要求;另1批次试剂盒的阳性对照不成立,PCR反应液E孔检测HPV39、HPV45和HPV68通道无Ct值或Ct值大于26,不符合试剂盒声称的质量控制要求。由于质控体系不符合要求,造成实验无效,从而无法判定参考品的检测结果。推测可能的原因为生产环节中阴性、阳性对照的配制或者出厂检验结果判定存在问题。
表2 检验项目及性能要求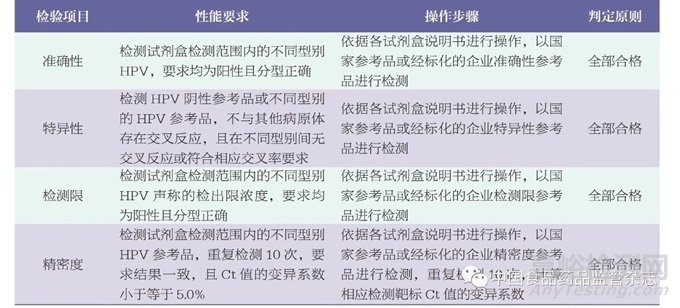
注:检测结果首先应满足试剂盒说明书中的质量控制要求,再进行结果判定;表中任意项判定不合格,本次抽检综合结论为不合格。
图2 15批次HPV核酸检测试剂盒检测结果
2.3 探索性研究
2.3.1 检测限评价
为了有效评估不同试剂盒检测新一代国家参考品的检出能力,使用11批次试剂盒检测稀释至最低检测限的国家参考品。结果显示,2批次试剂盒无法检出HPV68a或HPV68b(表3),提示企业需要补充完善企业参考品,并进一步评估其准确性性能。4批次试剂盒不符合产品技术要求声称的检测限,其余试剂盒符合相应要求。通过比较企业参考品和国家参考品的检测结果(Ct值)发现,企业参考品的定量偏差较大,提示企业需要进一步对最低检测限作详细评估。
表3 HPV核酸检测试剂盒检测结果统计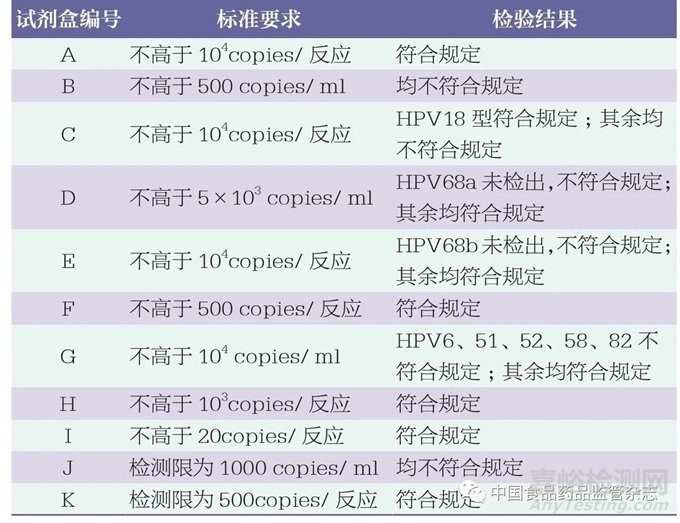
2.3.2 细胞质控品评价
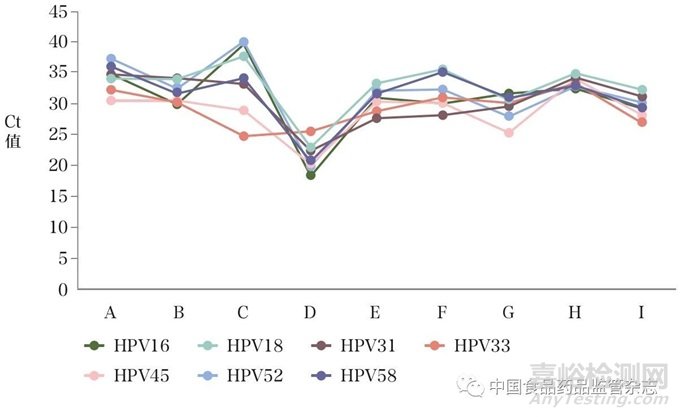
为了有效评估细胞质控品的准确性和有效性,使用11批次试剂盒检测高浓度(106copies/ml)和低浓度(104copies/ml)的细胞质控品。结果显示,9批次试剂盒均可以检出不同型别的高浓度细胞质控品(符合率为11/11),1批次试剂盒无法检出HPV16、HPV18和HPV52型质控品,另外1批次试剂盒无法检出HPV6型(表4)。分析检测不同型别符合率为11/11的9批次试剂盒的Ct值结果,发现同一型别HPV细胞质控品的Ct值差异较大,提示检测结果的强弱不同(图3),这可能与各试剂盒配套的核酸纯化试剂的提取效率不同有关。对于低浓度细胞质控品,11批次试剂盒的检出能力差异较大,且检测不同型别的符合率较低,造成这种差异的原因可能与不同检测试剂盒的分析灵敏度有关。
表4 不同型别细胞质控品检测结果符合率汇总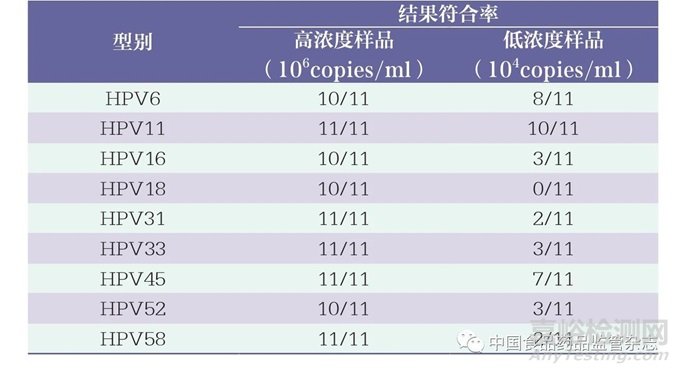
图3 9批次试剂盒检测不同型别HPV细胞质控品的Ct值汇总
3、讨 论
HPV核酸检测试剂盒因其具有较高的灵敏度和阴性预测值,在临床上应用较广。其检测结果的准确性对于宫颈病变及宫颈癌的筛查具有重要临床意义[8]。由于该类试剂盒种类较多,涉及多种方法学,试剂盒的质量参差不齐。行业标准(YY/T 1226—2014)自2015年7月1日实施以来,提升了该类试剂盒的质量,但依然存在一些问题。2013年和2015年国家药品监管部门开展了HPV检测试剂盒抽检工作,发现存在HPV型别交叉反应现象及部分试剂盒缺少内控的现象[9-11]。2022年,国家药品监督管理局再次开展该类试剂盒的抽检工作,评价其质量现状[7]。然而,本次抽检工作可能受疫情影响,整体覆盖率不高。共抽检15批次产品,2批次产品不合格,不合格检出率为13%,抽检产品的总体质量一般。
本次抽检的检验依据为企业各自的产品技术要求,考察项目为准确性、特异性、检测限和精密度4个项目。通过资料审核、检验检测和探索性研究,发现了以下问题及可能存在的风险点:①试剂盒的质量控制不符合要求,包括阴阳性对照不成立、未设置内对照或阴性对照未参与样品处理和检测全过程。由于实验操作中质量控制对监测整个检测体系至关重要,质控体系的无效直接影响临床检验中检测结果的准确性和可靠性[12]。②试剂盒未能检出检测范围内的亚型型别,如HPV68a或HPV68b型。这可能与企业参考品的设置不够完善有关。分析各企业的产品技术要求,发现用于出厂或型式检验的企业参考盘中准确性参考品和最低检测限参考品未覆盖检测范围内的所有型别,无法全面评估试剂盒的检测准确性和灵敏度。性能评估的局限会影响该类试剂盒的质量,在临床应用中可能会造成漏检。③用于评估试剂盒灵敏度的检测限参考品量值准确性差异较大。由于各企业参考品的定量标准不一,且上一代国家参考品量值的局限性,造成不同企业最低检测限的可比性较差。在临床应用时,造成不同医疗机构使用不同试剂盒或在同一机构使用不同试剂盒,检测结果的一致性较差[13]。④参考品亟需更新换代。现有国家参考品均为质粒样品,无法评估核酸提取环节。在本次抽检中,使用细胞质控品进行评估。结果发现,细胞质控品可以有效评估试剂盒的检测能力,可作为下一代HPV国家参考品的候选样品。然而,对于如何有效评估试剂盒核酸提取效率对试剂盒性能的影响及细胞质控品的定量准确性,需要进一步研究。
为了提升HPV核酸检测试剂盒的质量,确保临床检测结果的准确可靠,针对本次抽检作出以下建议:①加大抽检力度,完善和优化抽样模式,保证抽检的覆盖面广,更加合理评估试剂盒的现状。②督促各企业针对存在的问题进行深入分析,促使企业进行改进或者变更,以达到提高产品质量这一目的。③建议标准管理部门加强行业标准宣贯,企业及时关注行业标准更新动态,并根据行业标准及时完善产品技术要求。④不断优化更新国家参考品,更加科学合理地评价各试剂盒的检测性能。总之,本次抽检工作为HPV核酸检测试剂盒的科学监管提供数据支撑。积极解决抽检工作中的问题,在一定程度上有助于提高HPV核酸检测试剂盒的质量,使其更好地服务于临床应用。
引用本文
田亚宾,沈舒,刘东来,赵兰青,石大伟,许四宏*.人乳头瘤病毒核酸检测试剂盒国家监督抽检质量分析[J].中国食品药品监管,2023(8):58-63.