实际工作中,经常会遇到对含量(或效价)限度的判断,处理不好,会影响制定质量标准的质量。下面将从药品中有效成分含量测定的意义、含量测定的原理和水分(干燥失重)对含量(或效价)限度的影响等方面谈几点体会。
一、药物(药品)中有效成分含量测定的意义
测定药物(药品)中有效成分的含量是保证药品疗效的重要手段。一般可根据其有效成分的理化特征测定其含量。含量测定必须在鉴别无误,杂质和水分(干燥失重)检查合格等的基础上进行方有意义。
药物并不要求是百分之百的纯品,因此规定有一定的含量限度。含量限度的制定,要根据药品的性质、生产实际以及测定方法的准确度结合起来进行综合考虑。仅从测定方法上考虑,若选用准确度较高的重量法或容量法,通常测定误差为0.3%-0.5%,含量限度可定为99.0-100%;如选用非水滴定、比色、分光光度等方法,由于方法的测定误差较大,通常测定误差为1%-2%,且影响因素较多,含量限度就不应订得太高。否则,就不合理。非水滴定的药品一般只订在98.0%或98.5%以上,许多激素类药品本身较难纯化,测定方法又采用分光光度,故含量限度订为97.0%-103.0%甚至96.0%-104.0%。
再就是根据药品的给药途径的不同制定,如维生素C,口服用的含量限度为不得少于99.0%,注射用的不得少于99.5%。
而药物制剂由于生产中准确控制含量较难,且临床使用时的剂量也有一定的幅度,并考虑到样品检验的称量误差、测定方法和测定误差,故含量限度允许有较宽的范围,通常标示量为0.1g以上,含量限度为95.0%-105.0%;标示量为0.1g以下含量限度为90.0%-110.0%。
二、水分(干燥失重)对含量(或效价)限度的影响
药品中含有药品中含有较大量的水分时,不仅使药品含量降低,影响使用剂量的准确性,还会引起水解或发生霉败变质,而使药物失效。因此需进行水分(干燥失重)测定。
药品中的水分,可分为必要的水分(如结晶水或组成水),不必要的水分(即吸附水)。
1、干燥失重与水分测定的意义
干燥失重系指药品在规定的条件下,测定药品中所含能被驱去的挥发性物质,既包括水,如吸附水,也包括其他挥发性物质,如残留有机溶剂等。方法为照药品项下规定的条件干燥至恒重,从减失的重量和取样量计算供试品的干燥失重。
测定水分系指用药典附录方法(主要是第一法)测得药品中的残留水和结晶水的总和,不包括其他挥发性物质。
由于测定含量时通常以称取未经干燥的供试品来进行,而在含量限度中,为了能真实反映质量,规定按干燥品或无水物计算。该项目在药品标准中一般均应加以规定,尤其是对具有吸湿性或含有结晶水,以及因含水过高将影响其稳定性、理化性状及生理作用的药品。因此,对药品中的水分进行检查并控制其限度非常重要。
2、干燥失重方法的选择条件
干燥失重方法有以下三种:
1)加热干燥法 本法适用干受热较稳定的药物。此法采用较多,一般是在105℃干燥至恒重。干燥温度一般为105℃,干燥时间除另有规定外,根据含水分量的多少,一般先在达到指定温度后干燥2~4小时,再称至恒重为止。结晶水较难失去的供试品,需采用更高的温度加热干燥。有的药物在105℃水分不易除去,可提高干燥温度,如氯化钠在130℃供至恒重,枸橼酸钠在180℃烘至恒重。某些药物中含有较大量的水分,熔点又较低,如直接按规定在105℃干燥,供试品即融化,表面结成一层薄膜,使水分不易继续挥发,难以恒重,影响干燥效果。必须将供试品先在较低温度干燥l~2h,使大部分水分除去后,再按规定温度干燥。如碳酸钠、硫代硫酸钠先在40~50℃干燥,葡萄糖先在80℃干燥,然后渐次升高温度至105℃干燥至恒重。熔点低的供试品,采用较低的温度干燥。具体温度、时间、根据药品性质而定。
2)干燥剂干燥法 本法适用于熔点较低,加热易分解或易升华的供试品。供试品置干燥器内,利用器内贮放的干燥剂,吸收供试品中的水分,干燥至恒重。如苯佐卡因、亚硝酸钠、硝酸异山梨醇、马来酸麦角新碱等。干燥剂通常为无水氯化钙、硅胶、五氧化二磷或硫酸。
3)减压干燥法 指在一定温度下减压干燥的方法。在减压条件下,可降低干燥温度及缩短干燥时间,故本法适于受热不稳定及较难去除水分的药物,如没食子酸锑钠、硫酸长春碱、肾上腺素等。减压干燥法又分为恒温减压干燥法和减压加热干燥法。恒温减压干燥法通常采用干燥剂脱水,如布洛芬熔点74.5~77.5℃,在五氧化二磷的真空干燥器中干燥。易分解的供试品,但仍能耐受一定温度时,采用减压加热干燥法。不能耐受长时间加热的供试品,采用定时干燥,如地高辛,规定在105℃,减压干燥lh。
3、水分测定条件的选择
费休氏水分测定法于 1935年由 Karl Fische提出。1939年 Smith作了进一步研究与完善,目前已成为国际上通用的水分测定法之一,具有操作简便。专属性高、准确性好等优点,适用于遇热易破坏的药品,因而在水分测定法中应用范围较广。
费休氏水分测定法所用的标准滴定液称费休氏试液,是由碘、二氧化硫、吡啶和甲醇按一定比例组成的溶液,其滴定的基本原理是利用碘氧化二氧化硫时,需要一定量的水参加反应,为非水溶液中的氧化还原滴定法之一。
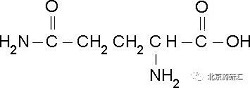
但由于干扰的存在,并不是含结晶水的药物一定能用“水分”测定。例如,一些羰基化合物对此法亦发生干扰,活泼的醛和酮与试剂中的甲醇作用,形成缩醛和水,因而滴定结果偏高。醌可被滴定反应中生成的碘化氢所还原,析出当量的碘,因为在滴定中溶液变深黑色,用目测不易判断终点,此时最好采用电位滴定法。一些氧化剂如铬酸盐、过氧化物等,还原剂如硫代硫酸盐(硫代硫酸钠)、硫化物(二巯丁二钠、乙酰半胱氨酸)等,以及能与试液生成水的化合物如碱性氧化物(咖啡因)等都干扰测定。为排除干扰,药典中的一些含结晶水的药物采用干燥失重的方法测定“水分”,如二巯丁二钠含三个结晶水,理论含水19.3%,测定方法为以五氧化二磷为干燥剂,在60℃减压干燥至恒重,减失重量应为18.0%-24.0%。又如硫代硫酸钠,本品含5分子结晶水,理论含水量36.3%,在48.2℃以上会出现熔化现象。测定方法先在40-50℃加热1-2h,升高温度至105℃并干燥至恒重,减少重量应为32.0-37.0%。
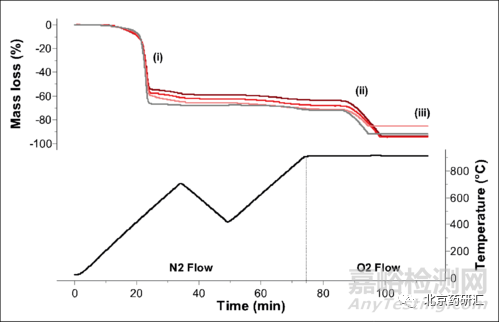
4、其他方法 采用热分析法(Thermal Analysis)测定药物中所含微量水分及研究药物中所含表面水、结晶水以及其他挥发性成分受热时的变化。物质在加热(或冷却)过程中往往会发生相变(如熔化、冷凝、升华、沸腾)或发生脱水、分解、氧化、还原等物理变化或化学变化,研究测定这种变化(特别是能量的变化)即为热分析法。其类型有多种,药物分析中常用的是热重分析(TG)、差示热分析(DTA)、和差示扫描热量法(DSC)等。
TG法是观察和测量物质在加热过程中的重量变化,并从这种变化来研究物质在加热过程中所产生的具有重量变化的反应。常用热天平称量其重量的变化。好的热天平可精确称量到lμg以下,供试样品可达200mg,温度可达1000~1500℃。本法适用于药物结晶水的测定和贵重药物或在空气中极易氧化药物的干燥失重分析。
DTA法是基于物质在加热过程中由于发生了上述物理或化学变化,总是伴随着产生吸热或放热现象,在吸热或放热的同时,必定会影响到温度的改变,通过将供试品与一种情性参比物质(即在加热过程中不发生相变和化学变化的物质)同置于一个可控制的加热容器中,将该容器按一定程序加热,同时测定供试品与参比物质之间的温差(△T),如果供试品无热效应产生,则与参比物质的温度相等,即△T=0。当供试品发生相变化就有热效应产生,如为放热反应,供试品的温度就会高于参比物质的温度,△T为正值,称为放热峰。如为吸热反应,相反, △T为负值。本法适用于待测物质的鉴别、纯度检查以及熔点和水分等测定。
DSC不同于DTA,在整个分析过程中,DSC试保持供试品与参比物质的温度在相同的条件下,测定维持在相同温度时所需的能量差。因此,当供试品发生吸热变化时,温度要下降,必须补充较参比更多的能量才能使其温度与参比相同;反之,当供试品发生放热变化时,温度要升高,则供给的能量应较参比为少,方能使其温度仍与参比相同,由于补充的能量差,相当于供试品发生变化时所吸收或释放的能量,所以记录这种维持平衡的能量既是所需测定的转化热量。待测物的相变(包括熔融、升华和晶型转变等)和化学反应(包括脱水、分解和氧化还原等)可产生特征吸热和特征放热峰。复杂的化合物常有比较复杂的差热分析曲线,各种吸热和放热峰的个数、形状和位置与相应的温度可用于定性地鉴别待测物质或其多晶型;与其对照品或标准品差热分析曲线之间地差异,亦可检查待测物质的纯度。
三、含量(或效价)的限度
含量(或效价)限度是指规定的测定方法测得本品应含“有效物质”的限度。为了能正确反映药品含量,一般应换算成干燥品的含量,并按检查项下所规定的“干燥失重”或“水分”,分别写成“按干燥品计算”,如乙酰半胱氨酸中“本品为……,按干燥品计算,含C5H9N2O3S应为98.0%-102.0%。”或“无水物计算”,如枸橼酸(C6H8O7.H2O)中“本品为……,按无水物计算,含C6H8O7应不得少于99.5%。”;如含有挥发性有机溶剂,也应写明扣除内容,如华法林钠(C19H15NaO4)检查项有水分(2.0%)、异丙醇(7.5%-8.5%),书写格式“本品为……,按无水,无异丙醇计算,含C19H15NaO4应97.0%-103.0%。”、又如秋水仙碱(C22H25NO6)检查项有干燥失重(3.0%)、三氯甲烷和醋酸乙酯(为三氯甲烷和醋酸乙酯加干燥失重的总和不得过10.0%),书写格式“本品为……,按无溶剂的干燥品计算,含C22H25NO6应97.0%-103.0%。”;若所含挥发性有机溶剂已包含在干燥失重之内,则仅需写明“按干燥品计算”而不再扣除溶剂,如地塞米松磷酸钠检查项有干燥失重(16.0%)、甲醇和丙酮(5.0%),书写格式“本品为……,按干燥品计算,含C22H28FNaO8P应为96.0%-102.0%。”
制定标准时,如果检查项下为水分测定,结构分子式中含有结晶水,含量限度中的就要采用去除结构分子式的结晶水的形式“按无水物计算”表达。如果含有结晶水的药物采用干燥失重的方法去除了结构分子式的结晶水,含量限度中的就要采用去除结构分子式的结晶水的形式“按干燥品计算”表达。如果是水分测定,而限度定为采用“按干燥品计算”,就为不规范用语,如,有的含结晶水药物的标准中,检查项为水分,而限度定为采用“按干燥品计算,而药物的结构分子式中并未去除结晶水”,由于检查项并未有干燥失重的数据,不可能按干燥品计算,如果按检查项的水分计算,限度中的分子式中又未去除结晶水,故使得计算含量时出现可操作性差,易引起计算歧异。
四、结语
总之,含量限度的制定看起来是件小事,实际上关系到质量标准制定的质量,关系到含量测定方法的正确选择和误差,关系到干燥失重和水分测定方法的正确选择,应引起关注。