每个医疗器械制造商的目标是保持一致的质量,并保证一定水平的安全和有效性。为了实现这一点,制造商必须遵守一系列法律、标准和法规。遵守所有法规的目的是确保患者、用户和第三方的产品安全。证明技术文件符合所有必要的要求是产品在特定市场成功注册的关键。
美国食品和药物管理局(FDA)是美国的一个监管机构,负责批准即将进入美国市场的医疗器械。欧盟医疗器械法规是由欧盟委员会公布的一套法规,以指导医疗器械制造商在将医疗器械投放市场之前符合法规要求。FDA法规和欧盟MDR对各自的市场都是强制性的。
通常情况下,在美国上市的医疗器械希望在欧盟市场注册并销售其医疗器械,反之亦然。在这种情况下,最大的问题是需了解两方市场所要求的技术文件和上市路径的异同。今天分别介绍FDA和CE法规要求的异同,让您发现医疗器械注册过程的主要差异,以及两类监管之间的相似之处。对于希望在两个市场上销售产品的制造商来说,了解哪些文件可以被两个市场使用,以及哪些文件是特定于某个市场的,是很有帮助的!
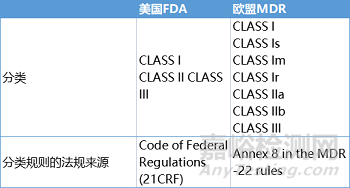
1、分类
根据对病人和/或最终用户影响的严重程度,每种医疗器械都被划分为一定的风险等级。每个等级都有不同的风险和相应的损害效应。
美国FDA和欧盟的《医疗器械注册和登记条例》都规定了医疗器械的三个基本等级。医疗器械分为低风险(I 级)、中等风险(II 级)和高风险(III 级)。在欧盟 MDR 中,还有一些更详细的子分类。
欧盟MDR的医疗器械根据MDR Annex 8中规定的规则进行分类,其中有22条规则,所有医疗器械都能在这些描述中找到,针对医疗器械分类,MDCG小组还发布了MDCG 2021-24“关于医疗器械分类的指导意见”。例外情况是,隐形眼镜等产品以及美容和纹身沙龙的某些器械也受到MDR法规的监管,尽管它们没有严格定义的医疗目的。Annex 16提供了关于非医疗用途器械的更多信息。
在美国市场,大多数医疗器械都可以通过21CFR Parts 862-892 中找到与器械相符的描述,对器械进行分类。
如果一款新产品可以在以上法规部分中找到产品分类,那么它可以通过上市前通知(510(k)),也可以通过上市前批准(PMA)。如果一款新产品不能根据21CFR 862-892进行分类,则自动被分为III类,并必须通过上市前批准。
510(k) 简单来说就是依据已有同类产品获得批准。这意味着制造商的医疗器械与市场上已有的另一种医疗器械相似。其基本理念是,如果可以证明等同性,那么产品就与同类产品一样安全有效。FDA 必须审查 510(k) 并 "批准 ",然后制造商才能在美国合法销售或分销该产品,或在美国销售。
如果产品属于 I 类或 II 类,则适用 510(k)。根据 21CFR Part 814的规定,III 类的医疗器械必须通过 PMA 。PMA 是一种监管和科学程序,用于验证医疗器械的安全性和有效性。上市前批准的基础是,产品的安全性和有效性在任何时候都有足够的临床研究和科学证据作保证。如果医疗器械因尚未上市而无法与任何上游器械进行比较,则该器械将自动被归入III类。
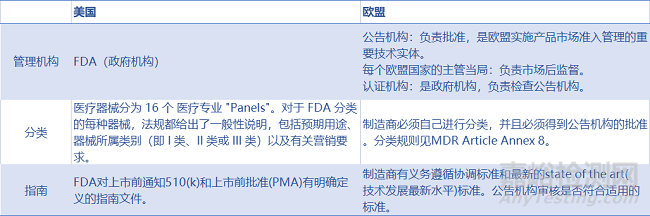
2、审批流程
审批流程是指医疗器械获准投放市场的流程,本文为广大制造商制作了审批流程差异表,详细分解欧盟MDR和美国FDA的审评差异。
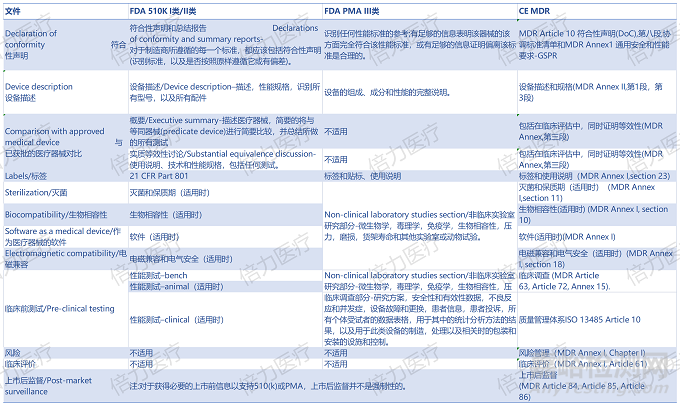
3、技术文档
在没有系统性学习美国和欧盟的医疗器械法规时,大部分人只是对FDA和CE的大致关键要素有些了解,比如:510K的本质是实质等同、CE-MDR的法规本质是满足法规的要求,临床数据可以选择等同器械的临床文献。那如何参照法规?如何搞懂全套技术文档到底要什么?
注:本表只考虑与医疗器械直接相关的文件,不包括申请 FDA 和公告机构所需的任何行政文件。
FDA和CE的异同总结
大多数经FDA批准的医疗器械都通过510K路径获得上市资格,除了与等同器械对比外,大部分情况下是不用提供临床信息的。因此这是和CE-MDR的最大区别,在MDR法规下制造商将在根据MDR准备临床评估方面付出很大努力。
第二大区别是,上市后监督不需要获得FDA的批准。因此,如果这是第一次在FDA注册医疗器械,那么制造商没有建立上市后监督系统,而这对欧盟市场是强制性的。对于在美国的公司,他们的产品已经在市场上上市一段时间(II类和II类),根据FDA的section 522 ,建立了a postmarket system。