导 读
本文简单介绍了PFA的历史应用到如今爆火的心脏消融领域的发展历程,着重介绍了影响PFA作用效果的影响因素,核心零部件以及系统组成,最后总结了PFA在心脏电生理治疗的潜在风险。
一、脉冲电场发展历程1
脉冲电场消融(pulsed field ablation, PFA)指在非常短的时间内(ms、μs、ns)应用间歇性的高强度脉冲电场,造成细胞膜电穿孔的不可逆性损伤(IRE)。
该技术始于上世纪六十年代食品和水消毒领域,八十年代初,尝试应用直流电脉冲消融心动过速,也是该技术首次用于心脏领域,由于当时对电脉冲的认识不足,安全性无法保证而终止;
Neumann在1982年首先应用电穿孔技术将外生的DNA引入到小鼠的淋巴瘤细胞内。细胞膜在一定强度的脉冲电场中可以发生RE,这一现象随后被广泛应用于基因工程,药物筛选和电化学治疗;
本世纪初,Davalos教授应用脉冲电场成功地破坏了实体肿瘤组织;
2012年,FDA批准基于高频脉冲电场的纳米刀技术用于肿瘤治疗。同年,Fred首次应用脉冲电场技术和环形电极对猪的心外膜心肌组织进行消融,验证了脉冲电场在心肌组织内可以形成连续的损伤,脉冲电场造成的损伤深度,足可以实现肺静脉的隔离;
2018年,Reddy教授首次在房颤患者中应用PFA技术进行了肺静脉消融,15例心内膜消融患者即刻成功率100%,每位患者总的PFA时间<60s,无严重并发症。
近些年国内外公司已经基于PFA原理进行大规模的心脏电生理消融临床试验, 2021年初,Farapulse PFA 系统获 CE 批准上市,国内也诞生了大量相关企业,对 PFA 的开发趋于白热化,技术也向更加快速化、精准化、整合化的方向发展。
二、脉冲电场消融的影响因素
1.脉冲电场生物学基础
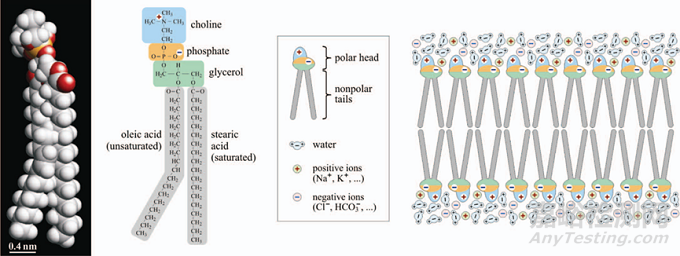
每个生物细胞都被双层脂质质膜包围,其中含有多种蛋白质,用作离子泵或通道,允许特定分子在细胞内部和外部之间运输。对于其他物质,细胞膜充当生物屏障,保护细胞免受环境影响。质膜的脂质由亲水(极性)和疏水(非极性)部分组成。细胞与离子泵和通道一起维持质膜内侧和外侧之间的电势差。在真核细胞中,静息跨膜电压范围为-40至-70 mV2。
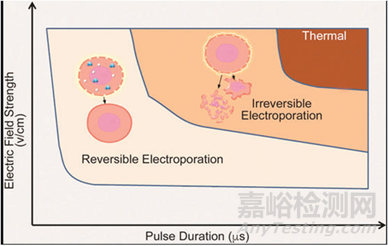
当生物膜暴露于足够高的外部电场可导致其电导率和渗透性快速大幅增加。这种效应通常被称为膜电穿孔。根据电场的强度对细胞莫得影响分为可逆电穿孔和不可逆电穿孔。对于心律失常治疗,目标达到不可逆电穿孔状态从而阻滞异常电信号的传导。
不可逆电穿孔受到多重因素影响,其中最重要的是电穿孔阈值因细胞而异,据报道在 200 至 500 mV 之间。电穿孔效果很大程度上取决于所施加的电穿孔信号的精确再现性。由于电穿孔过程是由局部电场驱动的,因此在大多数情况下输出电压是受控的。电穿孔信号的特征在于电场强度、脉冲幅度和持续时间、脉冲数量、脉冲重复频率和换向序列3。
2.电场强度
电穿孔对组织产生作用的基础是电场强度。传递的电场越强,对目标组织的影响越大。但随着电场强度的增加,产生热量的风险也会增加,从而导致热效应的转变。如下图所示:脉冲越长、电压越大,造成不可逆伤害和热损坏的可能性就越大4。
3.脉冲数和脉冲重复率
增加脉冲数量和脉冲重复频率通常会增加观察到的总体效果,但是这种关系不是完全线性关系。
目前尚不清楚需要施加的脉冲数量是否有一个临界阈值,但一些单细胞数据提示,当施加超过16个脉冲时,通透性或50%细胞群的死亡没有显著差异5。
电穿孔依赖于脉冲重复率,但目前文献并没有取得一致的认同关系。在一系列体内和体外实验中,有报道说随着重复次数的增加,效果会降低或者效果会提高。
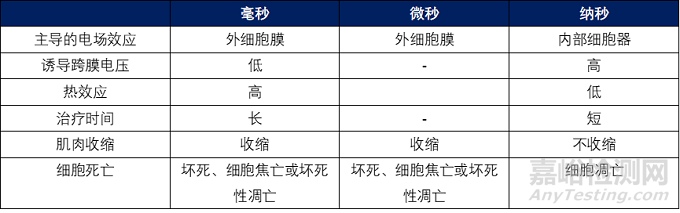
4.脉冲时间
脉冲持续时间的增加将对细胞产生更大的电穿孔效应。对于较长的脉冲,需要较低的电压来维持相同数量的电穿孔细胞,是一种非线性关系,特别是当持续时间<1毫秒时,需要更高的电压才能达到相同的效果。例如,当电场强度为137 V/cm时,100 ms脉冲可以导致细胞电穿孔,当电场增加到575 V/cm,100μs 即可导致细胞电穿孔,当电场强度升到10 kV/cm,获得相同效果时仅用150 ns脉冲6。
5.脉冲形状
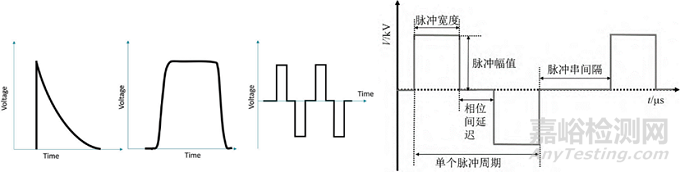
典型的脉冲电场(PEF)系统使用直流 (DC) 电源对电容器充电,然后在高压开关的帮助下对电容器进行放电(脉冲)。PEF有多种脉冲波形,包括方波、指数波、双相波和正弦波。方波是医学上最常用的,并且可以以相对较高的频率传送多个脉冲。方波有许多参数,包括脉冲持续时间、上升和下降时间以及幅度。双极高频脉冲在高频(高达 1 MHz)下使用多个非常短的脉冲(低至不到一微秒)可以防止肌肉收缩,产生有效的损伤的同时还会带来最小的疼痛或没有疼痛。
6.电极方向
电极方向相对于消融组织的纤维取向(各向异性)对观察到的效果具有重要影响。当平行于组织纤维施加类似的电场时,观察到比垂直于组织施加电场时更大的电穿孔效应。
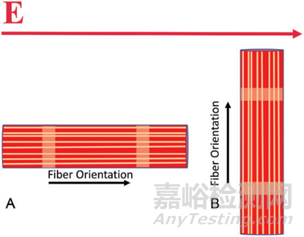
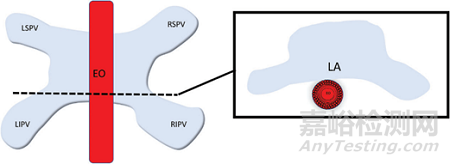
肌纤维的取向也对组织选择性的优势起作用。例如,食道既有纵向肌纤维也有圆形肌纤维,电场穿透纵向纤维;当它到达垂直的圆形纤维时,收到的 PEF效应比较小。如下图所示:LA,左心房;LSPV,左上肺静脉; LIPV,左下肺静脉; RSPV,右上肺静脉; RIPV,右下肺静脉。
7.细胞选择特异性7
当跨膜电压达到每个组织或细胞特有的某个阈值时,电穿孔现象就会发生。心脏细胞的 IRE 阈值低于周围组织的 IRE 阈值,例如神经 (3,800 V/cm)、血管平滑肌细胞或内皮细胞(1,750 V/cm)。
心脏电穿孔阈值的个体化数据源自细胞研究。然而,不同的非标准化电穿孔方案所应用的脉冲参数(或脉冲参数定义)不一致以及使用不同的电穿孔发生器导致数据的可比性、再现性不一致。大鼠成肌细胞为 375 V/cm,大鼠心室细胞为 500 V/cm(导致 80% 细胞死亡),人心肌细胞为750 V/cm ,和另一个心脏细胞系为1,250 V/cm。所以每一个电脉冲消融系统都需要探索其特定模式下的相关电穿孔参数。
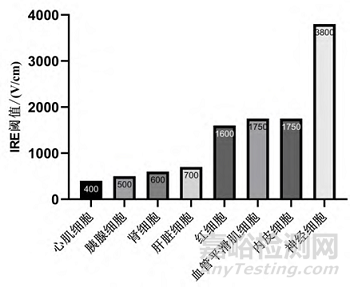
图 不同类型细胞的 IRE 阈值
三、PFA的发生
脉冲发生器系统一般由电源、存储单元、快速开关、触发电路、负载构成。
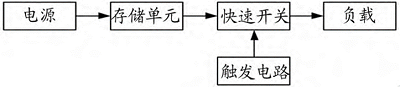
电源能持续稳定地将电能存储在储能单元中,储能单元存储足够的能量后,控制触发电路产生触发信号,驱动快速开关导通或关断,使储能单元的能量在一瞬间被释放,输出到负载上形成高压脉冲8。
依据储能单元不同,脉冲功率技术中常用的储能单元可以分为电容型储能和电感型储能。典型的纳秒脉冲发生器有9:
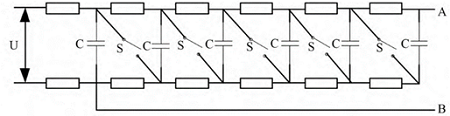
马克思发生器( MARX):利用低压直流电源 U 对电容 C并联充电,再利用开关 S 使所有电容支路串联放电,在AB端输出高电压脉冲信号。
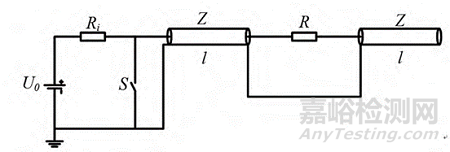
Blumlein传输线(Blumlein Transmission Line):U0 为高压直流电源, Ri 为充电电阻,单根传输线长度为 l,特性阻抗为 Z, S 为放电开关, R 为负载电阻,其基本工作原理是高压直流电源经过充电电阻将两个串联的传输线充电至 U0。当负载匹配,开关 S闭合时,负载电阻两端可得到幅值为 U0 的电脉冲。
目前临床上使用的纳秒脉冲消融肿瘤设备也大多是基于这些原理并加以改良而制造的。想要获得纳米级脉冲,快速开关是核心器件既要实现纳秒级快速导通和关断,又要能够承受数十千伏甚至上百千伏的高压。纳秒脉冲消融肿瘤设备对快速开关要求十分严苛,传统的开关器件虽然输出电压较高,但体积大、成本高且寿命有限。
近年来现代功率半导体技术的发展,新型半导体开关器件的开关速度和耐压有很大提升,给纳秒脉冲功率技术带来了新的方向。
四、PFA的潜在风险和不良反应
脉冲电场作为新的消融能量在心律失常领域展现了安全和高效的优势,但同时还需要了解和关注这项技术目前存在的一些问题,包括高电压的风险、骨骼肌收缩、微泡现象等。
1.高电压的影响
更高的输出电压意味着更高的场强和可能更大的损伤范围。但是,过大的输出电压也会带来安全性的风险:包括出现热效应、增加骨骼肌的收缩、微泡的形成,甚至出现电弧。
电弧的出现可以造成局部组织的气压伤,电弧还会造成血液在电极表面的结痂和凝结,影响随后的消融效果。因此,脉冲消融仪在参数设置上要有安全上限值,手术中对输出电压的调整不能超过安全上限。另外,脉冲消融仪还需要能够实时监控是否发生了电弧,如果发生,需要能够自动切断后续脉冲波的输出。
2.骨骼肌收缩
骨骼肌收缩是PFA过程中常出现的伴随症状,尤其是长时程的单相脉冲波消融时。增加脉冲波的频率,可以显著减少骨骼肌的收缩和扭矩。目前市场上用于房颤的主流脉冲消融仪器多采用高频双相脉冲波,采用较短时程的消融10。
3.微泡现象
脉冲波发放时可以通过超声监测到微泡的发生。术中微泡的形成机制目前还不是非常明确,可能的机制是血液中氮气的水解或置换。多个脉冲参数(电压、脉宽等)的改变可以影 响 微泡的形成。直径<38μm的气泡被认为会迅速溶解(6-10s),不太可能导致脑血流受损11。目前对于PFA过程中微泡的影响,还缺乏大样本和长期的随访数据,值得进一步探索。
参考文献:
[1] 徐剑刚,唐闽,梁明等.脉冲电场消融与细胞电穿孔:从基础到临床[J].中国心脏起搏与心电生理杂志,2022,36(05):404-406.
[2] Hartl S, Reinsch N, Füting A, Neven K. Pearls and Pitfalls of Pulsed Field Ablation. Korean Circ J. 2023 May;53(5):273-293.
[3] M. Rebersek, D. Miklavcic, C. Bertacchini and M. Sack, "Cell membrane electroporation-Part 3: the equipment," in IEEE Electrical Insulation Magazine, vol. 30, no. 3, pp. 8-18, May-June 2014
[4] Maor E, Sugrue A, Witt C, Vaidya VR, DeSimone CV, Asirvatham SJ et al. Pulsed electric fields for cardiac ablation and beyond: a state-of-the-art review. Heart Rhythm 2019;16:1112–20.
[5] Macek-Lebar A, Miklavcic DJR. Cell electropermeabilization to small molecules in vitro: control by pulse parameters. Oncology 2001;35. Retrieved from https://www.radioloncol.com/index.php/ro/article/view/1446
[6] Yao C, Lv Y, Zhao Y, Dong S, Liu H, Ma J. Synergistic combinations of short high-voltage pulses and long low-voltage pulses enhance irreversible electroporation efficacy. Sci Rep 2017;7:15123.
[7] Hartl S, Reinsch N, Füting A, Neven K. Pearls and Pitfalls of Pulsed Field Ablation. Korean Circ J. 2023 May;53(5):273-293.
[8] 吴启翔,陈永刚,龚立娇等.纳秒脉冲电场肿瘤消融关键技术研究综述[J].中国医疗设备,2023,38(05):36-43.
[9] 蔡焱. 高压纳秒时域信号源研究[D]. 西安: 电子科技大学, 2019.
[10] Miklavcic D, Pucihar G, Pavlovec M, Ribaric S, Mali M, Macek-Lebar A, Petkovsek M, Nastran J, Kranjc S, Cemazar M, Sersa G. The effect of high frequency electric pulses on muscle contractions and antitumor efficiency in vivo for a potential use in clinical electrochemotherapy. Bioelectrochemistry. 2005 Feb;65(2):121-8.
[11] Douglas YL, Jongbloed MR, Gittenberger-de Groot AC, Evers D, Dion RA, Voigt P, Bartelings MM, Schalij MJ, Ebels T, DeRuiter MC. Histology of vascular myocardial wall of left atrial body after pulmonary venous incorporation. Am J Cardiol. 2006 Mar 1;97(5):662-70.