导 读
本篇内容详细介绍了作为人工器官潜在的治疗方法之3D生物打印,详细介绍了目前在研究阶段的3D打印技术以及技术对比,其次介绍了打印所用的天然材料和高分子材料及相应的优缺点,最后介绍了材料结合细胞的打印方式。
(一)3D打印技术
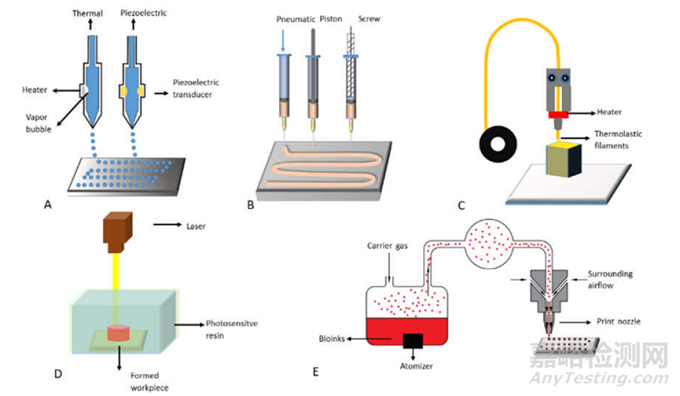
与传统制造技术相比,3D打印技术在生物人工器官制造方面具有诸多优势,尤其适用于快速、精准、定制化的生物医学应用。如下图所示是目前研究中常用的3D打印技术:
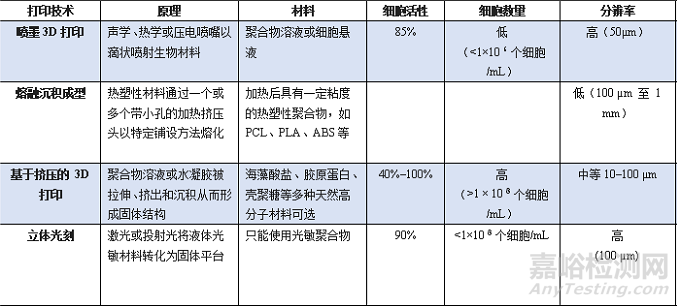
(A)喷墨3D打印(Inkjet 3D printing);基于喷墨的 3D 打印是一种非接触式增材制造(AM)技术,改编自工业 2D 打印机。在传统的 2D 打印中,一层液滴被选择性地沉积,而在 3D 生物打印中,可以通过改变“生物墨水”和沉积层的内容,将细胞和蛋白质打印成所需的器官形状。按需喷墨打印机是最常用的设备,由声学、热学、压电或静电喷墨喷嘴组成。喷墨打印机通常用于打印用于细胞接种的组织工程支架。但打印分辨率差、打印速度慢等问题极大地限制了其保真度和临床推广1;
( B ) 基于挤压的 3D 打印(Extrusion based 3D printing);与 FDM 类似,基于挤压的 3D 打印将“生物墨水”从注射器或喷嘴沉积到基于 CAD 模型的构建平台上,但该过程不涉及任何加热过程。含有细胞、生长因子和其他生物活性剂的聚合物溶液或水凝胶可以通过气动压力或物理压力的方式通过喷嘴挤出。
与其他3D打印工艺相比,基于挤压的3D打印技术提供了更高的打印速度。随着挤压3D 打印技术的发展,多种细胞类型可以以非常高的细胞密度与不同的生物相容性聚合物溶液/水凝胶一起沉积。聚合物溶液或水溶胶的固化是通过一系列物理和化学方法,如物理交联)、聚合、化学交联和酶促反应2。
打印后的细胞活力在40%到80%的范围内。通过优化打印参数,如沉积速率、压力和温度,可以提高细胞存活率3。
( C ) 熔融沉积成型(Fused deposition modeling,FDM);通过一个或多个带有小孔的加热挤压头,以特定的铺设模式逐层沉积熔融热塑性聚合物,也被称为“热塑性挤出”。在 FDM 中,将热塑性聚合物熔化成半液态,然后将半液态聚合物逐层挤出到平台上。挤出前的热塑性聚合物一般呈丝状或颗粒状。当热塑性聚合物被加热到高于其熔点的温度时,它会变成流体并从喷嘴中流出。一旦塑料聚合物从喷嘴中流出,它就会硬化并与下面的层结合。一旦构建了一层,降低平台或升高喷嘴,挤出喷嘴沉积另一层4。FDM技术在器官3D打印领域的致命缺点之一是细胞、生长因子和其他生物活性剂不能在高聚合物熔化温度下直接打印。
( D )立体光刻(Stereolithography,SLA);最早出现的 3D 打印技术,SLA 是最成熟的 3D 打印方式,在业界得到广泛应用。在 SLA 中,主要利用紫外激光为光源,再用振镜系统来控制激光光斑扫描,激光束会在液体树脂表面上先画出一个物件形状,随后打印平台会下降一定距离,再让平台浸入液体树脂中,如此反复,形成实体打印。
与其他传统方法相比,光固化生物3D打印具有灵活性高、分辨率高、制造速度快等特点。这些特性使其广泛应用于角膜基质组织再生、胰岛素输送、组织工程支架制造等领域5。
目前SLA的缺点也很明显6:
打印技术局限性:不同的SLA技术对灯管波长、打印尺寸、“生物墨水”黏度要求不同,难以标准化。
材料局限性:可用作“生物墨水”的光固化生物材料较少,且具有所需的低粘度。
成本限制:SLA仪器及其打印的生物材料价格昂贵,导致临床试验受限。
( E ) 气溶胶喷射打印(Aerosol jet printing):气溶胶喷射打印是一种非接触式打印方法,具有高分辨率和灵活性。“生物墨水”被放置在雾化发生器中,并通过超声波或气动雾化成气溶胶颗粒,然后通过惰性气体输送到打印喷嘴7。
该方法可以打印在金属、半导体、聚合物等多种基材上,产品广泛应用于电子领域。医疗设备主要是对柔性、可拉伸和可穿戴电子产品的探索。但研究表明,超声处理可使DNA变性,限制了其在生物医学领域的应用。到目前为止,除了心脏补片工程和蛋白质检测外,很少有使用该方法进行 3D 打印器官的研究8。
表 打印技术对比
(二)3D生物材料墨水
生物墨水是指位于 3D 或生物材料内的细胞或细胞聚集体。在生物打印领域,生物墨水指的是载有细胞,生物材料墨水单纯指材料即无细胞。因此,构成生物墨水的生物材料必须作为细胞载体,生物材料墨水可以打印,但只能在打印后播种细胞。如下图所示9:
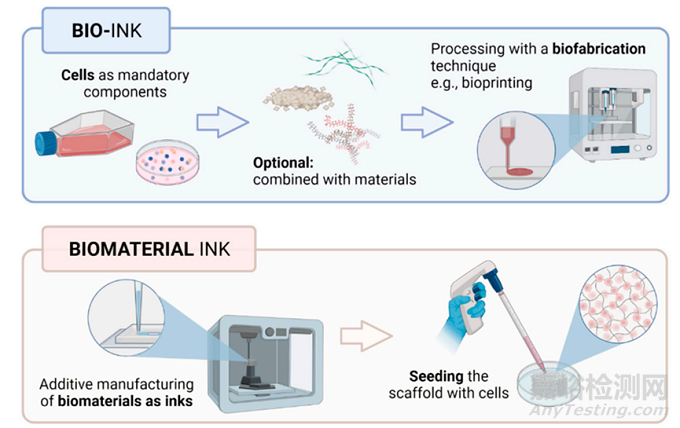
3D打印材料作为承载细胞以及相关因子的重要载体,材料必须具有如下的特点10:
a.可打印性:即用于打印的材料必须可以在一定的时间内精确地沉积在所指定的空间内,该性能直接关系到3D打印产品是否能取得期望的结构与尺寸精度;打印参数如喷头尺寸,会直接影响到材料内细胞所受到的剪切应力及材料沉积形成3D结构所需的时间,需要同时考虑对细胞活性的保护能力;
b.生物相容性:从最初的要求材料能够与组织器官共存,且不引起宿主任何不良的局部或系统反应,发展到植入材料需要与宿主产生积极的相互作用,包括与宿主组织和/或免疫系统的相互作用,以达到调控宿主细胞、组织和器官活性与功能的目的;生物相容性主要受材料的化学组成、结构形态(如多孔结构/丝状结构)、表面特性(如亲疏水性)、表面电荷以及材料的力学性能、物理化学特性等因素的影响;
c.力学稳定性:材料具有一定的力学强度,能够一定程度上抵抗外界作用力,维持打印物的形貌结构,在3D打印构建组织器官的相关研究中,应根据不同靶组织器官(如皮肤、肝脏、软骨、骨等)所需的结构力学环境,选用具有相应力学特性的打印材料;
d.降解特性:理想的生物打印材料,植入体内后应当随着细胞的增殖及细胞外基质(ECM)的产生而逐渐降解,且降解速率应当与细胞产生ECM替换植入材料的速率,及新组织生成的速率相匹配,同时降解产物应该无毒。易于代谢,能够快速代谢排除体外;
f.仿生学特性:材料仿生学特性有利于刺激细胞响应.在生物材料中掺入生物活性组分可对内源或外源细胞的粘附、迁移、增殖及功能表达产生积极作用,材料表面性质如化学基团的修饰、粗糙度、亲疏水性、微纳米结构等直接影响到细胞的铺展形状、分化过程、运动、取向、细胞骨架的组装,甚至是细胞内部的相关信号通路。11
1、生物打印材料
用于生物3D打印的高分子材料可分为合成高分子材料与天然高分子材料。用于生物3D打印的天然高分子材料有三个突出特点:良好的生物相容性、较差的机械强度和快速的生物降解性。经过几十年的探索,常用的高分子材料的性质总结如下表:
合成高分子网络由可重复的惰性单元组成。它们通常在机械性能和免疫原性反应方面优于天然高分子材料。常用的可生物降解合成聚合物包括 PLA、PGA、PU、PLGA 和 PCL。与天然聚合物相比,大多数合成聚合物明显优点包括合成方便、资源丰富、易加工、耐压、重量轻、成本低。其特点总结如下表13:
2、多材料3D打印
材料在体外打印构建组织器官时,需起到保护支撑、维持活性、诱导分化、引导新生以及促使功能成熟等多重功能。因此,任何单一组分的材料都不可能兼具重构组织功能所需的所有特性。开发多材料3D打印成为一个必然的趋势。多材料比单一材料方法更好地复制其宿主微环境。
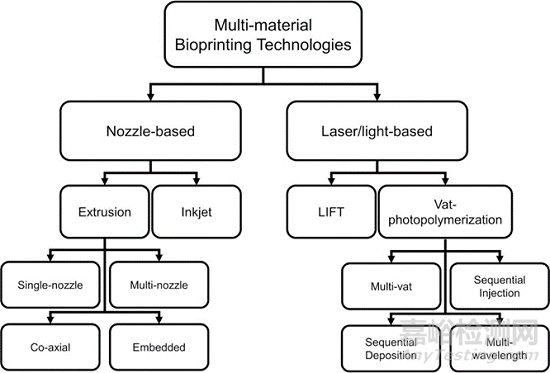
多组分生物墨水是指由两种或两种以上不同的生物材料混合而成的单相均质生物墨水。使用多种材料打印,必须考虑材料界面处的相互作用。较高的界面粘附力可以提高生物打印结构的韧性和抗疲劳性。但是,在多材料(生物)打印过程中,将水凝胶与不同性质的材料(尤其是弹性体和热塑性塑料)结合起来具有挑战性15。用于多材料打印的3D打印技术如下图所示:
以下简单列举几项多材料打印技术:
1)单喷嘴生物打印技术
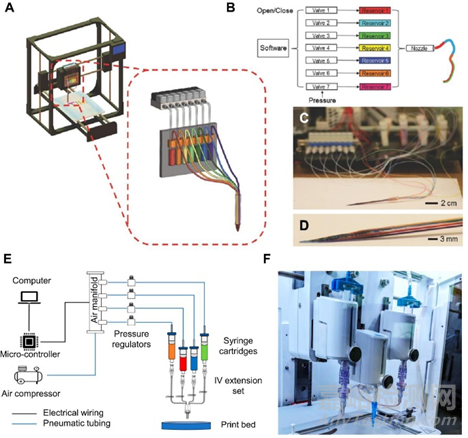
通过一个喷嘴挤出不同的生物墨水仍然是多材料生物打印的形式。如下图所示:多储液器系统和混合器是两种最常见的相关方式。混合器的作用是混合两种或多种不同浓度的生物墨水,以促进多材料打印,从而促进制造具有连续梯度特性的结构。
2)多喷嘴生物打印技术16
单喷嘴技术的一个缺点是(生物)墨水在一个喷嘴中流动时存在交叉污染的风险。多喷嘴多材料生物打印机与单喷嘴生物打印机相比,可以以更快的速度和更大的构建体积制造更复杂的特征。
3)同轴生物打印技术
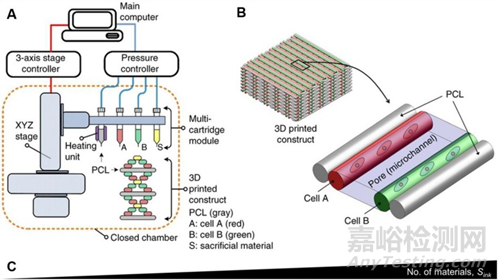
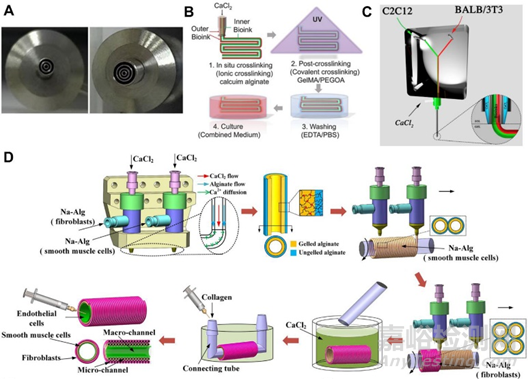
同轴喷嘴是一种用于生物打印多材料核壳结构的机制,如血管结构、异质微纤维和肿瘤模型。能够制造具有成分和几何复杂性的中空结构。同轴喷嘴特别适用于与交联剂混合后快速交联的生物墨水。例如:下图B中,CaCl 2用于内部喷嘴以离子交联生物墨水。双层管状结构随后通过紫外线再次交联以形成稳定的结构。使用这种设计,可以一步连续改变形状、尺寸和层数,而无需更换喷嘴。这些圆周多层构造可用作人体套管组织模型17。
3、3D打印干细胞
干细胞是一类具有自我更新能力,并能分化成其他类型细胞的特殊细胞,而人体正常组织的更新和修复与组织特异性干细胞密切相关,如骨髓干细胞、胚胎干细胞( embryonic stem cells,ESC )、造血干细胞、内皮祖细胞等。随着技术进步, 2007 年已实现人工将人的成年体细胞经过基因重组技术培养成诱导型多能干细胞( induced pluripotent stem cells , iPSC )18
干细胞治疗特点19:
① 治疗适用性强:干细胞可以从单个细胞分化成内胚层、中胚层和外胚层所有的细胞,最终形成机体的所有组织和器官,其成品可以在生物内环境中移植、存活并保持长期稳定。因而其治疗范围理论上可涵盖人体任何组织器官及相关疾病(如神经系统损伤、免疫功能障碍、器官衰竭、美容、断肢等),在自体组织器官移植方面有不可替代的作用;
② 获取容易:细胞技术发展初期,细胞来源往往局限于生物组织甚至体内采集,不可避免产生创伤及相应副作用,随着技术发展,干细胞已经可以通过人工诱导获取,是目前免疫治疗和基因治疗的最佳载体。
③ 副作用少且效果持久:干细胞治疗是能够以患者自身的细胞为基础,制作相应的干细胞并形成适用于疾病的治疗手段,在应用时减少了组织相容性的问题,减低乃至消除了治疗、移植过程中的排斥反应及使用免疫抑制剂所产生的副作用,且植入细胞并非快速消耗品,其定植于体内后可产生持久的治疗效果。
目前细胞打印在生物医学领域可应用的打印方案:
① 先打印出具有生物相容性的支架材料,再将有活性的细胞、干细胞组织种植到材料上形成细胞 - 材料复合体, 然后将细胞 - 材料复合体植入组织缺损部位,支架材料在逐步降解的同时,种植的细胞不断增殖、生长,形成细胞间连接,从而达到修复组织缺损的目的20;
② 将细胞与支架材料直接混合打印,一个或多个打印喷头打印细胞悬浮液,另一个或多个喷头打印细胞生长所需的支架(微环境),其支架材料的主要成分是含水的生物凝胶,逐层打印, 叠加形成 3D 的多细胞 - 凝胶支架体系,最终用于治疗或移植。活细胞的打印可实现组织器官结构及部分生物功能的重建,而由于打印过程是由计算机控制细胞排列,两种方案在技术上均可在生物体内进行原位打印,如原位软骨细胞打印进行骨修复;
③ 新兴方案,将细胞预制成细胞团,打印时使用临时的固定装置,如微型探针等以预期打印结构为目标进行结构固定,让细胞团生长融合达到稳定状态再去除临时固定装置,最终形成细胞自行连接的紧密结构,从而实现无支架的细胞打印21。
参考文献:
[1] Gudapati, H.; Dey, M.; Ozbolat, I. A comprehensive review on droplet-based bioprinting: Past, present and future. Biomaterials.2016, 102, 20–42.
[2] Ricci, J.L.; Clark, E.A.; Murriky, A.; Smay, J.E. Three-dimensional printing of bone repair and replacement materials: Impact on craniofacial surgery. J. Craniofacial Surg. 2012, 23, 304–308.
[3] Billiet, T.; Gevaert, E.; De Schryver, T.; Cornelissen, M.; Dubruel, P. The 3D printing of gelatin methacrylamide cell-laden tissue-engineered constructs with high cell viability. Biomaterials 2014, 35, 49–62.
[4] Turner, B.N.; Strong, R.; Gold, S.A. A review of melt extrusion additive manufacturing processes: Process design and modeling.Rapid Prototyp. J. 2014, 20, 192–204.
[5] Mahdavi, S.S.; Abdekhodaie, M.J.; Kumar, H.; Mashayekhan, S.; Baradaran-Rafii, A.; Kim, K. Stereolithography 3D bioprinting method for fabrication of human corneal stroma equivalent. Ann. Biomed. Eng. 2020, 48, 1955–1970.
[6] Song D, Xu Y, Liu S, Wen L, Wang X. Progress of 3D Bioprinting in Organ Manufacturing. Polymers (Basel). 2021 Sep 18;13(18):3178.
[7] Serpelloni, M.; Cantù, E.; Borghetti, M.; Sardini, E. Printed smart devices on cellulose-based materials by means of aerosol-jet printing and photonic curing. Sensors 2020,20, 841.
[8] Basara, G.; Saeidi-Javash, M.; Ren, X.; Bahcecioglu, G.; Wyatt, B.C.; Anasori, B.; Zhang, Y.; Zorlutuna, P. Electrically conductive 3D printed Ti3C2Tx MXene-PEG composite constructs for cardiac tissue engineering. Acta Biomater. 2020, 19.
[9] Groll, J.; Burdick, J.A.; Cho, D.W.; Derby, B.; Gelinsky, M.; Heilshorn, S.C.; Jüngst, T.; Malda, J.; Mironov, V.A.; Nakayama, K.; et al.A definition of bioinks and their distinction from biomaterial inks. Biofabrication 2018, 11, 013001.
[10] 毛宏理,顾忠伟.生物3D打印高分子材料发展现状与趋势[J].中国材料进展,2018,37(12):949-969+993.
[11] 朱敏,黄婷,杜晓宇,朱钰方.生物材料的3D打印研究进展[J].上海理工大学学报,2017,39(05):473-483+489.
[12] Fatimi A, Okoro OV, Podstawczyk D, Siminska-Stanny J, Shavandi A. Natural Hydrogel-Based Bio-Inks for 3D Bioprinting in Tissue Engineering: A Review. Gels. 2022 Mar 14;8(3):179.
[13] Assad H, Assad A, Kumar A. Recent Developments in 3D Bio-Printing and Its Biomedical Applications. Pharmaceutics. 2023 Jan 11;15(1):255.
[14] Fatimi A, Okoro OV, Podstawczyk D, Siminska-Stanny J, Shavandi A. Natural Hydrogel-Based Bio-Inks for 3D Bioprinting in Tissue Engineering: A Review. Gels. 2022 Mar 14;8(3):179.
[15] Ravanbakhsh H, Karamzadeh V, Bao G, Mongeau L, Juncker D, Zhang YS. Emerging Technologies in Multi-Material Bioprinting. Adv Mater. 2021 Dec;33(49):e2104730.
[16] Kolesky DB, Truby RL, Gladman AS, Busbee TA, Homan KA, Lewis JA, Adv. 2014, 26 , 3124.
[17] Pi Q, Maharjan S, Yan X, Liu X, Singh B, van Genderen AM, Robledo-Padilla F, Parra-Saldivar R, Hu N, Jia W, Xu C, Kang J, Hassan S, Cheng H, Hou X, Khademhosseini A, Zhang YS, Adv. Mater 2018, 30, 1706913.
[18] Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripo-tent stem cells from adult human fibroblasts by defined factors [J]. Cell, 2007, 131(5): 861-872.
[19] 庄东林,赵明一,刘南波,何标川,黄焕雷,朱平.3D打印技术在干细胞再生领域的发展及应用[J].生物医学工程与临床,2020,24(04):489-495.
[20] Park KM, Shin YM, Kim K, et al. Tissue engineering and regenerative medicine 2017: A year in review [J]. Tissue Eng Part B Rev, 2018, 24(5): 327-344.
[21] Moldovan NI, Hibino N, Nakayama K. Principles of the ken-zan method for robotic cell spheroid -based three -dimensional bioprinting[J]. Tissue Eng Part B Rev, 2017, 23(3): 237-244.