今日头条
施贝康小分子抗血栓新药报产。成都施贝康生物开发的1类化药sbk002片的上市申请获CDE受理,推测适应症为预防动脉粥样硬化血栓形成事件,如:近期心肌梗死患者(从几天到小于35天),急性冠脉综合征的患者,缺血性卒中患者(从7天到小于6个月)或确诊外周动脉性疾病的患者。这是施贝康生物开发的首个小分子新药,复星医药拥有该产品的大中华片区独家商业化授权。
国内药讯
1.康哲引进银屑病新药获批上市。康哲药业与太阳制药联合开发的替瑞奇珠单抗(Tildrakizumab)获国家药监局批准上市,用于治疗中重度斑块状银屑病患者。Tildrakizumab是一款靶向IL-23的人源化lgG1/k单抗,通过与IL-23的p19亚基结合,并抑制其与IL-23受体相互作用,从而抑制促炎症细胞因子和趋化因子的释放。2018年3月,该药已获FDA批准上市,用于治疗符合系统治疗或光疗指征的中重度斑块状银屑病,商品名为Ilumya。
2.康方PCSK9单抗降脂Ⅲ期临床积极。康方生物旗下子公司康融东方在EAS2023会议上发布PCSK9单抗伊努西单抗(AK102)治疗原发性高胆固醇血症和混合型高脂血症患者的关键Ⅲ期研究积极结果。与基线相比,AK102(450mg Q4W和150mg Q2W)组患者12周治疗后LDL-C(低密度脂蛋白胆固醇)水平分别降低64.90%和66.21%;两个剂量组LDL-C水平较安慰剂组分别下降59.13%和60.43%;药物的总体耐受性良好。
3.海正SHP2抑制剂获批实体瘤临床。海正药业SHP2小分子抑制剂HS336获国家药监局临床试验默示许可,拟开发用于治疗晚期实体瘤。HS336旨在将SHP2锁定在自抑制构象,阻止PTP催化中心与底物的接触,从而发挥相应的抗肿瘤作用。在临床前研究中,HS336已显示出针对食管鳞状细胞癌、头颈部鳞状细胞癌、非小细胞肺癌、结直肠癌等实体瘤的治疗潜力。
4.国产双价诺如病毒疫苗启动Ⅲ期临床。兰州生物制品研究所、国药中生生物技术研究院、北京生物制品研究所联合登记启动一项重组诺如病毒双价(GI.1/GII.4)疫苗的Ⅲ期临床试验,拟评估用于6月龄-13周岁健康人群全程接种疫苗14天后,预防由GI.1或GII.4型诺如病毒感染引起的中/重度急性胃肠炎的保护效力。该试验主要研究者为河北省疾病预防控制中心吴志伟副主任医师。
5.礼来CD200R激动剂中国获批湿疹临床。礼来1类生物制品LY3454738注射液获国家药监局临床试验默示许可,拟用于特应性皮炎的治疗。LY3454738是一款靶向激活CD200R的单克隆抗体,通过激活CD200R可降低细胞因子的释放和减少细胞增生。在针对特应性皮炎适应症的Ⅰ期临床试验中,治疗12周之后,患者的平均湿疹面积和严重程度指数(EASI)与基线相比降低约60%。
6.百济神州引进DLL3/CD3双抗获批临床。安进1类生物制品tarlatamab获国家药监局临床默示许可,拟开发用于治疗含铂一线化疗后的复发性小细胞肺癌患者。tarlatamab(AMG 757)是一款靶向DLL3和CD3的潜在“first-in-class”双特异性T细胞衔接蛋白(BiTE),百济神州拥有该药的中国商业化权益。在I期临床中,Tarlatamab的确认ORR为23%,疾病控制率为51%。
7.迈威IL-11单抗国内获批临床。迈威生物自主研发的靶向人白介素-11 (IL-11) 的人源化单克隆抗体9MW3811获国家药监局批准,拟针对晚期恶性肿瘤和特发性肺纤维化开展临床试验。9MW3811通过高效阻断IL-11下游信号通路的活化,抑制IL-11诱导的病理生理功能,从而达到治疗纤维化和肿瘤的目的。此前,该新药已在澳大利亚获批临床,是全球同靶点药物中首个开展临床试验的单抗药物。
8.mRNA巨头Moderna落户上海。5月24日,Moderna公司在上海注册生物科技公司。根据公开信息,莫德纳在中国新注册的公司名为美德纳(中国)生物科技有限公司,注册资本1亿美元,由Moderna英国公司控股,注册地为上海闵行区。该公司经营范围包含技术服务、技术开发、技术咨询、技术交流、技术转让、技术推广;医学研究和试验发展(除人体干细胞、基因诊断与治疗技术开发应用);货物进出口与技术进出口。
国际药讯
1.创新TCR-T疗法滑膜肉瘤Ⅱ期临床积极。Adaptimmune公司靶向MAGE-A4抗原的TCR-T产品afami-cel将在ASCO2023年会上公布用于晚期滑膜肉瘤或粘液样/圆形细胞脂肪肉瘤(MRCLS)患者的Ⅱ期试验SPEARHEAD-1(NCT04044768)队列1数据。中位随访为27.8个月时,滑膜肉瘤患者的总体缓解率(ORR)约为39%;中位反应持续时间约为12个月。12个月OS概率为90%,24个月OS概率为70%。该公司预计将于2023年中完成afami-cel的上市申请。
2.首款自体TIL疗法获FDA加速审评资格。Iovance公司肿瘤浸润淋巴细胞(TIL)疗法Lifileucel的生物制剂许可申请(BLA)获FDA受理,用于治疗晚期黑色素瘤患者。FDA同时授予其优先审评资格,PDUFA日期为今年11月25日。在II期C-144-01研究中,Lifileucel在这类难治性患者中的客观缓解率(ORR)达到31.4%;有41.7%的缓解持续时间≥18个月;中位总生存期(OS)和无进展生存期分别为13.9个月和4.1个月。Lifileucel有望成为首款获FDA批准用于这类患者的全新的治疗方法。
3.SERD乳腺癌Ⅲ期临床最新数据积极。Menarini旗下公司Stemline在ASCO2023年会上公布选择性雌激素受体降解剂(SERD)艾拉司群(Orserdu)用于治疗转移性乳腺癌的Ⅲ期临床EMERALD最新数据。一项新的事后分组数据显示,接受SOC内分泌单药治疗(氟维司琼、来曲唑、阿那曲唑、依西美坦)六个月内病情进展的患者,使用艾拉司群治疗实现了5.32个月的中位PFS,而使用SOC这一数值仅有1.87个月。安全数据与先前报告的结果一致。
4.CHMP建议撤市诺华镰状细胞病药物。欧洲药品管理局人用药品委员会(CHMP)建议撤销诺华开发的P-选择素抑制剂Adakveo(crizanlizumab)用于镰状细胞病(SCD)患者预防复发性血管阻塞性危象(VOC)或疼痛危象的有条件上市许可。在III期STAND(NCT03814746)研究中,Adakveo(5.0mg/kg和7.5mg/kg)较安慰剂均未能降低VOC的发生率。P-选择素是一种在血管内皮细胞和血小板表面发现的蛋白质,参与血栓形成或镰刀细胞病相关疼痛危象。
5.新型CAR-T治疗DIPG脑瘤临床前研究积极。澳大利亚沃尔特和伊丽莎-霍尔医学研究所(WEHI)等联合研究团队开发的靶向HER2的CAR-T细胞疗法,在用于靶向治疗弥漫内生型脑桥胶质瘤(DIPG)的临床前研究中获得积极结果。在DIPG肿瘤模型中,这些经过特别设计的CAR-T细胞能够进入大脑,并通过减少肿瘤负荷而产生抗癌效果。相关研究成果日前发表在Neuro-Oncology Advances期刊上。
6.细胞和基因治疗公司Elevate完成D轮融资。生物技术公司ElevateBio宣布完成4.01亿美元D轮融资。本轮融资由AyurMaya Capital Management Fund领投,Woodline、Lee Family Office、诺和诺德跟投等。本轮融资将用于进一步推进其基因编辑、RNA、载体工程、蛋白质和诱导多能干细胞技术平台建设,继续扩大基因和细胞治疗端到端cGMP生产制造和工艺开发业务规模。过去一年,ElevateBio已与Moderna和诺和诺德等超过15家生物制药达成合作。
医药热点
1.上海卫健系统最新任免。上海市政府近日发布一组人事任免信息,其中,任命胡鸿毅为上海市保健委员会办公室主任、上海市保健局局长,免去其上海市中医药管理局副局长职务;任命付晨为上海市卫健委副主任,免去其上海市疾病预防控制中心主任职务。任命陈昕为上海市疾病预防控制中心主任。
2.2023年基本公卫补助资金达725亿多元。近日,财政部会同国家卫健委下达2023年基本公共卫生服务补助资金约109亿元,加上已提前下达的补助资金约616.1亿元,合计下达补助资金约725.1亿元。2023年基本公共卫生服务补助资金支出方向包括0~6岁儿童、孕产妇、老年人、慢性病患者等重点人群健康管理,中医药健康管理,居民健康档案管理,健康教育,预防接种服务,地方病防治,职业病防治,农村妇女“两癌”(宫颈癌和乳腺癌)检查和孕前优生健康检查等。
3.英国国民保健署被曝与脸书共享患者数据。据英国《卫报》网站5月27日报道,在未经患者同意的情况下,英国国民保健署(NHS)下属的多个综合医疗集团一直与脸书网站共享患者的医疗状况、预约和治疗情况等信息。这些数据包括浏览的页面、点击的按键和搜索的关键词等细节。这些数据会匹配以用户的IP地址,而且在许多情况下还会与他们脸书账号的细节相匹配。目前,英国信息监管局正在调查此事。
评审动态
1. CDE新药受理情况(05月30日)
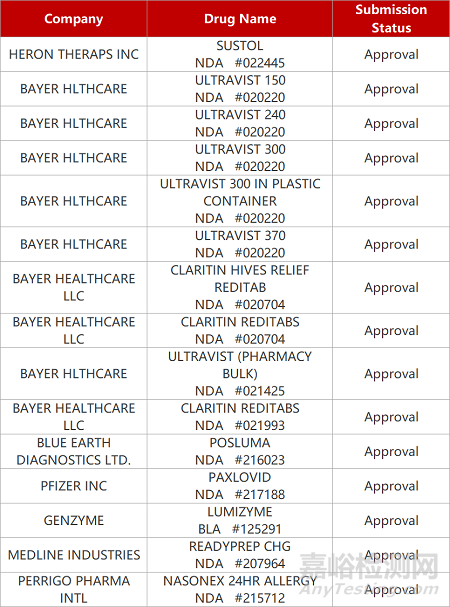
2. FDA新药获批情况(北美05月26日)