大出血和伤口感染是导致在战场上、日常生活中死亡的关键原因。常见的止血敷料由于吸血过量而导致不必要的失血量。同时,细菌感染很大程度上延缓了伤口愈合的进程。因此,开发高性能的止血材料在医学上具有重要的应用意义。
近日,暨南大学刘明贤教授课题组通过定向冷冻干燥技术和非对称性设计,整合埃洛石纳米管(HNTs)、壳聚糖(CS)和胶原蛋白(CO)制备具有快速有效止血性能、抑菌性、生物相容性的止血敷料(CS1N1-1‰CO)。该研究成果以“Engineering Design of Asymmetric Halloysite/Chitosan/Collagen Sponge with Hydrophobic Coating for High-Performance Hemostasis Dressing”为题发表在国际学术期刊International Journal of Biological Macromolecules(影响因子8.025, 中科院一区)杂志上。该论文以暨南大学化学与材料学院2021级硕士研究生林晓莹为第一作者,刘明贤教授为唯一通讯作者。
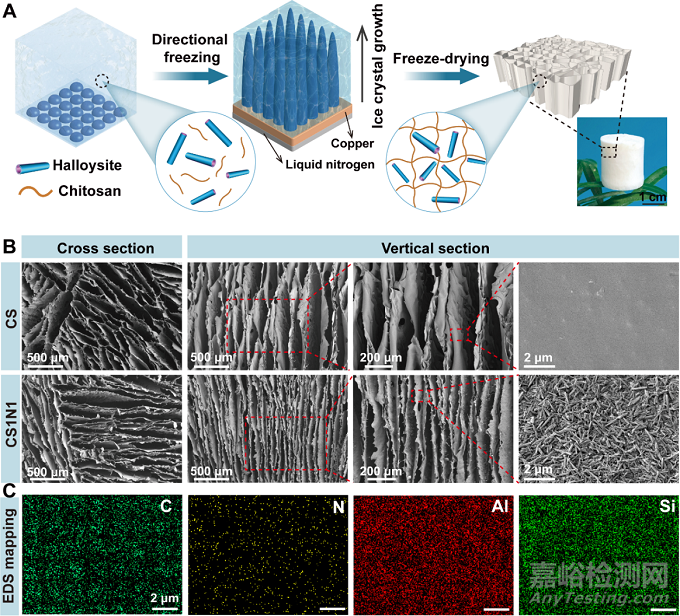
壳聚糖/胶原/埃洛石复合海绵是通过溶液共混-冷冻干燥法制备,制备流程图如图1A所示。将埃洛石和壳聚糖混合液置于模具中进行定向冷冻,液氮作为冷源,提供自下而上的温度梯度来定向冷冻悬浮液。冰晶沿着冰冻方向生长,埃洛石和壳聚糖被挤到冰晶之间的界面以实现固液分离。最后通过冷冻干燥,冰晶通过升华变为气体,留下轴向高度取向的多孔结构(图1B)。SEM图也可以看出,埃洛石均匀分布在壳聚糖中。图1C中,HNTs特有的Al和Si元素均匀分布也说明了这一点。
图1 定向冷冻干燥法制备埃洛石/壳聚糖复合海绵的流程图和CS和CS1N1的横截面和纵切面SEM图。
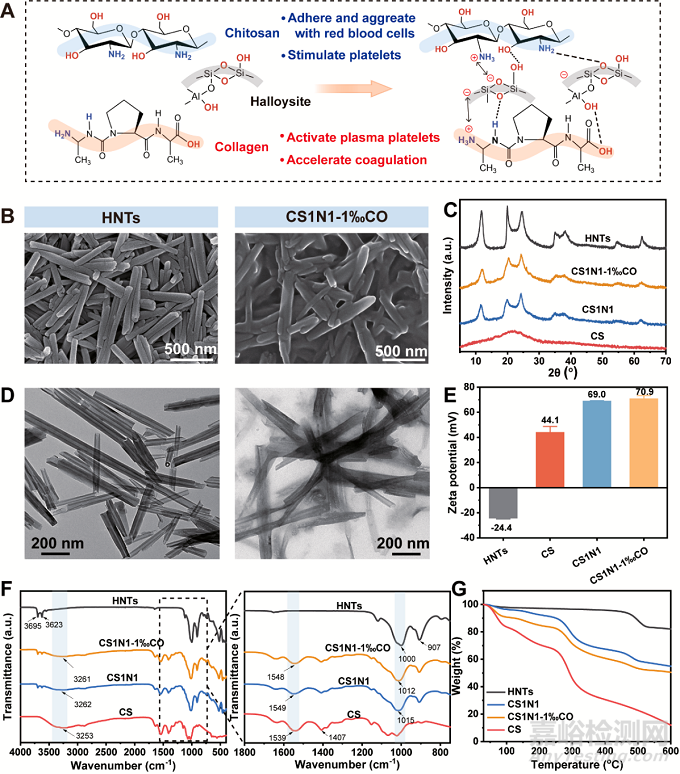
图2A 展示了埃洛石、壳聚糖、胶原蛋白相互作用的机理。壳聚糖和胶原蛋白上含有氨基和羟基,能与埃洛石上的铝羟基和硅羟基发生氢键作用。壳聚糖和胶原蛋白带正电与带负电的埃洛石发生静电吸引,使得他们之间具有良好的界面相互作用。图2B的SEM 和图2D的TEM直观地展示了埃洛石、壳聚糖、胶原蛋白三者相互作用的结果。纯的埃洛石是中空的管状结构,边缘清晰可见,而复合海绵中埃洛石表面包覆了一层有机层,使管边缘变得模糊。这表明埃洛石和高分子接触时,壳聚糖和胶原蛋白能够吸附于埃洛石的外表面。另外,XRD、FTIR、ζ电位也证实了这一点。
图2 埃洛石、壳聚糖和胶原蛋白的相互作用机制和表征。
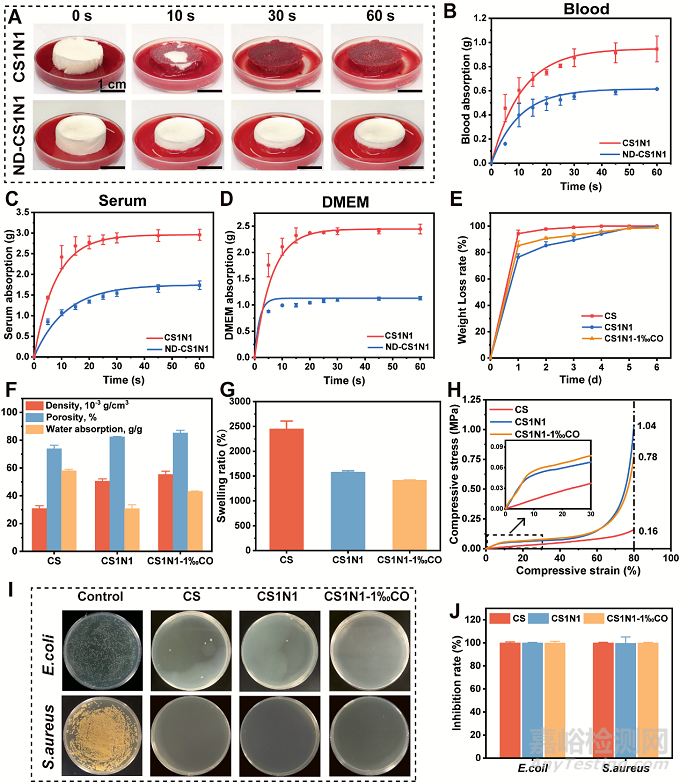
为了比较定向与非定向冷冻干燥海绵吸收液体速率及吸收量,相同体积的海绵分别吸收了全血、血清、细胞培养基。图3A可以看出,定向冷冻干燥的海绵在10 s时已经吸收了大部分血液,30 s时吸收基本完毕。不管吸收何种溶液,定向海绵表现出较大的吸收量和较快的吸收速率。这得益于定向冷冻技术赋予了海绵轴向有序、规则的孔隙通道,使海绵具有更高效的液体传输速率,这有助于在伤口大量出血时快速吸血。图3F比较了CS, CS1N1 and CS1N1-1‰CO的密度、孔隙率和吸水能力,埃洛石的加入提高了壳聚糖海绵的密度和孔隙率。孔隙率是止血敷料的一项基本性能,具有高孔隙率的海绵具有较大的表面积,有利于血红细胞的黏附和富集。同时,孔隙互联能够提供氧气和营养,为细胞提供良好的生理环境,有利于伤口保持在潮湿的环境中,并促进细胞增殖和伤口愈合。CS1N1-1‰CO敷料具有生物可降解性(图3E)和抑菌性(图3I),对金黄色葡萄球菌和大肠杆菌表现出高达99%的抑菌率(图3J),有助于减少伤口相关并发症以防止伤口受外部细菌感染,从而达到更好的止血和伤口愈合。
图3 定向埃洛石/壳聚糖/胶原蛋白的性能。
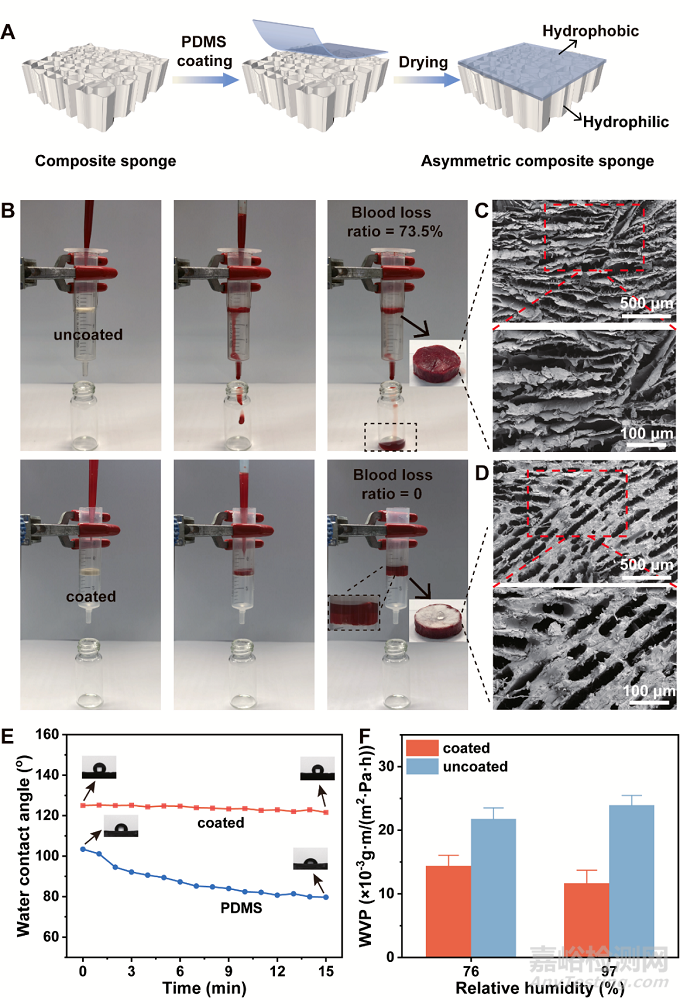
图4A 展示了非对称性海绵的制备过程,通过在海绵的一面涂布一层PDMS,达到非对称性的效果。为了测试PDMS疏水层对血液的阻隔情况,未涂布PDMS的海绵血液流失量达到73.5%,而非对称性的海绵在吸血饱和后能在较长的一段时间内兜住血液不让其往下流。图4E疏水面水接触角在15 min内仅从122.4o降低到109.4o,也证实了疏水面的疏水稳定性。同时,涂布PDMS的海绵仍保持一些孔隙(图4D),维持了止血敷料的透气性。因此,PDMS涂层既能防止血液的反渗透,阻挡外界物质通过孔道进入伤口,降低伤口受感染的风险,还能维持止血敷料的透气性,创面的空气流通还可以促进凝血因子、血小板、纤维蛋白的聚集从而达到凝血。
图4 非对称性复合海绵的结构和性能。
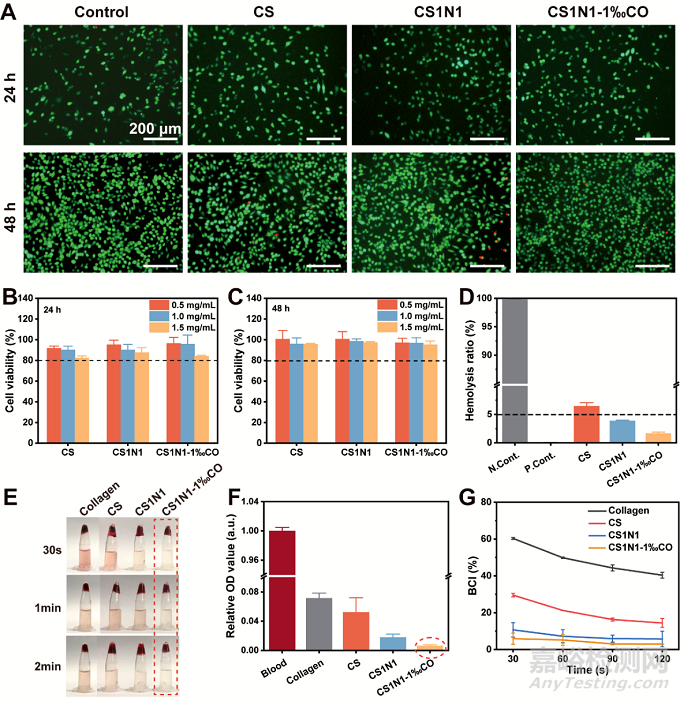
作为与伤口直接接触的材料,良好的生物安全性和细胞相容性是必不可少的。采用L929细胞(小鼠成纤维细胞)测定细胞相容性。用AM/PI进行荧光染色,如图5A所示,梭形细胞均匀分布,如图5B,在不同浓度的海绵浸提液的培养基共培养24 h和48 h,采用CCK-8检测试剂盒检测细胞活力,各组细胞活力均超过80%。图5D中,复合海绵溶血度均低于5%,具有较好的血液相容性。图5E凝血行为和图5G凝血指数(BCI)表明CS1N1-1‰CO海绵具有较好的凝血性能。
图5非对称性海绵的细胞相容性和止血性能。
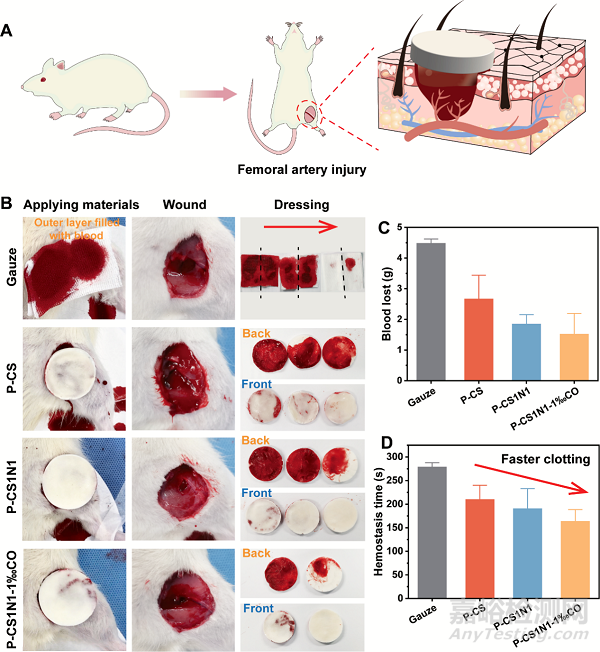
为了评估P-CS1N1-1‰CO海绵的止血性能,作者采用了SD大鼠股动脉损伤模型。图6B中,血液能迅速渗透到纱布的外层,而非对称性的海绵血液没有渗透出来,外部的疏水层几乎是干净的。利用定向冷冻干燥方法赋予海绵轴向有序的孔道结构快速吸收血液,而疏水层能防止血液润湿或过度渗透,达到促进血液凝固,减少失血量的效果。失血量和凝血时间都是令人满意的,尤其是CS1N1-1‰CO。P-CS, P-CS1N1, and P-CS1N1-1‰CO敷料的失血量分别为4.49 ± 0.14 g, 2.67 ± 0.77 g, 1.85 ± 0.30 g, and 1.52 ± 0.68 g (图6C),凝血时间分别为 279 ± 9 s, 210 ± 30 s, 190.5 ± 42.5 s, and 164 ± 24.54 s(图6D)。
图6 敷料对大鼠股动脉损伤的止血性能。
总之,该工作开发并证明了一种基于壳聚糖的非对称疏水性和定向冷冻干燥技术的具有快速凝血和防止血液反渗透的伤口止血敷料的设计策略。具有疏水涂层的不对称伤口敷料显示出高效止血能力、生物相容性和抗菌性能,在伤口愈合中具有广阔的应用前景。
该研究得到了国家自然科学基金(52073121)、广东省自然科学基金(2019A1515011509)、广州市科技计划(202102010117)、中央高校基础研究基金(21622406)、佛山国家高新技术产业开发区产业化创业团队计划项目组(2220197000129)、广东省重点领域R&D计划(2022B1111080007)、广州市重点领域研发计划(202103030003)的资助。
论文链接:https://www.sciencedirect.com/science/article/pii/S0141813023010425