亚硝胺杂质一直是各大医药监管机构近些年来高度关注的话题,他们加大了对制药公司和CDMO在亚硝胺检测和风险评估方面的监管力度,导致了多个品种的药品召回事件。
1、欧洲药典委员会修订涉及亚硝胺杂质的2034和2619通论
日前欧洲药典 (Ph. Eur.) 委员会 (EPC, European Pharmacopoeia Commission) 在第 174 届会议上通过了修订后的通论 2034 和 2619,其中包括一段解释 Ph. Eur对于亚硝胺杂质的控制方法。
通论2034的药用物质Substances for pharmaceutical use,在“生产”下增加了一段关于 N-亚硝胺的内容:“由于许多 N-亚硝胺被归类为可能的人类致癌物,因此负责制造人类药物活性物质的制造商,需要评估在整个制造过程和储存过程中 N-亚硝胺形成和污染的潜在风险。一旦风险得到确认,制造商应尽可能减少 N-亚硝胺的产生,例如通过修改制造工艺来实现,并应实施合理有效的控制策略,来检测和控制这些杂质。制造商可以参照通用章节 2.5.42 :活性物质中的 N-亚硝胺。”
Pharmaceutical preparations (通论2619) 在亚硝胺的章节中增加了关于 N-亚硝胺的类似段落:“由于许多 N-亚硝胺被归类为可能的人类致癌物,除了仅供兽医使用的产品和未经许可的药物制剂外,医药产品(medicinal products)制造商应评估在其整个生产过程和保质期中,N-亚硝胺形成和污染的潜在风险。如果风险得到确认,制造商应尽可能减少 N-亚硝胺的存在,例如通过修改制造工艺,并且必须实施控制策略来检测和控制这些杂质。制造商可以参照通用章节 2.5.42 :活性物质中的 N-亚硝胺”。
2、欧洲药典关于亚硝胺杂质分析的2.5.42通则
欧洲药典委员会设定的关于亚硝胺杂质分析的2.5.42通则,应被视为一个分析工具箱,它提出了三种分析亚硝胺杂质的手段(GC-MS、LC-MS/MS 和 GC-MS/MS)。重要的是包括使用不同仪器,满足欧洲及其他地区许多质量控制实验室的不同需求。
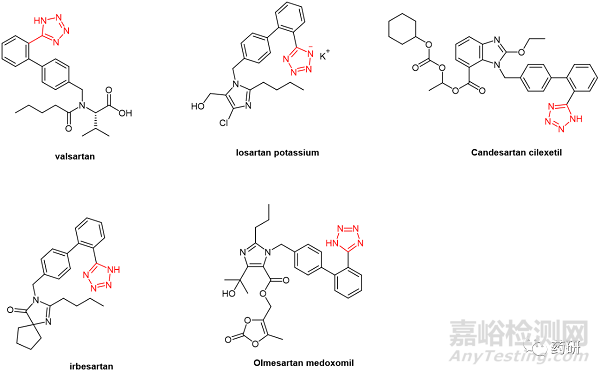
这些分析程序已针对所列亚硝胺物质进行了验证,作为目标浓度为 30 ppb 的限度测试(limit test,程序 A 和 B),或作为定量测试(quantitative test,程序 C,GC-MS/MS)。该通则主要针对分析含有四唑基团的血管紧张素-II-受体拮抗剂(angiotensin-II-receptor antagonists,沙坦类药物)中的 N-亚硝胺杂质,该类药物有 5 个 Ph. Eur. 专著(缬沙坦、氯沙坦钾、坎地沙坦酯、厄贝沙坦和奥美沙坦酯,图1)。 除了这5种沙坦类药物之外,其它的药物可在额外的分析方法验证之后,在证明预期目的的适用性条件下,通过以上的分析方法进行相关的亚硝胺杂质检测。
图1. 需要亚硝胺分析的五类沙坦类药物分子结构
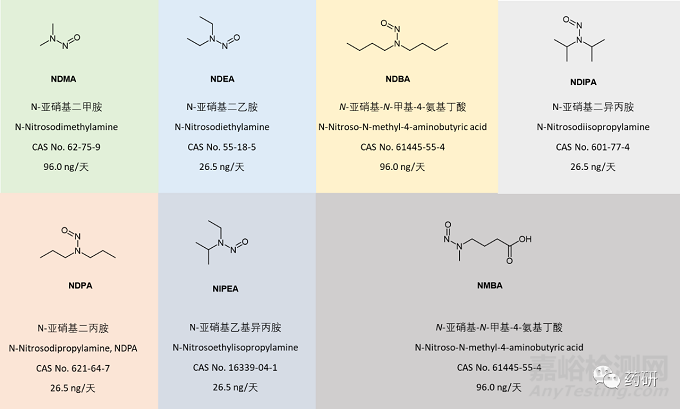
以上的三种分析方法针对了七种N-亚硝胺杂质(图2):N-亚硝基二甲胺(NDMA)、N-亚硝基二乙胺(NDEA)、N-亚硝基二丁胺(NDBA)、N-亚硝基-N-甲基-4- 氨基丁酸 (NMBA)、N-亚硝基二异丙胺 (NDiPA)、N-亚硝基乙基异丙胺 (NEiPA) 和 N-亚硝基二丙胺 (NDPA)。
图2. 欧洲药典规定的7种受检亚硝酸杂质
为支持新通过的关于活性物质中 N-亚硝胺杂质分析的通则(2.5.42)的实施,已经建立了图2中描述的七种参考标准品,可从欧洲理事会药品和医疗保健质量 (EDQM,European Directorate for the Quality of Medicines & HealthCare) 获取。
欧洲药典委员会设定的关于亚硝胺杂质分析的2.5.42通则,是在几个官方药物控制实验室 (OMCL) 的帮助下创建的。该通则并未提供用于测试 N-亚硝胺杂质的分析程序的详尽清单。根据亚硝胺杂质分析的困难程度以及测试需求,其它的分析手段可能会更适合,但需要经过分析手段的验证过程。
鉴于亚硝胺杂质在全球使用的药物中被广泛发现,Ph. Eur和 USP 将致力于趋同,以确保其公共质量标准保持一致。