今日头条
徐诺HDAC抑制剂获批胶质瘤临床。徐诺药业口服泛HDAC抑制剂艾贝司他获FDA批准开展Ⅰ期临床试验,拟联合替莫唑胺(TMZ)用于治疗复发性胶质瘤患者。在单药三线治疗复发难治滤泡性淋巴瘤的中国Ⅱ期临床中,艾贝司他达到70%的客观缓解率,疾病控制率为93%。目前该新药正在全球开展多项临床试验,涉及适应症包括肾细胞癌和非霍奇金淋巴瘤。
国内药讯
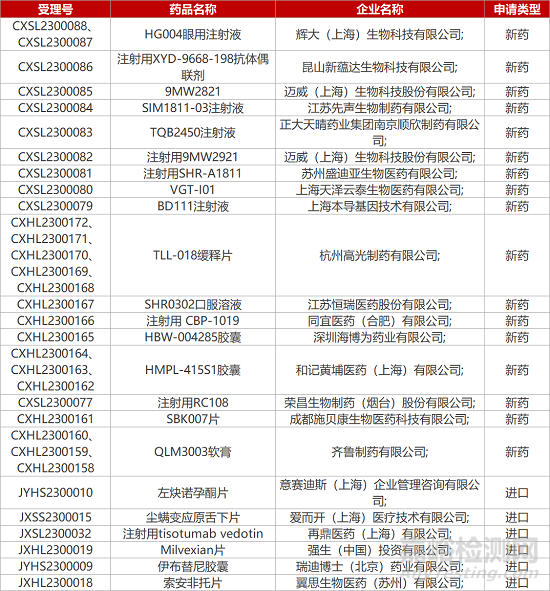
1.ALK公司创新过敏疗法在华报产。ALK公司3.1类新药尘螨变应原舌下片(Acarizax)获国家药监局批准上市。这是一款过敏原特异性免疫治疗(AIT)产品,能诱导机体对变应原建立免疫耐受,可使过敏症状得到长期缓解。2023年1月,该新药已获准在海南乐城国际医疗旅游先行区的博鳌超级医院用于临床急需,用于治疗12-65岁患有持续性中重度尘螨过敏性鼻炎,以及18-65岁患有尘螨过敏性哮喘的患者。
2.英矽智能IPF新药获FDA孤儿药资格。英矽智能开发的潜在“First-in-class”小分子抑制剂INS018_055获FDA授予的孤儿药资格,拟开发用于治疗特发性肺纤维化(IPF)。该新药在新西兰和中国开展的Ⅰ期临床已于2022年底完成最后1例受试者随访,数据显示该候选药物具有良好的安全性、耐受性和药代动力学特征。英矽智能计划在2023年早期在中国率先开展INS018_055的Ⅱ期临床试验。
3.复宏汉霖EGFR单抗早期临床积极。复宏汉霖改良型全人源化重组抗EGFR单抗HLX07用于治疗晚期实体瘤的Ib/II期临床结果积极。该项研究探索HLX07与不同化疗方案(吉西他滨及顺铂;紫杉醇及卡铂;以及mFOLFOX6方案)联合治疗时的安全性和最大耐受剂量(MTD)。试验结果显示,临床中无药物相关的剂量限制毒性(DLT)事件发生,HLX07与不同化疗方案联合的MTD未达到。
4.亘喜双靶点CAR-T在美获批临床。亘喜生物靶向BCMA/CD19双靶点自体CAR-T产品GC012F获FDA批准,即将在美国针对复发/难治性多发性骨髓瘤(R/R MM)开展Ⅰb/Ⅱ期临床。公布于ASH 2022年会上的中国Ⅰ期临床长期随访数据显示,GC012F达到100%的总体应答率(ORR),100%受试者达到微小残留病灶(MRD)阴性。2021年11月,FDA已授予该新药孤儿药资格,用于治疗多发性骨髓瘤。
5.上海本导基因编辑药物报IND。本导基因公司的基因编辑药物“BD111注射液”的新药临床试验申请获CDE受理。这是一款基于BDmRNA递送专利技术开发的基因编辑治疗产品,具有一次性注射治愈病毒性角膜炎的潜力。去年7月,该公司宣布BD111在治疗疱疹病毒型角膜炎的临床试验中获得有效性和初步的安全性结果,并获得FDA授予孤儿药资格认定。
国际药讯
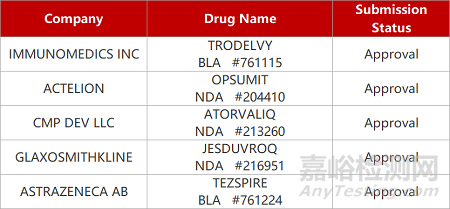
1.吉利德TROP2靶向ADC获批新适应症。吉利德科学TROP2靶向ADC新药Trodelvy(sacituzumab govitecan)获FDA批准新适应症,用于治疗接受过多种前期治疗的转移性HR+/HER2-乳腺癌。在Ⅲ期临床TROPiCS-02中,Trodelvy较化疗使患者的疾病进展或死亡的风险下降34%(中位PFS:5.5个月vs4个月,p=0.0003),使患者的死亡风险下降21%。此前,FDA已批准Trodelvy二线治疗转移性三阴性乳腺癌(TNBC)和二线治疗转移性膀胱癌。
2.辉瑞CDK4/6抑制剂获批新适应症。辉瑞CDK4/6抑制剂重磅乳腺癌疗法Ibrance(palbociclib)获FDA批准扩大适用人群,联合芳香酶抑制剂(AI)用于治疗HR+/HER2-的转移性乳腺癌,无论患者是否已停经。在Ⅲ期PALOMA-3临床中,Ibrance与激素药物fulvestrant组合疗法较安慰剂显著延长患者的无进展生存期(中位PFS:9.5个月vs4.6个月)。在HR+/HER2-转移性乳腺癌患者群体中,停经前与围绝经妇女占比约为17%。
3.TSLP单抗家用预充笔获批上市。FDA批准阿斯利康Tezspire(tezepelumab)预充式注射笔上市,用于治疗12岁及以上重度哮喘患者居家自行注射。2021年12月,tezepelumab注射液首次在美国获批上市,用于作为12岁及以上的重度哮喘患者的附加维持治疗方案,是一款first in class的人源化TSLP靶向单抗。在临床试验中,tezepelumab通过小瓶-注射液(V-S)、一次性预充式注射液(PFS)和预充式注射笔(AI)这三种设备类型用药的药代动力学(PK)暴露量相当。
4.K药联合化疗子宫内膜癌Ⅲ期临床积极。默沙东PD-1抑制剂Keytruda(pembrolizumab)联合化疗治疗III、IV期或复发性子宫内膜癌的Ⅲ期试验(NRG-GY018)达到主要终点。与安慰剂和化疗组合相比,Keytruda组合疗法显著改善患者的无进展生存期(PFS),无论患者携带错配修复缺陷(dMMR)或错配修复正常(pMMR)的肿瘤。Keytruda的安全性亦与已知研究一致。
5.Ionis/GSK启动乙肝新药III期临床。葛兰素史克与Ionis公司联合开发的反义寡核苷酸(ASO)新药bepirovirsen日前启动两项用于治疗慢性乙肝(CHB)的III期临床(B-Well 1和B-Well 2)试验。Bepirovirsen靶向所有乙型肝炎病毒(HBV)信使RNA,可降低病毒蛋白水平,旨在功能性治愈乙肝。在IIb期B-Clear研究中,有28%~29%的患者在接受bepirovirsen治疗24周后检测不到病毒水平。
6.Purple Biotech收购三特异性抗体药物公司。Purple Biotech公司宣布收购多特异性抗体药物研发公司Immunorizon。Immunorizon的主要产品是条件激活的三特异性抗体,能够衔接T细胞和NK细胞,在肿瘤微环境中产生强烈的局部免疫反应。根据协议,Purple Biotech将收购Immunorizon全部的股票(100%),其他长期研发、监管和销售里程碑的总金额为9400万美元,累计交易付款(不包括预付款)将不超过1亿美元。
医药热点
1.安徽整合口腔种植类医疗服务价格项目。安徽省医保局规范整合全省口腔种植类医疗服务价格项目,日前重新制定出安徽省省属三级公立医疗机构口腔种植医疗服务项目政府指导价,并将于3月1日起执行。规范整合后,安徽省新增15个口腔种植类医疗服务价格项目,停用17个涉及口腔种植的专科项目。据悉,单颗常规种植牙全流程医疗服务及药品总费用不超过4280元。
2.北京严禁超范围开展新冠相关实验。北京市卫健委日前就进一步做好新冠病毒实验室生物安全管理工作发出通知。通知要求,在北京行政区域内从事新冠病毒培养、动物感染实验、核酸检测等实验活动,需经国家卫健委或北京市卫健委批复后方可开展,且应严格遵照国家和北京市新冠病毒实验室生物安全管理相关规定,严禁超范围开展实验活动。
3.恒瑞公布新一届领导班子名单。2月2日,恒瑞医药召开第九届董事会第一次会议并对提名及聘任的公司高级管理人员进行公布。董事会选举孙飘扬先生为第九届董事会董事长。经提名,聘任戴洪斌先生为公司总经理,聘任刘笑含女士为公司董事会秘书,聘任张连山、江宁军、孙杰平、蒋素梅、沈亚平、王洪森、廖成、王泉人、贺峰、张燕为公司副总经理,聘任刘健俊先生为公司财务总监。
评审动态
1. CDE新药受理情况(02月04日)
2. FDA新药获批情况(北美02月03日)