摘 要 Abstract
我国确立了基于风险启动药品注册核查检验的模式,2021 年12 月国家药品监督管理局药品审评中心发布《药品注册核查检验启动工作程序(试行)》,进一步明确核查检验具体程序。本文从监管要求、外部协作管理及申办者内控制度三个维度出发,结合研究机构/ 研究者合规、第三方服务机构合规、临床数据合规及人类遗传资源合规,探讨临床研究中的合规难题,以期为我国医药企业临床研究合规管理提供借鉴。
China initiated a risk-based model on examination and inspection of drug registration. Tentative Procedures on Examination and Inspection of Drug Registration promulgated by Centre for Drug Evaluation ("CDE") under National Medical Products Administration ("NMPA") in December 2021 intended to standardize detailed procedures on examination and inspection of drug registration. This paper aims to probe into critical compliance issues in clinical studies from the perspectives of regulatory requirement, external cooperation management and sponsor's internal control system by highlighting some key compliance considerations for investigators / institutions, third-party service providers, clinical data security and human genetic resources, in an effort to shed some light on compliance management of clinical studies by biotech, biopharma and pharmaceutical companies.
关键词 Key words
临床研究;合规管理;数据合规;人类遗传资源管理;合规体系建设
clinical study; compliance management; data compliance; human genetic resources management; compliance management systems
临床研究分工细致、法律关系复杂。申办者(指负责临床研究的发起、管理和提供临床研究经费的个人、组织或者机构)作为临床研究质量最终责任人面临越来越多的合规难题。申办者应如何建立临床研究合规管理体系?如何妥善管理各临床研究参与方?如何开展临床数据合规管理?如何精准把握人类遗传资源监管要求?本文将针对以上合规难题,结合境外临床研究合规实践,探讨相关解决路径,以期为我国医药企业临床研究合规管理提供借鉴。
一、临床合规管理体系
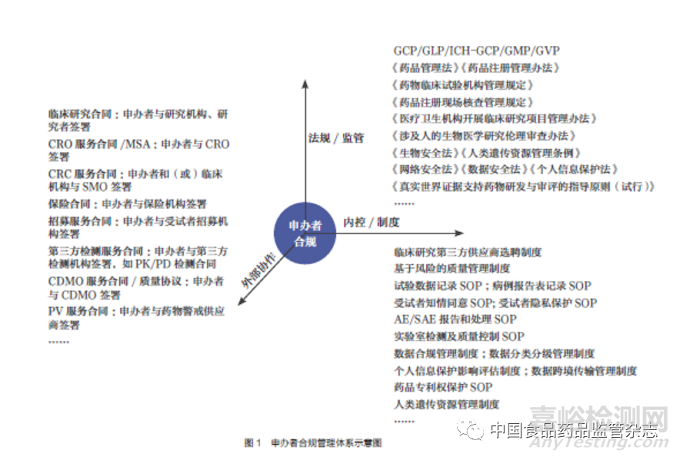
申办者作为临床研究数据质量和可靠性的最终责任人[1],需要在遵循监管要求的基础上,充分协调并管理外部协作资源,不断建立并完善内控制度。笔者建议可从三个维度对临床研究进行合规管理,以完善合规管理体系,如图1 所示。
(一)监管要求
《药品管理法》《药品注册管理办法》《药物临床试验质量管理规范》(GCP)等法规是我国临床研究监管的主要依据,立法和监管部门还就研究机构、伦理审查、数据核查与数据安全、人类遗传资源管理等发布了相关法律法规和规范性文件,并开展基于风险的现场核查。因此,申办者应根据监管法规动态和现场核查要求,及时调整合规管理体系,严格依法开展临床研究。
(二)外协管理
临床研究涉及面广,申办者一般需要外部服务机构协助完成相关工作。申办者应建立第三方服务机构筛选、合同管理等合规制度,选择合格的第三方服务机构并与其签署权责明确的合同,以监督其履行职责。
(三)内控制度
为规范临床研究合规开展,申办者可在企业内部建立相关的内控制度,并要求各参与方在临床研究开展过程中遵守相关的内控要求。
二、临床参与方合规管理
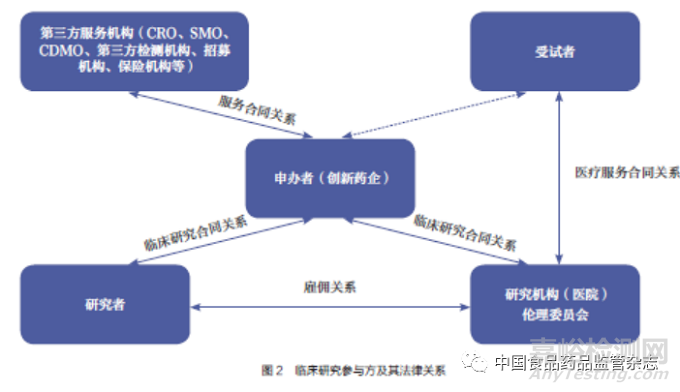
临床研究涉及多方参与,包括但不限于申办者、医疗机构/ 研究者、受试者、合同研究组织(contract research organization,CRO)、现场管理组织(site management organization,SMO)、第三方检测机构、保险公司、招募机构等。对于申办者而言,与其他参与方签署权责明确的合同并有效开展参与方合规管理,是关乎临床研究最终质量的重要问题。临床研究各参与方及其法律关系如图2 所示。
(一)研究机构/ 研究者合规管理
申办者如何选择合适的研究机构和研究者、避免利益冲突、签署权责明确的临床研究合同、有效管理研究机构和研究者履行职责,是开展临床研究需要重点关注的合规问题。
1. 资质和内控制度核查
根据GCP 和相关法律规定,研究机构和研究者应具备并维持与开展临床研究有关的资质要求,并完成备案。申办者在临床研究开始前可核查研究机构和研究者是否具备相关资质,并在“药物临床试验机构备案管理信息平台” [2] 确认研究机构、拟开展临床研究所在科室和专业及主要研究者(principal investigator,PI)是否已完成备案。
根据GCP 要求,临床研究的实施应当遵守利益冲突回避原则;根据《公立医院内部控制管理办法》相关规定[3],公立医疗机构应当建立临床研究相关内部控制制度。申办者可在临床研究开始前要求研究机构提供相关内控制度并核查其是否履行,包括但不限于临床研究利益冲突政策、临床研究运行管理制度、临床研究立项审批和审查制度、临床研究经费使用管理制度以及临床研究档案管理制度等,以判断研究机构是否在内控层面满足相关法律法规和临床研究实施要求。
2. 合同管理
申办者需要与研究机构及主要研究者签署权责明确的合同,可在合同中重点关注以下内容:①主要研究者的签字确认。②各方应当避免的、可能的利益冲突要求。③研究者的职责,如熟知研究方案、做好知情同意、及时完善病例报告表等。④发生不良事件时研究机构/ 研究者的救助和报告义务、受试者权益保护内容。⑤数据记录和报告程序。⑥申办者的监查和稽查、药品监督管理部门的检查可直接去到试验现场,查阅源数据、源文件和报告。⑦研究经费合理且符合市场规律,建议明确每例受试者相关治疗费、检查费、补偿费等费用标准,并合理设计支付节点;对于筛选失败、失访和脱落病例也建议约定结算方法。⑧必备文件保存时间、费用和到期后的处理方法。⑨研究用药物的储存、分发、使用、返还等规定。⑩受试者个人信息保护措施和要求。⑪生物样本检测要求。⑫临床数据所有权及其他研究成果(包括探索性研究)的知识产权归属和对外发表文章的要求。⑬各方的违约责任及免责情形。⑭合同终止情形、终止程序和工作交接、对受试者的处理、报告要求。⑮反腐败反商业贿赂要求等。
申办者需要在合同中平衡各方利益,为临床研究的合规开展预设相关的要求和标准,并对合同履行实施监督。
3. 监查和稽查
监查是申办者对临床研究进行质量控制的方法之一。在GCP要求的常规监查内容外,为确保研究机构/ 研究者合规开展临床研究,笔者认为申办者在监查过程中还可额外关注以下内容:①是否遵守研究方案和合同约定开展临床研究。②研究者文件夹文件资料是否完整、实时更新、准确。③知情同意过程是否有记录,是否按照研究方案及相关法规要求进行。④知情同意书和受试者鉴认代码表签署时间是否存在逻辑关系、签字字迹是否一致。⑤登录医院信息系统,核查是否按规定要求进行受试者访视。⑥安全性数据及记录,确认有无严重不良事件发生。⑦记录前后的一致性,有无矛盾或遗漏,记录是否准确、充分。⑧实验室检查结果,尤其是异常结果的记录和反馈情况。⑨研究用药物的相关使用记录情况等。
除监查外,申办者还可选定独立于临床研究的人员担任稽查员,依据稽查计划和规程对临床研究相关活动和文件进行稽查。
通过监查和稽查,申办者可以掌握研究机构/ 研究者实施临床研究的具体情况,发现任何问题时可要求研究机构/ 研究者及时进行整改,防止影响临床研究质量。
4. 境外研究机构/ 研究者合规管理
在国际多中心临床研究(multi-regional clinical trial,MRCT)中,申办者还需要关注不同国家和地区对于研究机构/研究者的合规要求。以美国为例,美国食品药品监督管理局(Food and Drug Administration,FDA) 要求申办者应公开临床研究信息,实施公众监督,即符合要求的药物临床研究必须在美国国立卫生研究院建立的网站[4]上进行注册,填报规定的基本信息,否则申办者将受到重罚。对于研究机构/ 研究者,FDA 要求其应具备相关资质,研究者需要接受过临床研究相关培训,严格按照美国GCP 要求开展研究[5]。FDA 还会不定期发布针对研究者的警告信,告诫研究者在临床研究中的不合规之处,也使相关整改更具有针对性。
根据近年来FDA 针对研究者的警告信内容,FDA 对于研究者的监管要求主要包括[6] :①能否按照计划进行研究。②能否全面准确记录数据。③能否获取/ 记录受试者同意。④能否妥善落实药品管理。⑤能否将更改通知伦理委员会、提交进度报告、监督或亲自进行临床研究。⑥能否妥善保护受试者权益。⑦是否获得或记录伦理委员会的批准。⑧能否报告药物不良反应。⑨能否报告临床研究结果等。
我国申办者在涉及美国的多中心临床研究中,可重点关注研究者能否履行上述合规要求,以保证临床研究质量。
(二)临床服务机构合规管理
根据GCP 第三十三条规定,申办者可以将其临床研究的部分或者全部工作和任务委托给合同研究组织,监督合同研究组织承担的各项工作。实践中,除合同研究组织外, 申办者还可能委托现场管理组织委派临床研究协调员(clinical research coordinator,CRC) 为研究者提供相关服务、委托招募机构进行受试者招募、委托第三方检测机构对生物样本进行检测等。涉及国际多中心临床研究时,申办者也可能委托境外的服务机构履行相关工作。
申办者如何选择合适的第三方服务机构、与其签署权责明确的合同、监督和管理其履行职责是必须要解决的合规难题。本文从合同研究组织、现场管理组织、招募机构、检测机构为切入点,探讨上述合规问题的解决路径。
1. 合同研究组织
(1)尽职调查。申办者在选聘合同研究组织之前可以对其进行尽职调查,了解其基本信息、相关业务资质、服务报价、既往服务案例、内控制度及执行情况(如反腐败反商业贿赂制度、临床研究项目管理制度、商业秘密和知识产权保护制度等),综合对比后选择合适的合同研究组织。申办者还可以建立合同研究组织的筛选制度,明确相关的招投标机制,防止因选聘合同研究组织过程中的商业贿赂问题最终影响临床研究质量。
(2) 合同管理。合同研究组织通过与申办者签署的服务合同参与到临床研究中,若合同条款约定不明、权责划分不清,很可能在实践中产生纠纷,影响临床研究进度。因此,申办者需要在合同中明确双方的权责,并可重点关注以下几点内容:①申办者委托的具体工作以及相应的标准操作规程。②项目人员和资源配备情况、人员更换流程、双方沟通层级和频率。③合理设计费用支付节点、支付要求和支付比例,明确代垫费用范畴及支付流程,明确备用金金额、使用流程和结算制度(如需)。④明确受试者个人信息保护和数据安全要求。⑤明确记录、报告和监管协助要求。⑥明确知识产权的归属情况。⑦明确合同终止情形、单方终止权利的安排、终止后受试者安排和工作移交程序等。⑧明确违约责任承担主体和范围及免责事项;明确对第三方供应商的监督或管理责任及相关的违约责任安排。⑨明确质量控制和保证具体要求,明确申办者的监查和稽查以及审计权利。⑩可以要求合同研究组织签署廉洁承诺函,争取合规风险隔离等。
在国际多中心临床研究中,申办者可将临床研究相关工作委托给业务领域能够覆盖多中心的合同研究组织,并与其签署权责明确的合同。在此类合同中,申办者除需要关注以上所列内容外,还需要关注不同地区对于临床研究监管的特殊要求并注意适用法律的选择。
2. 现场管理组织
在我国临床研究中,申办者通常会聘请第三方独立的现场管理组织,并由其派遣合格的临床研究协调员协助研究者进行临床研究中非医学判断的事务性和规范性工作。在选聘现场管理组织之前,申办者应充分考虑研究机构和研究者的意见。申办者可与研究机构、现场管理组织签署三方合同,明确各方的权利义务;在得到研究机构和研究者同意的前提下,申办者也可直接与现场管理组织签署相关合同。申办者在与现场管理组织签署的合同中可以明确以下内容:①现场管理组织及其委派的临床研究协调员资质要求。②临床研究协调员的委派和更换程序。③临床研究协调员的工作内容和汇报要求,要特别注意其不得从事涉及医学判断的事务和工作。④现场管理组织与临床研究协调员的雇佣关系。⑤患者健康信息、医疗信息和其他个人信息保护要求。⑥付款计划与受试者入组和访视进度相协调。⑦ 保密和知识产权归属。⑧违约责任和救济措施等。
成熟市场的现场管理组织服务方式更加多元化。例如美国的现场管理组织可以凭借其临床信息资源网络和专业经验,加速研究机构和研究者的选择及资格评估、合同谈判和研究启动等过程, 帮助申办者提高效率。对于研究机构而言, 现场管理组织可以为其拓展业务,帮助其进入全球研究者网络,使研究机构有更多机会参与国际多中心临床研究。现场管理组织还可以参与研究方案的可行性分析、递交伦理委员会申请、实施受试者招募和知情同意、收集并记录数据、参与临床研究现场标准操作规程制定、参与研究者和研究人员培训工作等[7]。在开展国际多中心临床研究时,申办者也可以选择境外专业现场管理组织, 提供更多元化服务,提高临床研究效率。
3. 招募机构
传统受试者招募方式(如研究者现场招募、通过招募广告等途径公开招募)可能存在受试者招募数量不足、入组进度缓慢等情况,由此催生了商业性招募机构的发展。商业性招募机构实际上提供的是信息中介服务,由招募机构将潜在受试者信息推荐给研究者,最终根据推荐数量或推荐成功数量,由申办者支付招募机构相应费用。在这种招募模式中,如何确保招募信息来源的合规性、如何保证招募过程中受试者个人信息保护、如何防止招募机构与研究者或受试者间的商业贿赂等问题,是商业性招募的合规痛点问题。在国际多中心临床研究中,申办者还面临境外招募受试者的问题。本文基于申办者视角,尝试性地探讨上述痛点问题的解决路径。
(1)招募信息来源合规性问题。招募机构在获取潜在受试者个人信息过程中,要特别注意受试者个人隐私保护问题。招募机构不应在未获得个人知情同意的前提下,直接接触潜在受试者个人身份信息、医疗信息等隐私信息。在通过潜在受试者主治医生获得受试者个人信息前,不应由主治医生同意就直接获取受试者个人信息,而应由主治医生询问潜在受试者个人意愿,在潜在受试者愿意了解临床研究相关信息且签署知情同意书后,招募机构才可以获取潜在受试者个人信息;在通过检测实验室或其他数据库数据识别潜在受试者前,应在获得潜在受试者知情同意后才可将个人信息提供给招募机构。招募机构将潜在受试者的个人信息推荐给研究者前,均应获得潜在受试者知情同意。
(2)受试者隐私保护和反商业贿赂。申办者在与招募机构签署的合同中可对受试者隐私保护和商业贿赂问题进行约定,并保留申办者对招募机构履约行为进行监督和审计的权利。建议申办者可在相关合同中明确以下几点内容:①招募机构承诺遵守受试者隐私保护和反商业贿赂相关法规政策,并约定相关的违约责任。②招募机构不得参与一切与受试者招募有关的医学判断。③招募机构提供的服务不得超出经伦理委员会批准的研究方案及招募信息/ 广告的范围。④招募机构不得未经个人知情同意即接触和披露个人隐私信息。⑤招募机构不得实施任何行为影响潜在受试者意愿或使受试者退出。⑥招募机构不得向任何受试者/ 潜在受试者收取任何费用或回报等。⑦申办者对招募机构的监督和审计权利等。
在国际多中心临床研究中,需要招募不同国家和地区的受试者,因此申办者也需要了解其他国家和地区临床研究中受试者招募方式。以美国为例,其在受试者招募中一般采取多种招募方式以加快招募速度,如在各类媒体上发布各种类型的招募广告、开展针对公众的招募宣传活动、利用研究机构及现场管理组织进行招募、通过患者组织(patient organizations)进行招募等。此外,FDA 在国际多中心临床研究中越来越关注对于引起地区差异等潜在因素的研究和分析的重要性[8]。因此,对于开展国际多中心临床研究的申办者而言,需要特别关注不同区域和人种的受试者招募,在符合各个地区相关法律法规的前提下通过多种方式招募受试者。
4. 检测机构
(1)尽职调查。临床研究中若涉及生物标志物、基因测序、药物代谢动力学、药效动力学等检测项目,申办者可能会委托第三方检测机构来进行检测。申办者在选聘检测机构之前,可对检测机构进行尽职调查,了解检测机构的基本信息、既往服务案例、内部的质量保证和控制制度、隐私保护政策及相关的运行情况,以及是否取得相关资质[ 如中国合格评定国家认可委员会(ChinaNational Accreditation Service for Conformity Assessment,CNAS) 关于ISO 15189 质量管理体系的认可、美国病理学家协会(College of AmericanPathologists,CAP)、《美国临床实验室改进法案修正案》(clinical laboratory improvement amendments,CLIA)的认证等]。申办者还应当在知情同意书中明确告知受试者采集的样本类型、检测项目和用途、第三方检测机构等信息,并就受试者的生物样本第三方检测获得受试者知情同意。
(2)合同管理。申办者应与检测机构签署权责明确的合同,并可在合同中明确以下内容:①样本的采集和运输要求以及样本损毁的责任承担。②样本类型、例数、检测技术、检测结果交付、剩余样本处理、数据保存等要求。③检测费用组成、支付节点及付款条件。④检测机构配合药品监管部门检查的义务。⑤检测工作成果的知识产权归属等。
在国际多中心临床研究中,若涉及质控样本的交叉验证,申办者可选择业务能够覆盖国际多中心的检测机构,以使交叉验证能够顺利进行并保证检测方法的一致性。若涉及人类遗传资源材料出入境和海关进出口,申办者还应根据人类遗传资源管理的相关法规完成相关审批或备案程序、按照海关管理的相关法规完成海关进出口手续等。
三、申办者内控制度建设
除针对临床参与方的合规管理外,申办者还需要建立完善的内部临床研究合规管理制度体系,以覆盖临床研究的全生命周期。这些制度包括但不限于数据合规管理制度、人类遗传资源管理制度、第三方服务机构选聘制度、质量管理与质量保证制度等。申办者可基于管理制度制定相关的标准操作规程,如试验数据记录、受试者知情同意、不良事件及严重不良事件报告和处理、实验室检测及质量控制等标准操作规程。本文通过节选临床数据合规和人类遗传资源管理的相关内容,探讨申办者应如何建立相关的合规管理制度。
(一)临床研究数据合规管理
临床研究数据是评估药物安全性、有效性的关键考量因素。如何降低数据合规风险并提高数据质量、如何解决国际多中心临床研究数据分享等数据合规问题,是申办者亟需解决的问题。
1. 数据合规监管体系
临床研究数据合规监管体系以《药品管理法》《生物安全法》《网络安全法》《数据安全法》《个人信息保护法》等一般药品管理、生物安全、网络安全、数据安全、个人信息保护法律为基础,以GCP、《人类遗传资源管理条例》《人口健康信息管理办法(试行)》《国家健康医疗大数据标准、安全和服务管理办法(试行)》和GB/T 39725-2020《信息安全技术 健康医疗数据安全指南》等医药医疗与生命科学领域数据管理的单行法规、条例、国家标准和指南为具体规则,涉及国家市场监督管理总局、科学技术部、工业和信息化部等监管部门。申办者应在了解数据合规监管体系的基础上,进一步完善数据合规管理制度。
2. 数据合规常见问题
申办者是药品注册的申请者和权利人,对临床研究数据可靠性承担法律责任。药品监管机构开展的临床研究数据核查工作反映了诸多数据合规问题,申办者可以在了解相关的合规问题后“有的放矢”,建立有效的合规管理体系。常见的数据合规问题主要包括:①编造或者无合理解释地修改受试者信息以及研究数据、研究记录、研究药物信息。②隐瞒研究数据,无合理解释地弃用研究数据,以其他方式违反研究方案选择性使用的研究数据。③瞒报与临床研究用药相关或可能相关的严重不良事件。④故意损毁、隐匿临床研究数据或者数据存储介质。⑤受试者的筛选/ 入组相关数据链缺乏完整性。⑥知情同意书的签署内容不完整、不规范,签署数量与总结报告中的筛选和入选病例数不一致。⑦临床研究过程记录及临床检查、化验等数据不真实且无法溯源。⑧电子数据的修改、转换、编辑未留痕且不可追溯。⑨临床研究的生物样本采集、保存、运送与交接记录无法保证完整性和真实性。⑩研究用药物的管理过程记录缺乏完整性和原始性等。
3. 国际多中心临床研究数据合规
国际多中心临床研究的数据合规主要涉及数据出境及域外认可问题。
对于数据出境,需要在数据合规监管体系下,根据数据的不同属性适用不同的监管法规要求。如涉及重要数据、10 万人个人信息或者1 万人敏感个人信息等情况,需要按照相关法律法规的要求进行数据出境安全评估;涉及人类遗传资源的数据,应履行相关的信息备份和备案程序;如涉及人口健康信息的,跨境传输将被禁止。
对于数据域外认可, 根据《接受药品境外临床试验数据的技术指导原则》的要求, 若境外临床研究数据真实可靠、符合ICH- GCP 和药品注册检查要求、支持目标适应症的有效性和安全性评价、不存在影响有效性和安全性的种族敏感性因素等,则可被国家药品监管部门完全接受。根据美国2012 年《FDA安全和创新法案》(Food and Drug Administration Safety and Innovation Act,FDASIA) 的规定以及FDA 网站公布的接受境外药品临床研究数据的指引,若数据能够被FDA 验证、具有有能力的研究者、根据美国GCP 的规定进行且适用于美国公民及医疗实践等,则可被FDA 接受[9]。
近期,美国曾质询过我国制药企业使用在我国进行的/ 主要在我国进行的临床研究数据来提交新药申请,其从侧面反映我国制药企业走出国门仍面临诸多困难。对于要成为全球化的制药企业而言,更需要密切关注不同区域临床数据合规要求和域外认可标准,建立并完善数据合规管理制度,合规开展国际多中心临床研究。
4. 数据合规管理制度建设
为了使临床研究数据合法合规收集、使用,申办者可以建立相关的数据合规管理制度,重点可关注以下内容:①建立数据管理相关人员的责任、资质及培训制度,明确申办者、研究者、监查员、数据管理员、合同研究组织的责任,并进行定期评估及考核。②建立临床研究数据管理系统,包括质量手册、程序文件、作业指导书、质量记录等,并确保数据的可溯源性。③建立数据标准化体系,为申办者之间的交流、申办者与药物评审机构之间的交流及各临床研究的药物安全性数据共享提供便利。④建立数据质量的保障及评估制度,包括数据核查制度、数据质疑流程、数据修改流程、数据盲态审核等。⑤建立安全性数据及严重不良事件报告制度,包括为确保严重不良事件数据的一致性而对临床研究数据库与药物警戒数据库的一致性核查等。
除以上数据管理制度外,临床研究中所收集、存储、使用的数据信息还可能涉及个人隐私信息、健康医疗大数据、人类遗传资源信息或人口健康信息。这些数据的存储和传输都有特定的法规要求。申办者需要结合具体实践情况,综合考虑数据合规监管体系的各项具体要求,合法合规地收集、存储和使用临床研究中的各项数据。
(二)人类遗传资源合规管理
临床研究通常需要采集人体血液、脑脊液、细胞等生物样本,可能涉及人类遗传资源,需要履行人类遗传资源相关的审批或备案程序。实践中,如何认定“外方单位”,如何合规开展国际合作科学研究,以及如何在企业内部建立人类遗传资源合规管理制度,是申办者面临的合规难题。
1. 外方单位认定
《人类遗传资源管理条例》(以下简称《条例》)中明确规定,外方单位是指外国组织及外国组织、个人设立或者实际控制的机构。《人类遗传资源管理条例实施细则(征求意见稿)》(以下简称《实施细则》)第十二条对于“实际控制”一词限定为四种情形,对于外方单位的认定更偏向于从实质层面上认定境外组织、个人是否足以对机构的决策、管理等重大事项施加重大影响,而不是单纯从形式层面上以股权占比作为认定标准。但《实施细则》对于“设立”尚未进一步细化解释。
关于外方单位的认定,在目前的实际操作中,任何向上追溯含有外资成分的企业都可能会被中国人类遗传资源管理办公室(以下简称遗传办)认定为外方单位,且通过协议控制方式被控制的境内运营实体也会被认定为外方单位。但是基于《实施细则》中对“实际控制”认定标准作出的进一步限定,未来实操中认定外方单位的标准可能会发生变化,申办者需要密切关注《实施细则》的更新发布情况,以进一步判断企业在人类遗传资源监管体系下的性质。
2. 国际合作科学研究合规管理
国际合作科学研究是目前含有外资成分的申办者利用我国人类遗传资源开展临床研究的可行途径,需要申办者了解国际合作科学研究的审批/ 备案要求、国际合作科学研究的知识产权归属及人类遗传资源信息对外提供等问题。
(1)审批/ 备案要求。利用我国人类遗传资源开展国际合作科学研究的,应当由中方单位和外方单位共同提出申请并经遗传办批准。为获得相关药品在我国上市许可,在临床机构利用我国人类遗传资源开展国际合作科学研究、不涉及人类遗传资源材料出境的, 不需要审批。但是,合作双方在开展临床试验前应当将拟使用的人类遗传资源种类、数量及其用途向遗传办备案。对于研究者发起的临床研究(investigator initiated trial,IIT)而言,若涉及利用人类遗传资源的,也需要履行相关审批和备案程序。但实践中外方单位开展的IIT 在遗传办审批中可能会遇到较大阻碍。
(2)知识产权归属。《条例》规定,利用我国人类遗传资源开展国际合作科学研究,产生的成果申请专利的,应当由中方单位和外方单位共同提出申请,专利权归合作双方共有。实践中,遗传办特别关注探索性研究的知识产权共有问题。若申办者为外方单位,其与中方单位签署的合同中应明确探索性研究的知识产权由合作双方共享。
(3)信息对外提供。《条例》规定,将人类遗传资源信息向外方单位提供或者开放使用的,应当向遗传办备案并提交信息备份。根据《人类遗传资源管理常见问题解答(系列问答二)》中的官方答复,利用我国人类遗传资源开展国际合作科学研究所产生的人类遗传资源信息,合作双方可以使用,不需进行数据信息对外提供备案。参加合作的其他外方单位如要使用相关研究数据,则应由合作双方中的中方数据信息所有者申请数据信息对外提供或开放使用备案。另外,申办者需注意,若针对临床研究成果发表文章涉及开放使用人类遗传资源信息的,应在信息出境前进行信息备份和备案。
3. 人类遗传资源合规管理制度建设
由于人类遗传资源监管要求的复杂性,常会影响临床研究的整体进度,因此申办者有必要在内部建立人类遗传资源合规管理制度,以高效管理人类遗传资源,推进临床研究项目进度。申办者可根据企业性质,按照以下“三步法”来搭建人类遗传资源合规管理制度。
第一,业务梳理与评估。首先判断企业以及业务合作方的主体性质,是中方单位还是外方单位;其次,梳理目前开展的所有业务类型,明确哪些业务涉及人类遗传资源和涉及的环节(如人类遗传资源采集、保藏、利用等);最后,对业务进行风险等级评估,按照人类遗传资源不同的监管要求进行高、中、低风险划分。
第二,内部管理体系搭建。根据企业管理架构,明确负责人类遗传资源管理工作的部门及承担的职责,并根据不同的业务风险等级划分,确定相应的审批部门并制定相应的审批流程。
第三,体系化管理制度建设。根据业务情况,制定人类遗传资源活动审批/ 备案、业务活动风险等级划分、不同风险等级业务审批流程、内部稽查和自查、外部监督检查应对等标准操作规程。还可以在标准操作规程基础上制定体系化管理文件,以有效反映人类遗传资源管理情况,如人类遗传资源申请批准进度及问题跟踪表、人类遗传资源批件到期更新表、人类遗传资源总结报告递交进度及问题跟踪表、数据备份备案进度及问题跟踪表、自查及质量事件报告进展及问题跟踪表、内部稽查发现及整改计划进展跟踪表、监管机构核查发现及整改计划进展跟踪表等。
申办者在人类遗传资源合规管理制度建设过程中,应及时关注人类遗传资源相关法律法规和监管部门官方问答的更新情况,并据此调整合规管理制度和体系化管理文件内容。
四、结语
目前,我国临床研究正处于高速发展阶段,相关法律法规正根据实践情况在不断完善,监管部门对于临床研究也提出了越来越高的合规要求。由于临床研究各参与方合规意识存在不足,并且临床研究涉及的研究机构、数据安全、人类遗传资源等又分属不同的监管部门,所以不同监管部门的联合执法、合规宣传及培训显得特别重要。申办者作为临床研究数据质量和可靠性的最终责任人,应结合实际情况和法律法规要求,选择合适的临床研究参与方并对其进行监督管理,遵守数据合规和人类遗传资源合规要求,建立体系化的临床研究合规管理制度,使临床研究合法合规开展,加快研究药物上市进度,造福广大患者。