您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-12-14 15:15
根据产品功能和预期用途,体外膜肺氧合医疗器械可以分为体外膜肺氧合设备(简称ECMO设备)和体外膜肺氧合器具(简称ECMO器具)。
本文适用于ECMO设备,产品适用范围相似的其他医疗器械,亦可参考本文内容。
参照《医疗器械分类目录》,ECMO设备属于子目录“10-输血、透析和体外循环器械”中的“一级产品类别05-心肺转流设备”,具体涉及三个二级产品类别:01-心肺转流用泵、02-心肺转流监测设备、04-体外心肺支持辅助系统。
心肺转流泵(分类编码10-05-01):此类产品可以实现“人工心”的作用,临床配合其他体外循环设备和器具使用,在手术或抢救过程中暂时替代患者心脏功能进行体外循环或局部灌注,按照第三类医疗器械进行管理。
心肺转流监测设备(分类编码10-05-02):此类产品可以用于连续监测动脉、静脉血气参数(氧饱和度值、氧分压值、二氧化碳分压值、pH值、温度值等),按照第三类医疗器械进行管理。此类产品也可以仅用于体外循环手术过程中测量血液的压力、温度等,按照第二类医疗器械进行管理。
体外心肺支持辅助系统(分类编码10-05-04):此类产品一般为心肺转流泵、心肺转流监测装置、心肺转流控制装置的组合产品,临床预期与配套耗材联合使用,可以在体外循环手术、长时间心肺功能支持或急救过程中,暂时替代患者心/肺功能,按照第三类医疗器械进行管理。
心肺转流泵是体外循环设备的核心部件,按照技术类型可以主要分为两类:滚压泵和离心泵。目前在中国已经批准上市的ECMO设备均采用了离心泵技术。
滚压泵:此类产品一般由滚压式血泵、监测系统、底座、支架等组成,通常采用挤压泵管的方式驱动血液流动,长时间使用可能累积较大的血液损伤。滚压泵常见于人工心肺机产品,主要用于心肺旁路(Cardiopulmonary bypass, CPB)手术期间提供体外循环支持,其持续工作时间一般小于6小时,不属于通常意义所指的ECMO设备范畴。
离心泵:此类产品一般由泵头连接器、泵驱动模块、紧急驱动装置、流量传感器等组成,需要配合离心泵泵头使用。离心泵通过驱动泵头内的转子/叶轮转动,为血液循环提供动力。离心泵一般为模块化设计,可以独立使用,也可外接适配的控制和监测设备联合使用。
一、ECMO设备工作原理及结构组成
ECMO设备配套离心泵泵头、体外循环管路、氧合器、空氧混合器、滤器、热交换水箱等医疗器械,可以为患者提供安全、有效的心肺支持辅助治疗。
ECMO设备一般由系统控制模块、泵驱动模块、监测模块、紧急驱动装置、推车、附件等组成。
ECMO设备主要工作原理包括持续工作时长、血流驱动方式、血泵最高转速等方面。
1.持续工作时长
1.1、短时程心肺转流
此类产品通常称为“人工心肺机”,一般心肺转流时间小于6小时,临床适用于心肺旁路手术期间为患者血液循环提供机械支持,属于体外循环的一种短时程应用形式。例如:心脏手术过程中,暂时停止心脏跳动,通过人工心肺机维持患者身体器官和组织的灌注。
目前,采用滚压泵作为核心部件的心肺转流设备一般属于人工心肺机产品,某些人工心肺机也采用了离心泵技术。
人工心肺机此类仅具有“短时程心肺转流”功能的产品,不属于通常意义所指的ECMO设备范畴。
1.2、长时程心肺转流
ECMO设备具有长时程心肺转流的产品功能,一般心肺转流时间大于24小时,临床适用于为心肺功能障碍患者的血液循环提供机械支持,例如:急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、心肺器官移植等。
ECMO设备配套氧合器等相关耗材构成了ECMO系统,能够同时提供血液循环辅助和呼吸辅助等功能。ECMO系统通过将患者静脉血液引流至体外循环回路,进行氧合和二氧化碳清除,再回输患者体内,实现了部分或近似全部的血气交换、血液循环功能。
2.血流驱动方式
2.1、离心恒流式
血泵输出流量保持在预设的恒定值,血流波形呈现为平流模式。
2.2、离心搏动式
血泵输出的血流波形具有搏动特征,在一定程度上模拟了人体正常血流模式。
3.血泵最高转速
3.1、低速型
离心泵的最高转速< 6000 r/min 。
3.2、高速型
离心泵的最高转速≥ 6000 r/min 。
二、ECMO设备相关适用标准
ECMO设备相关适用标准
|
标准编号 |
标准名称 |
|
GB 9706.1 |
医用电气设备 第1部分:基本安全和基本性能的通用要求 |
|
GB 9706.15 |
医用电气设备 第1-1部分:安全通用要求 并列标准:医用电气系统安全要求 |
|
GB/T 14710 |
医用电器环境要求及试验方法 |
|
YY 9706.102 |
医用电气设备 第1-2部分:基本安全和基本性能的通用要求 并列标准:电磁兼容要求和试验 |
|
或 |
或 |
|
YY 0505 |
医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验 |
|
YY 9706.108 |
医用电气设备 第1-8部分:基本安全和基本性能的通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南 |
|
或 |
或 |
|
YY 0709 |
医用电气设备 第1-8部分:安全通用要求 并列标准 医用电气设备和医用电气系统中报警系统的测试和指南 |
|
YY 9706.112 |
医用电气设备 第1-12部分:基本安全和基本性能的通用要求 并列标准:预期在紧急医疗服务环境中使用的医用电气设备和医用电气系统的要求 |
|
YY 1412 |
心肺转流系统 离心泵 |
|
YY 0781 |
血压传感器 |
|
YY 9706.234 |
医用电气设备 第2-34部分:有创血压监测设备的基本安全和基本性能专用要求 |
|
或 |
或 |
|
YY 0783 |
医用电气设备 第2-34部分:有创血压监测设备的安全和基本性能专用要求 |
|
YY/T 0316 |
医疗器械 风险管理对医疗器械的应用 |
|
YY/T 1145 |
人工心肺机术语 |
三、ECMO设备性能研究实验要求
ECMO设备性能指标条款可以参照YY 1412的相关要求,结合产品特征进行制定。开发人需要依据产品实际应用情况,在性能指标条款中列明相关参数的具体数值,例如:范围、误差等。此外,需要考虑符合以下标准要求:
电气安全:GB 9706.1。
电磁兼容:YY 9706.102或YY 0505。
报警系统:YY 9706.108或YY 0709。
其他(若适用):YY 0781、YY 9706.234、YY 9706.112,以及选配件、附件的相关适用标准。
ECMO设备主要性能指标存在较大差异,难以合理选择典型性产品型号,一般宜划分为不同的单元。
例如:流量控制、转速控制、温度控制、压力监测、报警限值等关键指标存在重大差异。
1、化学和物理性能研究、电气系统安全性研究
开发人应对产品应用模式、运行模式、产品配置等,开展相应的测试验证。
需要重点关注技术缺陷、故障、误操作等相关的不良事件。
2、软件研究
可依据《医疗器械软件注册审查指导原则》,进行软件研究。软件研究需要覆盖全部软件组件。
ECMO设备属于高风险医疗器械,包含了涉及血泵驱动、监测、控制等可能导致患者死亡或严重伤害的软件组件,其软件安全性级别应定义为严重(C)级。
核心算法可以参考下表示例:
核心算法示例
|
算法名称 |
类型 |
预期用途 |
临床功能 |
|---|---|---|---|
|
泵速控制算法 |
成熟 |
对泵速进行控制,调节流量 |
功能A… |
|
反馈调节算法 |
全新 |
利用传感信号反馈,实时调节泵速 |
功能B… |
|
氧合器效能评估算法 |
全新 |
基于跨膜压差、流量、血氧等数据信息,评估氧合器功能 |
功能C… |
|
患者状态评估算法 |
全新 |
基于生理监测数值,对患者生理状态进行定量/定性评估 |
功能D… |
|
… |
… |
… |
… |
开发人需要明确软件完整版本的全部字段和字段含义,并确定软件完整版本和发布版本。
开发人可以参照《医疗器械网络安全注册审查指导原则》开展网络安全研究。
若ECMO系统各部件/组件之间采用了无线通讯技术,开发人应明确保证无线通讯质量的措施,以确保系统的安全性和有效性;必要的无线通讯安全措施;与其他无线通讯设备的共存问题,以及相关风险缓解措施。
3、生物学特性研究
一般而言,ECMO设备与患者不直接接触。若适用,开发人可以依据GB16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》的方法,开展生物学评价研究。
4、清洁和消毒研究
4.1、使用者清洁和消毒
开发人应确定推荐的消毒周期、消毒方式、消毒剂的型号和供应商等。若适用,建议说明不同的消毒剂的消毒效果并开展相关研究。
4.2、残留毒性
若清洁、消毒方法可能出现残留,开发人需要开展残留物毒性的相关研究。
5、动物试验研究
开发人应对ECMO设备是否需要开展动物试验研究进行科学决策,进行相关论证。动物试验研究应确定试验目的、实验用动物信息、受试器械和对照信息、动物数量、评价指标和试验结果、动物试验设计要素的依据等内容,建议参考相关动物试验指导原则。
ECMO设备动物试验目的是通过活体动物的在体试验来获得产品安全性和有效性的数据,对设计定型的产品进行临床前确认。对于新研制的ECMO设备,建议在人体临床试验前开展动物试验。
对于已经上市应用于临床或已经完成动物试验确认的产品发生设计变更时,经过对变更部分与产品整体关系的评价后,可能会对产品重新进行动物试验;或只针对产品变更部分进行动物试验;若有充分证据表明,通过台架试验等方式,已经可以验证产品变更部分的安全性和有效性,则不必再进行动物试验。
6、稳定性研究
6.1、使用稳定性
开发人可以依据《有源医疗器械使用期限注册技术审查指导原则》,进行产品使用期限的研究。开发人应考虑在正常条件和不利条件下对产品进行分析。
6.2、运输稳定性
开发人需要开展运输稳定性和包装研究,证明在规定的运输条件下,运输过程中的环境条件不会对医疗器械的造成不利影响。
开发人可以参考GB/T 14710等相关标准进行研究。
7、其他研究(专题研究)
7.1、产品电池的研究
若适用,建议开发人开展产品电池的评价研究,可以参考本指导原则的附录III。
关于电池的持续工作时间,一般需要考虑的主要影响因素包括:离心泵转速、离心泵流量、电池寿命和充电状态等。若适用,开发人需要确定在特定条件下的电池预计剩余工作时间的估算方法。
7.1.1、电池类型
按照是否可重复使用,产品电池一般可以分为两种类型:
ECMO设备电池一般采用可充电电池,通常为多块电池构成的电池组形态,并考虑了备用电池的需求。开发人需要结合ECMO设备的实际配置情况,对电池或电池组开展评价研究。
7.1.2、可充电电池和电池组的要求
可充电电池的性能和寿命是产品评价研究需要考量的重要内容。开发人开展评价工作时,建议关注电池的工作条件和要求,例如:场景、温度、电流损耗、充电/放电规程等。若开发人通过测试进行评价,则测试报告一般至少需要包括:试验方案、验收标准、试验结果。
7.1.2.1、电池标称值
一般包括:尺寸规格、电池类型、标准电压、容量(安培小时)、包装、连接方法、充电能力等。
7.1.2.2、电池寿命循环试验
测试电池的有效充电和放电循环次数。
7.1.2.3、电池温度试验
测试电池安全工作的温度范围。例如:电池可用容量(%)vs. 工作温度。
7.1.2.4、电池放电特性试验
一般包括:电池可用容量vs. 放电速率;电池电压vs. 放电速率;电池电压vs. 放电时间(小时,低速率);电池电压vs. 放电时间(小时,高速率)。
7.1.2.5、单个电池和电池组的合格性试验
验证单个电池及其构成的电池组的最终电压和安培小时数,确认是否符合要求。
7.1.2.6、电池功能性试验
电池及其联合使用的医疗器械需要进行完整的功能性试验(例如:外部电源中断时,内部电池可以为离心泵提供动力,驱动其正常运行)。若存在与其他电池或电池组联合使用的情况,同样需要考虑开展功能性试验。
7.1.2.7、电池维护
明确电池维护信息,确保电池寿命和医疗器械的正常使用。明确电池充电/放电的具体要求,包括:允许/禁止充电的情况、充电/放电的操作流程等。
例如:某些电池在充电操作之前,要求先对其进行完全放电操作,所以在电池未用尽所有电量的情况下,可能需要提示用户禁止进行电池充电操作。
7.1.3、其他
根据产品设计和临床使用条件,建议开发人可以证明电池安全的第三方认证信息,以及满足下列标准的验证资料:
GB 31241-2014,《便携式电子产品锂离子电池盒电池组安全要求》
IEC 62133:2013,《含碱性或其它非酸性电解液的蓄电池和蓄电池组-便携式密封蓄电池和蓄电池组的安全要求》
UN38.3,联合国关于危险品运输的建议、手册及试验标准,第6次修订版。
7.2、患者转运的研究
ECMO设备的使用可能涉及紧急医疗环境,以及不同类型的交通运输工具,建议开发人开展必要的环境试验、电磁兼容试验等产品评价研究。若适用,可供参考的国际标准如下表:
|
IEC 60601系列 |
|
|
IEC 80601-2-49: 2018 (IEC 60601-2-49: 2011) |
Medical electrical equipment - Part 2-49: Particular requirements for the basic safety and essential performance of multifunction patient monitors |
|
PREN 50447: 2004 |
Active implantable medical devices - Particular requirements for Heart-Lung Machines (HLM) |
|
救护车辆及其设备的要求 |
|
|
EN 1789: 2007 + A2 2014 |
Medical vehicles and their equipment - Road ambulances |
|
救护飞机及其设备的要求 |
|
|
EN 13718-1: 2020-10 |
Medical vehicles and their equipment -Air ambulances - Part 1: Requirements for medical devices used in air ambulances |
|
环境试验 |
|
|
EN ISO 11201: 2009 |
Acoustics - Noise emitted by machinery and equipment - Measurement of emission sound pressure levels |
|
IEC 60529: 1989 + AMD1: 1999 +AMD2: 2013 CSV |
Degrees of protection provided by enclosures (IP Code) |
|
IEC TR 60721-4-2: 2001 + AMD1: 2003 CSV |
Classification of environmental conditions - Part 4-2: Guidance for the correlation and transformation of environmental condition classes of IEC 60721-3 to the environmental tests of IEC 60068 - Transportation |
|
IEC 60068-2-6: 2007 |
Environmental testing - Part 2-6: Tests - Test Fc: Vibration (sinusoidal) |
|
IEC 60068-2-27: 2008 |
Environmental testing - Part 2-27: Tests - Test Ea and guidance: Shock |
|
IEC 60068-2-31: 2008 |
Environmental testing - Part 2-31: Tests - Test Ec: Rough handling shocks, primarily for equipment-type specimens |
|
IEC 60068-2-64: 2008 + AMD1: 2019 CSV |
Environmental testing - Part 2-64: Tests - Test Fh: Vibration, broadband random and guidance |
|
IEC 60068-2-80: 2005 |
Environmental testing - Part 2-80: Tests - Test Fi: Vibration - Mixed mode |
|
RTCA DO-160G, Sect. 4 |
Environmental Conditions and Test Procedures for Airborne Equipment - Sect. 4Temperature and Altitude |
|
RTCA DO-160G, Sect. 7 |
Environmental Conditions and Test Procedures for Airborne Equipment - Sect. 7Operational Shocks and Crash Safety |
|
RTCA DO-160G, Sect. 8 |
Environmental Conditions and Test Procedures for Airborne Equipment - Sect. 8Vibration |
|
电磁兼容 |
|
|
RTCA DO-160G, Sect. 20 |
Environmental Conditions and Test Procedures for Airborne Equipment - Sect. 20Radio Frequency Susceptibility |
|
RTCA DO-160G, Sect. 21 |
Environmental Conditions and Test Procedures for Airborne Equipment - Sect. 21Emission of Radio Frequency Energy |
|
相关性能和测试方法 |
|
|
ISO 18242 (1st ED) |
Cardiovascular implants and extracorporeal systems - Centrifugal blood pumps |
|
ISO 15676 (2nd ED) |
Cardiovascular implants and artificial organs -Requirements for single-use tubing packs for cardiopulmonary bypass and extracorporeal membrane oxygenation (ECMO) |
|
ASTM F1830-19 |
Standard Practice for Collection and Preparation of Blood for Dynamic in vitro Evaluation of Hemolysis in Blood Pumps |
|
ASTM F1830-97 |
Standard Practice for Selection of Blood for In Vitro Evaluationof Blood Pumps |
|
ASTM F1841-97 |
Standard Practice for Assessment of Hemolysis in Continuous Flow Blood Pumps |
|
ASTM F2172-02 |
Standard Specification for Blood / Intravenous Fluid / irrigation Fluid Warmers |
7.3、流量、转速和压差的研究
开发人需要开展离心泵流量、转速和压差的流体力学分析和评价工作。若适用,建议开发人优先考虑以试验方式开展相关评价研究工作。
7.3.1、适配的离心泵泵头
开发人需要明确离心泵泵头的必要信息,一般应包括型号规格、关键参数、上市情况等。
若申报产品测试时采用了第三方制造商生产的离心泵泵头,需开展进一步关于泵头的相关研究。
若申报产品宣称可以适配多个不同型号规格的离心泵泵头,在开展研究时需要考虑所有适配的离心泵泵头。
7.3.2、血液粘度对离心泵运行的影响
开发人宜开展血液粘度与离心泵性能的研究,结合临床真实应用场景,分析血液粘度对于ECMO设备正常运行的影响,并进一步研究转速、流量、压力等关键要素之间的关系。
7.3.3、ECMO设备的流量转速曲线
开发人需要规定测试的环境要求,模拟临床使用条件,开展ECMO设备流量和转速分析的研究。相关评价研究结果建议在产品说明书等随机文件中予以体现。在ECMO设备发生某些异常或故障的情况下,例如产品用户界面流量显示功能失效时,操作者可以依据流量特性曲线图表(图1),以及离心泵转速、泵入口和出口的压力差值等关键参数,对ECMO设备当前输出的流量进行判定和控制。
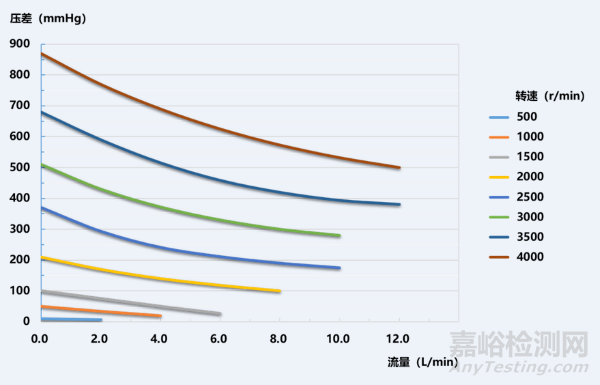
图1 离心泵流量转速曲线示例(新鲜牛血,hct 30%)。
7.4、产品长时间连续运行的研究
开发人需要调研临床实际情况,模拟临床应用场景,搭建ECMO设备和配套耗材的测试系统,可以采用体外管路循环模拟血液溶液的方式,开展产品长时间连续运行的试验研究。模拟血液溶液应能够复现出血液的关键物理特性,例如:粘度、温度、密度等。试验时间一般建议大于申报产品宣称的持续灌注时间。
开发人可以结合临床典型使用条件,确定产品试验参数选取的科学依据。例如:流量、转速、背压、温度、管路阻力、循环时间等,以及压差的影响[2]。
7.5、产品对血液成分影响的研究
开发人需要开展ECMO设备和配套耗材所构成的ECMO系统对血液成分影响的相关研究。建议开发人考虑不同典型运行模式并开展溶血研究,明确溶血指标的定义依据以及对体外溶血进行研究,推荐参照ASTM F1841的方法进行体外溶血测试评估。若适用,建议结合动物试验等进行研究。
四、ECMO设备主要风险
ECMO设备的主要危害
|
可能的危害 |
可能的原因 |
造成的后果 |
|
|
能 量 危 害 |
电磁能 |
设备产生电磁干扰;设备受到电磁干扰 |
影响其他设备正常使用; 影响操作者的健康;影响患者治疗 |
|
网电源 |
网电源不稳定 |
设备无法正常工作,影响患者治疗 |
|
|
漏电流 |
电击 |
患者或操作者受到电击伤害 |
|
|
热能 |
设备加热或散热功能失常 |
体外循环血液温度过高或过低,伤害患者; 设备无法正常工作,影响患者治疗 |
|
|
重力 |
液袋坠落伤害(输液架,若有) |
砸伤患者或操作者 |
|
|
贮存的能量(备用电源,若有) |
电池超期使用; 电池容量或续航能力有限 |
设备某些功能失效,影响患者治疗 |
|
|
运动部件 |
意外接触转动中的手柄 |
夹伤手指 |
|
|
生 物 学 和 化 学 危 害 |
细菌、病毒、其他介质、再次或交叉感染 |
未能正确地连接体外循环管路 |
患者感染 |
|
血路/气路、组织、环境或设备暴露在外来物质中 |
清洁和消毒操作 |
导致患者或操作者受到化学灼伤 |
|
|
化学成分的毒性 |
存在毒性材质部分 |
导致患者或操作者中毒 |
|
|
操 作 危 害 |
不正确或不适当的输出或功能 |
软件存在缺陷; 操作错误 |
影响患者治疗 |
|
不正确的测量 |
软件存在缺陷; 产品器件损坏或受到干扰 |
监测数据不准确; 影响患者治疗 |
|
|
错误的数据转换 |
软件存在缺陷; 产品器件损坏或受到干扰 |
影响患者治疗 |
|
|
功能的丧失或变坏 |
心肺转流等产品功能的丧失或变坏 |
影响患者治疗 |
|
|
使用错误 |
不正确的参数设置,错误的安装 |
影响患者治疗 |
|
|
不遵守规则 |
不遵守医嘱设置参数 |
影响患者治疗 |
|
|
信 息 危 害 |
不完善的使用说明书 |
使用说明书存在缺陷,过于复杂而难于理解,或缺少必要的步骤描述 |
不能正常使用设备; 影响患者治疗 |
|
不完善的操作说明书 |
使用说明书存在缺陷,过于复杂而难于理解,或缺少必要的步骤描述 |
不能正常使用设备; 影响患者治疗 |
|
|
医疗器械及其附件的描述不适当 |
型号不统一 |
不能正常使用设备; 影响患者治疗 |
|
|
不适当的标记 |
标记缺失,不明显,不规范 |
导致误操作; 影响患者治疗 |
|
除上表外,亦可参考GB 9706.216《医用电气设备第2-16部分:血液透析、血液透析滤过和血液滤过设备的基本安全和基本性能专用要求》的附录BB的适用项目进行风险分析。
若ECMO治疗期间出现离心泵意外中断工作、血流缓慢或者停滞的情形,可能的风险是泵驱动电机产生的热量传导至离心泵泵头内的血液,导致潜在血液损伤,例如:凝血或溶血。
若适用,关于离心泵、配套耗材、供电部件之间的连接设计,建议开展产品可用性研究,提供必要的防止错误连接的安全措施。

来源:嘉峪检测网


