您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-23 11:30
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
瑞博降血脂siRNA药物启动I期临床。瑞博生物宣布其自主研发的针对高甘油三酯血症 (HTG) 和家族性乳糜微粒血症(FCS)的小核酸(siRNA)药物RBD5044注射液在澳大利亚启动首次人体临床。RBD5044利用RNA干扰机制抑制肝细胞APOC3的表达,通过调节脂蛋白脂肪酶和肝脂酶的活性,促进富甘油三酯脂蛋白的清除,以降低血液中甘油三酯。该项I期临床拟评估RBD5044在健康受试者中的安全性和有效性。
国内药讯
1.诺诚健华BTK抑制剂在新加坡获批。诺诚健华新型BTK抑制剂奥布替尼获新加坡卫生科学局(HSA)批准上市,用于治疗复发/难治性套细胞淋巴瘤(R/R MCL)。这是诺诚健华针对血液肿瘤及自身免疫性疾病开发的1类新药,已获国家药监局附条件获批上市,用于治疗复发/难治性慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL),以及R/R MCL。此外,该新药治疗复发/难治性华氏巨球蛋白血症和边缘区淋巴瘤(MZL)两项新适应症上市申请也获得CDE受理。
2.罗氏IL-6受体单抗新适应症报产。罗氏皮下注射托珠单抗注射液的新适应症上市申请获CDE受理。托珠单抗(Tocilizumab)是一款重组IL-6受体单抗,通过抑制IL-6受体的活性来发挥作用。此前,托珠单抗的静脉注射剂型已在中国获批用于治疗类风湿性关节炎、全身型幼年特发性关节炎和细胞因子释放综合征。今年4月,该药的皮下注射剂型也已获NMPA批准上市,用于治疗对抗风湿药物治疗应答不足的中重度活动性类风湿关节炎。
3.泰诺麦博破伤风抗体启动Ⅲ期临床。泰诺麦博破伤风中和抗体TNM002登记启动一项Ⅲ期临床,评估与破伤风人免疫球蛋白被动免疫相比预防破伤风感染的有效性和安全性。研究计划入组675例因切割伤、烧伤、交通伤、动物抓咬伤等各种创伤造成不洁或污染伤口且需要接受被动免疫以预防破伤风感染的18岁以上受试者;主要研究者将由广州医科大学附一院的梁子敬教授和北京大学人民医院的王传林教授共同担任。
4.传奇生物CAR-T获批肺癌I期临床。传奇生物CAR-T疗法LB2102获FDA批准,拟开展首次人体I期临床,评估治疗广泛期小细胞肺癌(SCLC)或大细胞神经内分泌肺癌(LCNEC)患者的安全性和初步疗效。LB2102旨在选择性靶向δ样配体3(DLL3),这种配体高度局限于各种恶性肿瘤,包括SCLC、LCNEC、某些其他部位神经内分泌癌和前列腺癌。DLL3与肿瘤生长、迁移和侵袭有关。
5.宜明昂科CD47/20双抗联合疗法报IND。宜明昂科1类生物制品IMM0306的IND申请获CDE受理,联合来那度胺治疗复发难治非霍奇金淋巴瘤患者。IMM0306是全球首个进入临床阶段的CD47/CD20双抗。IMM0306对CD20的亲和力高于CD47,因此可优先与恶性B细胞上的CD20及CD47结合,弱化了CD47靶点相关的毒性;IMM0306不与人红细胞结合,同等剂量下显示出优于利妥昔单抗药效的潜力,有望成为B细胞淋巴瘤的一线治疗选择。
6.和铂与Dragonfly合作开发抗体疗法。和铂医药全资子公司诺纳生物宣布与Dragonfly公司签订合作协议,双方将利用和铂医药专有的HCAb转基因小鼠技术平台,针对Dragonfly指定靶点生成全人源重链抗体,用以双特异性抗体及多特异性抗体疗法的开发。Dragonfly是由麻省理工学院科赫研究所创始主任Tyler Jacks以及加州大学伯克利分校免疫学家David Raulet共同创立,致力于三特异性NK细胞接合器疗法的开发。
国际药讯
医药热点
1.国家精神疾病医学中心正式启用。11月20日上午,国家精神疾病医学中心在北京大学第六医院揭牌,标志着中国精神卫生事业发展迈向新起点、步入新阶段。中国科学院院士、北京大学第六医院院长陆林表示,北大六院将进一步发挥精神医学学科和亚学科优势,发挥引领和辐射作用,搭建全国上下联动、区域协同的精神疾病防控体系,致力提升我国精神医学卫生的均衡发展,切实提升我国精神医学的医疗服务和学科水平。
2.新冠核酸检测再次降价。近日,广东省新冠肺炎防控指挥办发布关于进一步降低新冠病毒检测价格的通知。深圳、珠海、东莞、清远等广东多地根据文件精神,对当地新冠病毒核酸检测价格进行相应调整,其中,单人单检价格降至每人份不超过13.5元(其中检测服务费每人份不超过9.5元),多人混检价格统一降至每人份不超过2.8元,不区分普通混检和政府组织的大规模筛查、常态化检测。
3.广东省高水平临床医学院建设名单公布。日前,广东省教育厅发布《关于首批广东省高水平临床医学院、公共卫生学院和中医药学院建设名单的公示》,遴选出广东省首批高水平临床医学院、公共卫生学院和中医药学院重点建设学院15个,培育建设学院6个。据悉,获得立项的高校要“一拖一”支持帮扶1所粤东粤西粤北区域高校同类学院建设,提升基层医疗人才质量。
评审动态
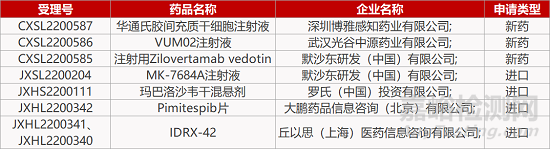
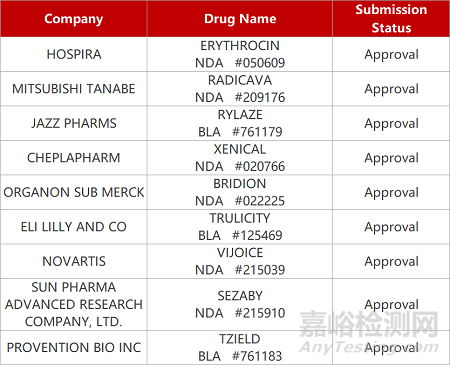

来源:药研发


