您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-29 05:21
一、简述
基于生物杂交的细菌微型机器人作为可能可控的外部靶向癌症治疗工具,已经逐渐被人接受。而磁场被视作传递能量和引导它们运动,并且安全的重要手段。
到目前为止,在这一背景下使用的磁控制机器人依赖于可伸缩磁场梯度,同时需要主动位置反馈,不适合在人体内的扩散分布。所以,作者提出了一种磁转矩驱动的控制方案,以增强细菌微型机器人通过生物屏障的转运过程,并且增强细菌对肿瘤核心的固有趋化性,使用磁螺旋菌作为模型生物。这种混合控制策略易于规模化扩展,独立于位置反馈,适用于易于被循环系统分散的细菌微型机器人。
作者观察到在血管内皮模型中,磁性反应细菌的易位增加了四倍,并发现驱动运输增加的主要机制是细胞界面转矩驱动导致的表面探索。使用球体作为三维肿瘤模型,放置在旋转磁场中,并在其信号高出21倍的核心区域用荧光标记细菌机器人的定植。
除了增强运转外,作者还证明了这个控制方案的其他优势,包括基于感应检测的闭环优化的可能性,以及减少脱靶效应的空间选择性驱动。最后,在小鼠全身静脉注射后,可以发现细菌微型机器人在肿瘤的聚集显著增加,支持了将该控制方案应用于临床的可能性。
图 沙门氏杆菌图
二、介绍
结合了细胞和合成成分的生物杂交细菌微型机器人有望改善肿瘤治疗的方案,因为它们有自主驱动力,且能够自主响应,并且携带能够治疗肿瘤的有效载荷。基于细菌的微型机器人有特别的功能,它们有免疫调节能力,以及某些菌株表现出的肿瘤导向性和优先定植性。
在机器人领域之外,直接使用细菌进行肿瘤治疗的研究已经进行了一个多世纪,并且已经在各种动物模型中进行了大量的基因工程和减毒菌株测试。此外,沙门氏菌、分枝杆菌和梭状芽孢杆菌的菌株已经进展到人体临床试验阶段。然而,由于在肿瘤中的定植不足而导致的临床反应不完全,阻碍了这种方法的临床转化。改变控制方法以增强和加快细菌在肿瘤内的积累,对于限制免疫系统清除,促进细菌定植,降低细菌剂量,从而提高治疗效果和安全性是至关重要的。
生物混合微型机器人通过感受外部刺激(包括化学梯度、光、电场和磁场)的变化实现无线控制。其中,磁场由于其微创、在组织深部穿透性良好和临床安全性,因此在医学上有很大的应用前景。对磁性有反应的细菌,包括通过与磁性材料结合而产生带有磁性的菌株和天生具有磁性的趋磁细菌(MTB),在原生环境中,MTB通常将稳定磁化的各向磁性纳米颗粒生物矿化,并利用磁场辅助迁移到氧浓度低的区域。在体内定向磁场(DMF)或磁场梯度存在的情况下,在肿瘤周围注射后,携带有效载荷的MTB菌株优先在肿瘤的脱氧区域增殖。
尽管基于磁性细菌的微型机器人是很有前途的药物传递媒介,但到目前为止,它们在临床转化方面依旧有限制。这种控制策略会导致微机器人在体内的分散分布,因此不适合全身注射。而DMF控制需要在肿瘤周围给药,只能应用于浅层的肿瘤。
在这项研究中,作者建立了一种混合控制方法,利用磁转矩驱动运动和自主导航,用磁螺旋菌AMB-1菌株作为磁响应模型生物和共价偶联脂质体(MTB-LP)载体的渗透性(图1)。均匀旋转磁场(RMF)可以在临床上应用,控制分散的微型机器人,并且不依赖于视觉反馈。
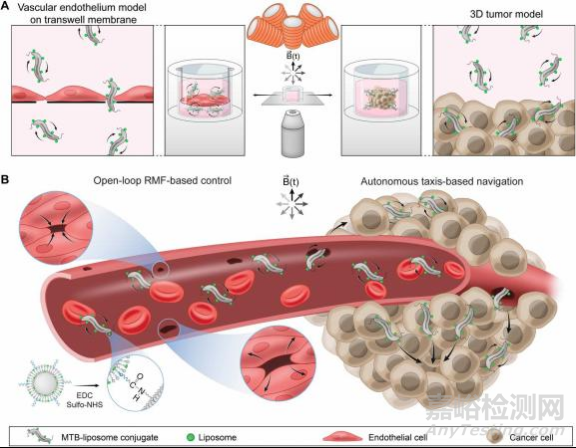
图 磁性增强MTB脂质体缀合物转运混合控制方案的概念概述
三、实验结果
RMF增强细菌易位,并提供独特的控制优势
之前已经使用了一系列的方法来操作MTB,将其作为使用外部磁场的微型机器人(图2A)。在DMF存在的情况下,细菌的运动依赖于鞭毛产生的推进力(FP)和流体阻力(FD),两者在匀速运动时方向等值相反。
MTB自推进被DMF覆盖时,来自周围流体的粘性阻力在外场与MTB的磁矩之间产生了相位滞后,产生了施加在细菌上的磁转矩。磁转矩驱动的运动产生的力比MTB自行推进产生的力高一个数量级。静态场梯度也被用于将MTB拉向目标位置。虽然这种方法已经在小动物模型中显示出了效果,但要在相同的磁矩上产生相当的力,需要一个超过1300 T/m的梯度,这是不现实的(详细计算可见文献原文补充资料)。
面内RMF和DMF相比,面外旋转可以显著提高MTB的渗透率(图2C)。频率在1到20赫兹之间的平面外驱动始终比没有磁暴露的对照组产生更高的易位。鉴于这些发现,后续实验都是使用平面外RMF进行的。
并且在每次实验前后作者都进行了Lucifer yellow (LY)排斥试验,验证了MTB刺激不影响单层分子膜的完整性。在所有测试条件下,LY排斥值保持在99%以上,表明单层未发生损伤(图2D)。
在观察到使用RMF增强了MTB易位后,作者研究了使用RMF控制和MTB应答。与DMF或梯度场不同,RMF的时变性可同时用于MTB的驱动和监测,使操作过程中可以调整驱动参数以改善位置。
在一个概念验证实验中,使用一个小型定制RMF磁强计驱动在过程中对MTB进行感应检测,该磁强计由两对嵌套Helmholtz线圈组成(图2E)。正弦电流被应用到每组线圈产生一个圆形RMF。当暴露在RMF下时,MTB的总磁矩随时间变化。MTB的磁化强度对于旋转磁场是相移的,反映了细菌磁响应中的相位滞后。
使用拟合于同相场探针的余弦函数,我们将采集到的信号分离为样品磁化率的同相分量和异相分量(图2F)。将实验数据与分析数据进行比较,以评估MTB产生的检测信号是否符合预测特性。模型预测了同相和异相易感性的潜在趋势,证实了能够在RMF驱动下检测MTB。
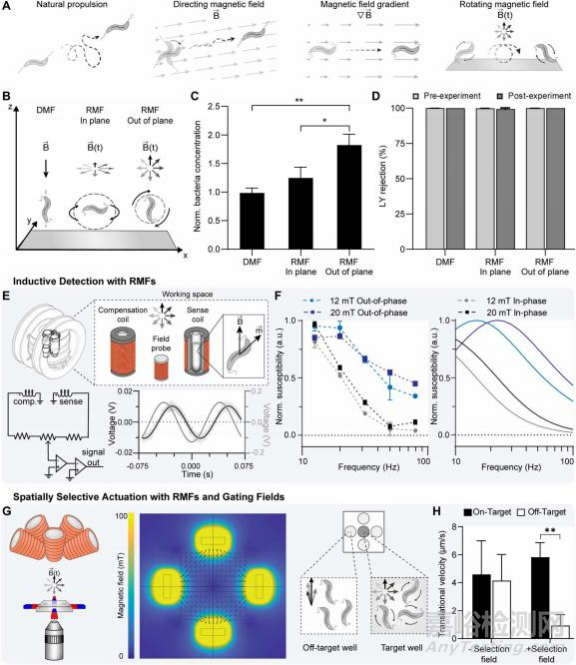
图 RMF增强了MTB的易位,并能够诱导检测和空间选择性控制MTB
用计算模型阐明转矩驱动运动在易位中的作用
考虑到RMF对MTB通过细胞屏障传输的显著影响,使用COMSOL Multiphysics中的计算模型来理解驱动增强易位的主要机制。由于内皮是静脉给药后遇到的第一个生物屏障,因此对二维内皮细胞单层运输进行建模,该单层膜由相邻的细胞组成,形成上下之间的密封屏障。流体动力的相互作用被模拟为作用在刚体上的线性阻尼和旋转粘性阻尼。
对细菌通过被动连接所需的力进行建模,得到的接触力进行估计(图3A)。在低于12 mT,14 Hz旋转的细菌,扭矩诱导接触力远低于细胞阻力(图3B)和打破由血管内皮-钙粘蛋白键所需的力(36)。
为了表征模型单分子层的渗透性,模拟了直径约200nm的脂质体被动扩散,5.9%的脂质体扩散到下腔室(图3C)。继续比较DMF和RMF下的MTB传输(图3D)。在RMF条件下生成的细菌扩散速度显示出良好的研究特性(图3E)。
同时模型显示,暴露于DMF的细菌中只有6.6%的细菌跨越了该屏障,而暴露于RMF的细菌有20%跨越了该屏障(图3F)。相比之下,在RMF作用下的MTB沿着单层转译,这使得细菌能够探索单层表面,并通过细胞之间的缝隙。这些发现表明,由基于扭矩的运动引起的表面探测是促进MTB易位增加的主要原因。
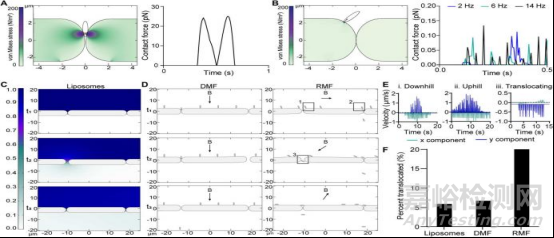
图 MTB跨内皮单层转运的计算模型
RMF增加MTB-脂质体结合物的外渗
继续在适合于血管外渗模型的体外系统中研究易位。在Transwell植入物上培养的人单层微血管内皮细胞(HMEC-1)用于模拟静脉输送后可能遇到的内皮屏障。对VE-钙粘蛋白进行了染色(图4A)。从荧光强度可以发现,1小时后,只有0.24%的脂质体能够通过被动扩散进入基底外侧腔(图4B)。
然后研究MTB脂质体的结合在单分子膜上的易位。MTB-LP复合物结合了传统治疗的纳米载体适应性和磁性平台功能性,生产了一种靶向给药的微型机器人。增加个磁场强度下,MTB应变频率为24 Hz(25),与磁强计数据一致(图2F)。
将MTB-LP在单分子膜的平面外激活1小时后,与暴露于DMF和未激活进行对照比较(图4C)。平面外旋转导致MTB-LP易位比DMF高4.6倍。暴露于DMF的MTB-LP浓度与非驱动对照相当,Caco-2单层实验的情况也是如此(图2C)。最后进行跨内皮电阻(TEER)测量和LY排斥试验,结果表明MTB激活不影响单层膜完整性(图4D和E)。这表明在暴露于磁场后单层膜未发生破坏。
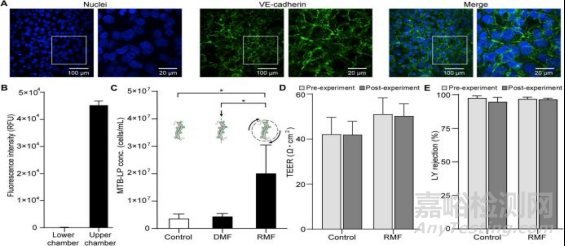
图 基于RMF增加MTB-脂质体结合物的外渗
基于RMF的控制改善MTB的转运和三维球体肿瘤定植
证明了跨越内皮单分子层的易位增强后,下一步在人乳腺腺癌(MCF-7)的球体外肿瘤模型实验中测试基于RMF的控制对MTB-LP肿瘤渗透的影响。球状肿瘤可以有效地再现无血管肿瘤组织的运输特性和复杂结构,并已被用于研究基于细菌的癌症治疗(42-44)。在1小时的驱动(MFG- 100-i, 20 mT和24 Hz)后,球体孵育120小时(图5A)。考虑到未驱动控制和DMF的结果具有可比性(图2C和4C),以及在球形三维模型中缺乏明确定义的优先方向,在后续所有实验中,将RMF与未驱动控制进行比较。
可视化培养24小时后脂质体的分布(图5B)。暴露于RMF后,MTB-LP结合物能够推进到无血管球体的深部。在驱动样品中检测到密度随着深度的增加而增加(图5C)。
80 μm截面的强度分布曲线显示,与对照组相比,驱动样品中的MTB-LP分布存在明显差异(图5D)。对照样组的荧光信号分布更为均匀。相比之下,驱动样品的整体荧光强度值较高,且荧光信号在球体中心区域最高。在深度为100 μm的范围内,每个切片的平均荧光强度总和,是对照的4倍(图5E)。
活体肿瘤的共聚焦图像,被用于可视化和量化RMF样本和未受刺激的对照组在24小时和120小时荧光标记细菌的分布(图5F)。z投影图像显示,在120小时后,驱动样品和对照组的MTB在球形内仍然是可测量的。利用球体的荧光强度曲线来研究MTB在球体中的定位。MTB的优先积累可能是由于氧敏感机制,这有利于它们向缺氧环境导航(47-49)。
每个切片在100μm深度内的平均荧光强度总和,用于评估不同时间点球体中MTB的相对含量。在24小时和120小时,暴露于RMF的球体的荧光强度值分别是对照组的9.9倍和21.3倍。我们对MCF-7球状体进行了组织学切片(图5G)。从球体中心的切片显示MTB在细胞之间形成簇状,暴露于RMF的球体中MTB的信号高于对照组。总的来说,这些发现表明稳定的肿瘤定植是磁转矩驱动运动与自主导航结合的结果。
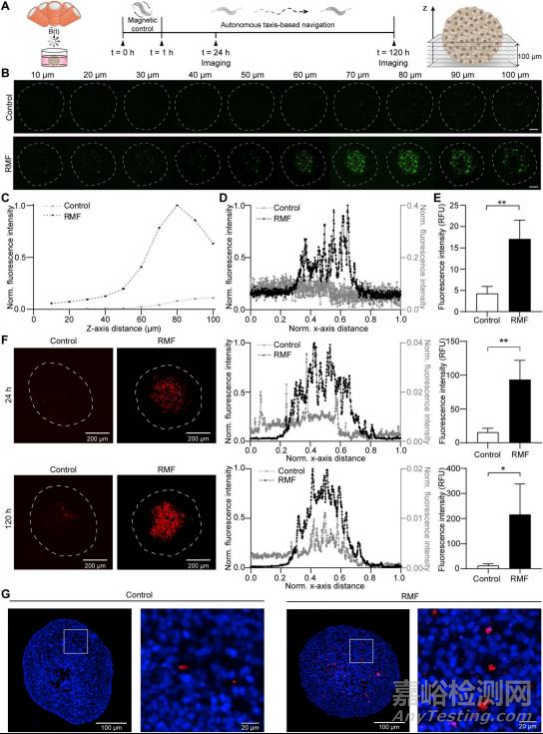
图 基于RMF的控制改善MTB的转运和三维球体肿瘤定植
基于RMF的控制增强了MTB在体内肿瘤中的转运
由于RMF对MTB体外转运的显著影响,下一步作者通过使用小鼠模型来测试RMF驱动方法是否也增强了体内细菌的积累。BALB/c鼠后侧皮下有MCF-7肿瘤,静脉注射1×109 MTB,并将MTB染色为红色(图6A)。设置对照组,使一个定向磁场不能作用于肿瘤部位。
治疗后,将小鼠放回笼中24小时,24小时后取出肿瘤和主要器官,利用全器官荧光扫描仪评估细菌的分布(图6C)。所有肿瘤均检测到荧光信号,说明细菌可以在肿瘤中天然积累。暴露于RMF的肿瘤小鼠比未受刺激的对照组高16倍(图6D)。
为了评估在荧光扫描中检测到的细菌是否仍然存活,采集的肿瘤被置于MTB培养基中。8天后,在所有的试管中都有大的黑色小球出现,表明肿瘤中含有活细菌(图6E)。
对肿瘤进行组织学切片,在肿瘤深度约1mm处采集切片,和对照组相比交流组的肿瘤周围有更明显的聚集(图6F)。肿瘤切片的分布随着与周边距离的增而增加,细菌可以在前250μm范围内被检测到,暴露于RMF的样品的信号总体高于对照组(图6G)。同时评估横向组织切片,评估MTB与肿瘤表面距离的分布(图6H)。连续横切面的荧光强度表明,总的荧光强度——MTB的传递量比对照组高2.1倍(图6J)。这些结果,结合体外发现的分析,证明了磁转矩驱动控制方法在增强肿瘤内细菌的积累具有潜力。
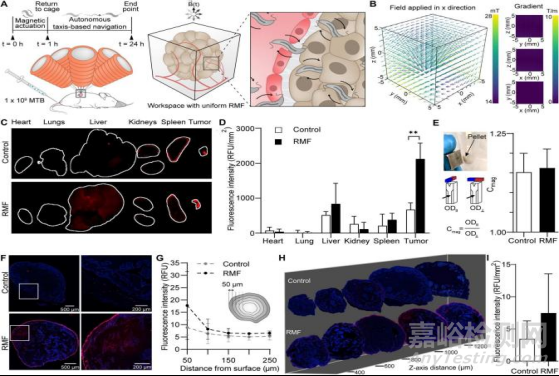
图 基于RMF的控制增强了MTB在体内肿瘤中的转运
四、讨论
生物杂交微型机器人与不同的控制方法结合,具有增强肿瘤定植的潜力,增强了细菌治疗癌症的临床可能。但这种方法有内在的局限性,它降低了临床转化的潜力。相比之下,对于深部肿瘤中磁反应药物的开环控制,在临床上使用均匀的RMF的方法更加合理。
RMF的时变性为磁性微型机器人的实时驱动和检测提供了机会。作者的概念验证实验证明了由RMF驱动的MTB可以被检测到,并且它们基于力矩的运动可以被磁静态门控场控制在一定区域内。这些验证为空间驱动、同步监测和驱动闭环参数的进一步优化奠定了基础。
同时磁转矩驱动自主导航被证明是一种非常有效的混合控制方法,可以帮助微型机器人跨越各种生物障碍。并且表明,开环控制方法在体外表征结果可以在体内高度复杂的生物环境中复制,暴露于RMF的肿瘤可以获得显著的MTB积累。
将这种增强微生物微机器人渗透的方法与治疗中药物传递相结合,可能是提高细菌治疗效果的有力工具,在细菌癌症治疗领域引起越来越多人的兴趣。这种方法可以更有效地使用这些菌株,并且提高安全性和有效性。通过将细菌治疗的优点与可伸缩磁转矩驱动控制方法结合,有效的针对活体微型机器人进行改进,未来可以用以癌症治疗。

来源:和义广业创新平台


