您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-10-26 10:47
今日头条
祐森健恒TYK2抑制剂报自免疾病IND。祐森健恒生物1类新药UA021胶囊的临床试验申请获CDE受理。UA021是一款TYK2变构体抑制剂,它通过分子变构机制作用于TYK2激酶的JH2区域,且对JAK家族的其他成员有高度的选择性,有望降低不良反应。该新药拟开发用于治疗银屑病、炎症性肠病(IBD)等自身免疫性疾病。在澳洲,UA021的Ⅰ期临床将在近期完成首例受试者给药。
国内药讯
1.复星凯特CAR-T新适应症报产。国家药监局受理了复星凯特的阿基仑赛注射液的新适应症上市申请(受理号:CXSS2200087),拟用于一线免疫化疗无效或在一线免疫化疗后12个月内复发的成人大B细胞淋巴瘤(r/r LBCL)。值得一提的是,该项适应症已被CDE纳入优先审评。阿基仑赛(Yescarta)是一款由复星凯特从吉利德旗下公司Kite引进,并在中国本地化生产的靶向CD19自体CAR-T细胞治疗产品。
2.博唯四价HPV疫苗启动Ⅲ期临床。博唯生物四价重组人乳头瘤病毒疫苗(汉逊酵母)登记启动一项Ⅲ期临床,评估接种于18~45岁中国女性预防HPV 6/11/16/18型感染相关下生殖道病变的保护效力、免疫原性和安全性。该项研究由广西疾控莫兆军主任医师担任主要研究者,拟入组10000例受试者。据悉,该公司的九价HPV疫苗也正在针对9-45岁中国女性开展Ⅲ期临床和针对男性适应症开展Ⅰ期临床。
3.启德HER2靶向ADC获批临床。启德医药自主开发、具有全球知识产权的新一代定点偶联ADC药物GQ1005获国家药监局临床默示许可。GQ1005是一款靶向HER2的ADC药物,拟开展用于人表皮生长因子受体2(HER2)表达的晚期实体瘤成年患者的临床研究。启德医药专有iLDC技术平台,将细胞毒素或其他类型的有效载荷与抗体进行位点特异性智能连续偶联,开发出的多款创新ADC药物已进入临床阶段。
4.博安Claudin18.2靶向ADC报IND。绿叶制药旗下博安生物靶向Claudin18.2的ADC药物BA1301的临床试验申请获得NMPA受理。Claudin18.2是Claudin蛋白家族成员Claudin 18的异构体之一,在胃癌、食管癌、胰腺癌、肺癌等多种肿瘤中高表达。BA1301是博安生物第二款靶向Claudin18.2的药物,也是其申报的首款ADC药物,拟开发适应症为胃癌、胰腺癌及食管癌。
5.创胜Gremlin1单抗临床前研究积极。创胜集团在第10届TEMTIA会议上公布其Gremlin1单抗TST003的临床前研究成果。在检查点抑制剂耐药的多种难治性实体瘤(包括去势抵抗性前列腺癌和微卫星稳定转移性结直肠癌)的人源性组织异种移植肿瘤模型中,TST003展现出有前景的单药活性。在同源移植小鼠模型中,TST003也增强了检查点抑制剂的抗肿瘤活性。2022年9月,TST003已获得FDA的临床许可。
国际药讯
1.环孢素滴眼液治疗干眼症报NDA。FDA受理Novaliq公司环孢素滴眼液CyclASol用于治疗干眼症(DED)的新药申请,预计在明年6月8日前完成审查。在关键III期临床(ESSENCE-2)中,与对照组相比,CyclASol组第29天时患者的全角膜荧光素染色评分(tCFS)较基线显著改善(p=0.0278);在4周内产生应答(角膜染色改善≥3级)的患者比例更高(71.6%,p=0.0002)。恒瑞拥有CyclASol的中国权益。
2.诺华FIC补体抑制剂III期临床成功。诺华口服因子B抑制剂Iptacopan在治疗既往接受补体C5疗法治疗后仍有贫血症状的阵发性睡眠性血红蛋白尿症(PNH)患者的关键III期APPLY-PNH临床达到两个主要终点。在24周不需要输血的情况下,与C5单抗相比,服用iptacopan(200mg每日2次)的患者实现血红蛋白水平较基线增加≥2g/dL的患者比例显著增加;达到≥12 g/dL血红蛋白水平的患者比例显著更高。药物的总体耐受性良好。
3.杨森IL-23抑制剂肠炎Ⅱb期临床成功。杨森IL-23抗体Tremfya(guselkumab)治疗中重度溃疡性肠炎(UC)的Ⅱb期临床结果积极。24周治疗数据显示,guselkumab(200mg、400mg)的临床缓解率分别达到80.2%与78.5%。在接受Tremfya静脉注射12周后没有获得缓解的患者中,平均约52.1%在继续使用Tremfya治疗后,在24周时达到临床缓解。详细数据将公布在今年美国胃肠病学院(ACG)年会当中。
4.第一三共白血病新药获FDA优先审评资格。第一三共制药FLT3抑制剂quizartinib的新药申请(NDA)获FDA授予优先审评资格,联合标准化疗治疗携带FLT3-ITD突变的新确诊急性髓系白血病(AML)患者。PDUFA日期为2023年4月24日。在Ⅲ期临床QuANTUM-First中,与标准治疗相比,quizartinib联合标准诱导和巩固化疗治疗,然后继续接受quizartinib单药治疗患者的中位总生存期显著改善(中位OS:31.9个月vs15.1个月);死亡风险降低22.4%。目前该新药已在日本获批上市。
5.吉利德HIV三合一复方真实数据积极。吉利德公布HIV新药Biktarvy(bictegravir /恩曲他滨/替诺福韦艾拉酚胺,BIC/FTC/TAF)一项真实世界BICSTaR研究的24个月随访分析数据。总体而言,97%的初治受试者和95%既往接受过治疗的受试者在24个月时实现了病毒抑制。另外,来自两项III期研究(研究1489和研究1490)的五年真实数据显示,超过99%受试者实现了病毒抑制。2021年,Biktarvy销售额达到86.24亿美元。
6.新型CAR-T向FDA报狼疮性肾炎IND。Kyverna公司靶向CD19的自体CAR-T疗法KYV-101已向FDA提交新药临床试验申请(IND),用于狼疮性肾炎的治疗。临床前研究显示,KYV-101在疾病模型中可在循环和组织中诱导深度和完全的B细胞耗竭,对于炎性肌病、狼疮性肾炎等B细胞驱动的自身免疫性疾病有显著疗效。在一项Ⅰ/Ⅱ期临床中,KYV-101还显示出减少肿瘤患者细胞因子的释放,降低严重神经毒性的发生率。
7.慢性肾病新药III期研究失败。Tricida公司非吸收聚合物混悬制剂veverimer用于治疗慢性肾病(CKD)的III期临床(VALOR-CKD)试验未达到主要终点,定义为至首次发生复合终点(肾源性死亡、终末期肾病 (ESRD) 或经证实的肾小球滤过率(eGFR;也称为DD40)降低≥40%)中任何事件的时间。在中位治疗26.7个月时,veverimer治疗组与安慰剂组分别有149例和148例患者发生DD40主要终点事件,veverimer与安慰剂的风险比为0.99[95%CI,0.78,1.24;(p=0.898)]。
医药热点
1.上海启动吸入用重组新冠疫苗加强免疫。根据国务院联防联控机制工作部署,上海市于2022年10月26日起启动吸入用重组新冠病毒疫苗(5型腺病毒载体)加强免疫。2022年10月25日起,符合条件的市民可通过“健康云”APP等进行加强免疫接种在线预约登记。携本人有效身份证件在约定时间前往预约的接种门诊进行加强免疫接种。70岁及以上人群接种时,要由家属或志愿者陪同
2.河南居民医保财政补助新增30元。日前,河南省医保局下发《关于做好2022年城乡居民基本医疗保障工作的通知》。河南2022年城乡居民基本医保人均财政补助标准新增30元,达到每人每年不低于610元;个人缴费标准同步提高30元,达到每人每年350元。《通知》针对异地就医直接结算方面,要求2022年底前实现每个县开通至少一家普通门诊费用跨省联网定点医疗机构,所有统筹地区开通高血压、糖尿病等治疗5种门诊慢特病费用跨省直接结算服务。
3.第四批国家区域医疗中心项目名单公布。10月18日,国家发改委、国家卫健委等部门联合发文,公布第四批国家区域医疗中心项目名单,全国14省份和新疆兵团的26家医院获批。其中,上海交通大学医学院附属上海儿童医学中心贵州医院、北京积水潭医院贵州医院两个国家区域医疗中心建设项目正式获批,标志着贵州省国家区域医疗中心建设新突破。
评审动态
1. CDE新药受理情况(10月25日)
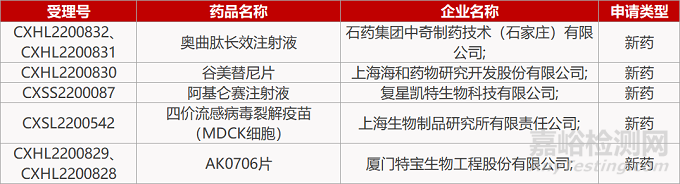
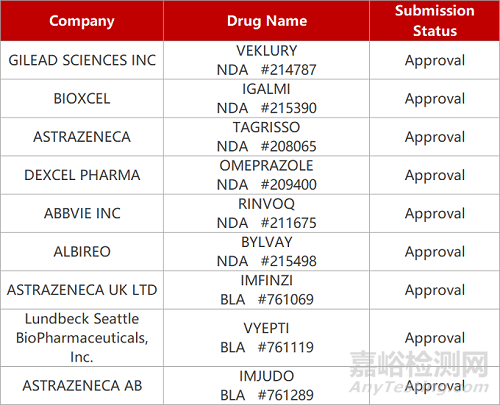
2. FDA新药获批情况(北美10月24日)
股市资讯
上个交易日 A 股医药板块 -2.14%
涨幅前三 跌幅前三
君实生物+15.99% 艾德生物-11.86%
上海谊众 +7.62% N 康 为 -10.94%
首药控股 +7.00% 普利制药-10.93%
【常山药业】公司药品依诺肝素钠注射液获得乌兹别克斯坦卫生部签发的药品注册证书。
【复星医药】近日,上海复星医药(集团)股份有限公司投资的复星凯特生物科技有限公司的阿基仑赛注射液(商品名:奕凯达)用于治疗一线免疫化疗无效或在一线免疫化疗后12个月内复发的成人大B细胞淋巴瘤(r/rLBCL)的药品注册申请获国家药品监督管理局审评受理,并被纳入优先审评品种名单。
【华森制药】于近日收到重庆市药品监督管理局核准签发的关于公司产品八味芪龙颗粒、胆舒软胶囊的《药品再注册批准通知书》。

来源:Internet


