您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-09-15 19:22
刚刚,国家药监局器审中心发布《电针治疗仪产品注册审查指导原则》,全文如下:
电针治疗仪产品注册审查指导原则
本指导原则旨在指导注册申请人对电针治疗仪产品注册申报资料的准备及撰写,同时也为技术审评部门提供参考。
本指导原则是对电针治疗仪产品的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料,还应遵循相关法规。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围
本指导原则适用于电针治疗仪产品的注册申报。按照YY0780标准中3.1的定义,本指导原则中所述的电针治疗仪产品,是指通过电针给患者进行治疗和辅助治疗的仪器。在《医疗器械分类目录》中分类编码为20中医器械-02中医治疗设备-01穴位电刺激设备,管理类别Ⅱ类。
通过经皮导电电极片对患者经络、穴位或特定点进行无创电刺激的产品,不适用本指导原则,若产品有多个功能,本指导原则仅适用于其电针的功能部分或单元。
二、注册审查要点
(一)监管信息
1.产品名称的要求
产品的命名应参考《医疗器械通用名称命名规则》和国家标准、行业标准上的通用名称要求。产品名称应以体现产品的工作原理、技术结构特征、功能属性为基本准则。不应采用预期病症和治疗效果等。
建议产品名称规范为:电针治疗仪。
2.注册单元划分的原则和实例
注册单元按照《医疗器械注册与备案管理办法》第一百一十一条的要求“医疗器械注册或者备案单元原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据”进行划分,并结合《医疗器械注册单元划分指导原则》进行考虑。
(二)综述资料
1.产品的结构和组成
产品通常包含主机和附件,若产品电源外置还包含外置的电源适配器。从输出形式上,产品可分为单通道和多通道,即一路输出和多路输出。
产品主机通常包含波形(信号)发生单元、信号控制和定时单元、输出幅度提升单元、输出强度调节单元、输出端子以及内部电源(若有)。产品结构示意图见图1。
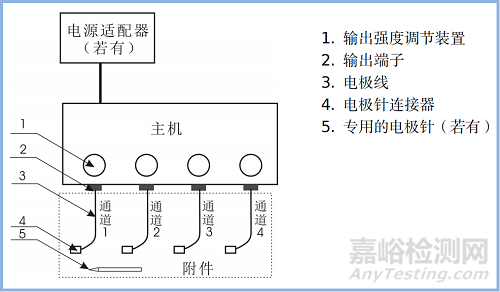
图1 电针治疗仪结构示意图
附件通常为电极线和电极针连接器,其中电极线和电极针连接器也可一体。若产品的电极针为专用针,则附件还包含有电极针。若产品附件不含电极针,还应明确可配用电极针的要求。
2.产品工作原理/作用原理
2.1工作原理
产品从内部功能原理来看,是一台单通道或多通道,带输出幅度调节装置的脉冲信号发生器,产品的功能原理框图见图2。
控制单元是产品的核心,控制单元产生基本的脉冲波形式、控制脉冲的频率和脉冲宽度、控制脉冲的输出模式、控制定时治疗的时间,同时接收保护取样单元反馈的信号,以判断是否出现异常而关断输出,控制单元可控制单一通道也可控制多个通道。
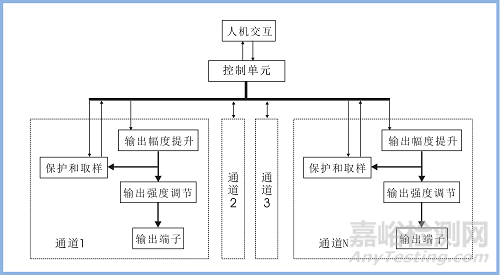
图2 产品的功能原理框图
人机交互单元包含输出端和输入端。输出端,可显示设备的输出状态和工作参数的状态,通常可由显示屏、数码管和指示灯组成。输入端,是对设备进行参数设定或调整以及工作或暂停的控制端,通常可由按键、旋钮和触摸屏组成。
输出幅度提升单元,其作用是将控制单元产生的仅有几伏的脉冲幅度电压提升至几十伏,此单元也可称之为功率放大单元。
输出强度调节单元,其作用是控制输出的强度,可以无级调节输出脉冲的幅度从最小到最大,也可有步长的分段调节。
取样保护电路的作用是获取输出短路、开路或意外输出的异常信号,将其发送给控制单元。
输出端子是主机连接电极线的装置。
产品可以单通道或多通道,各通道间相互独立,功能可相同,通道之间输出参数独立可控。
2.2主要作用机理
中医对病症和治疗的视角是多维的且存在地域、时域和派属差异,对电针疗法的机理也是如此。以下例举出一种机理参考。申请人可以从中医的其他研究角度给出有依据的并和注册产品相一致的产品机理。
电针疗法即针刺穴位获得针感后,在针上通以微量电流,以针刺和电的双重刺激,疏通经络,治疗疾病的一种治疗方法。人体组织是由水、无机盐和带电生物胶体组织组成的复杂的电解体。当一种波形、频率不断变换的电流作用于人体时,组织中的粒子会发生定向运动,消除细胞膜极化状态,使离子浓度和分布发生显著变化,这是电针治疗的电生理基础[1]。
选择不同治疗参数在对不同疾病的治疗或镇痛过程中有着因果关系。脉冲电刺激条件包括五个因素:波形的形态、频率、脉宽、幅度和组合模式。
常用的波形形态如下:(并不限于此二种波形)
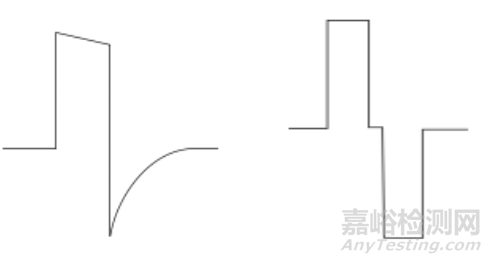
有负向反冲的矩形波,负向反冲可视为尖波。
双向矩形波。
常用的脉冲组合模式见图3(并不限于以下模式)。
连续模式是连续按同一频率输出;断续模式是时有时无周期性输出、疏密模式是按两种不同频率周期性输出,除这三种基本模式以外,还有程序模式,程序模式是制造商对产品的输出脉冲按频率、脉宽、幅度等参数进行的周期性或非周期性组合的一种模式。
脉冲幅度与治疗效果直接关联,幅度太小起不到治疗作用,幅度太强则完全没有必要,还会引起患者的不适也存在发生电击伤害的风险[2]。
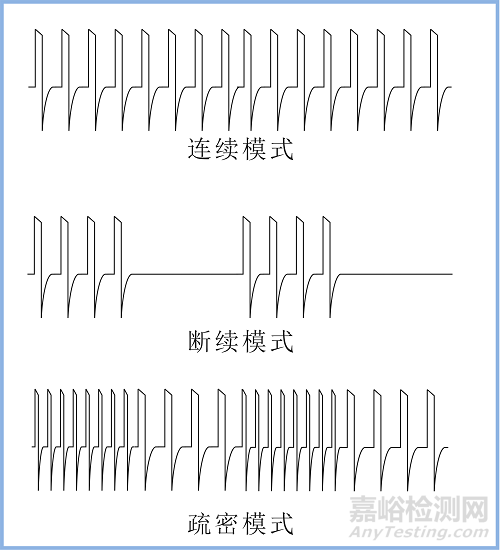
图3 常用的脉冲组合模式
3.产品的适用范围/预期用途、禁忌证
3.1适用范围
电针治疗仪适用范围应规范表述为:该产品在医疗机构中使用,在现有中医理论和实践基础上,供人体进行低频电脉冲针灸治疗。具体适应证应在适用范围中予以明确。
3.2禁忌证(不限于)
有严重心脏病的患者应谨慎使用,使用前医生应评估电刺激对心脏可能造成的不利影响;对心脏周围禁止使用电针刺激;对安装有源植入物(如心脏起搏器)的患者禁止使用;皮肤破损处、肿瘤局部、妊娠妇女腹部、颈动脉窦附近禁止电针使用。普通针灸的禁忌证同样适合电针疗法。
4.产品的不良事件历史记录
发生过针体断裂(断针)的不良事件。内容如下:
一次性使用针灸针是用于按一定的穴位刺入患者体内,并通过捻转、提插等手法治疗疾病的器具。一般由针体和针柄组成。
国家药品不良反应监测中心既往监测数据表明,一次性使用针灸针存在超适应症使用的风险,部分医疗机构将一次性使用针灸针连接电针仪进行针灸治疗,通电使用后出现针灸针在患者体内断裂的不良事件,需手术才能取出患者体内的断针。建议医疗机构按照产品说明书正确、规范使用一次性使用针灸针。同时,生产企业应就产品适用范围、临床注意事项、操作要点等方面内容加强对医护人员的操作培训。
申请人应关注并收集同类产品以及申报产品注册周期内的不良事件历史记录。申请人应当明确配用针的要求,并进行充足验证,清楚告知用户,进行必要的培训。
(三)非临床资料
1.产品风险管理资料
应符合YY/T 0316《医疗器械 风险管理对医疗器械的应用》的有关要求,审查要点包括:
1.1与产品有关的安全性特征判定可参考YY/T 0316《医疗器械 风险管理对医疗器械的应用》的附录C。
1.2危险(源)、可预见事件序列、危险情况及伤害处境判断可参考YY/T 0316《医疗器械风险管理对医疗器械的应用》附录E、I。
1.3风险控制的方案与实施、综合剩余风险的可接受性评价及生产和生产后监视相关方法可参考YY/T 0316《医疗器械风险管理对医疗器械的应用》附录F、G、J。
以下依据YY/T 0316《医疗器械风险管理对医疗器械的应用》中附录E(表E.1)从各方面列举了电针治疗仪产品的危险(源)分析。
表1 危险(源)、可预见事件序列、危险情况及伤害示例
|
危险(源) |
可预见的事件序列 |
危险情况 |
伤害 |
|
电磁能量(线电压) |
电极线无意地插入了网电源插座 |
网电压出现在针上 |
严重烧伤、心脏颤动、死亡 |
|
电磁能量(ESD) |
产品的信号发生和强度控制出现故障 |
产生了高能量的脉冲输出 |
造成电击伤害 |
|
机械能量 |
电极线过粗过硬 |
将针拉偏、拉断,造成与临近的针短路,造成能量意外叠加 |
针刺部位发生变化,造成无效或危险; 造成电击伤害 |
|
电极针连接器夹持力不足 |
电极针连接器脱落触碰其它针或患者身体其它部位 |
造成电击伤害; 治疗无效; |
|
|
化学的(电腐蚀) |
电针仪输出的直流分量使针发生电化学腐蚀 |
发生断针 |
针的断体部分留在患者体内 |
|
功能(不适当输出) |
新电池电压过高或充电后电池电压过高 |
产生了高能量的脉冲输出 |
造成电击伤害 |
|
使用错误 (不遵守规则) |
不适当的操作说明和产品维护保养 |
非专业医生使用;没有使用说明书和技术说明书,或其内容不全。如缺少必要的警告说明、缺少详细的使用方法、缺少必要的技术参数、缺少电路图和元器件清单、缺少运输和贮存环境条件的限制、缺少产品维护保养要求。设备在单一故障状态下运行 |
产生危险;产品损坏 |
|
产品附件(电极针)有效期标识不清晰 |
患者接触到过期有菌产品 |
感染,严重时导致死亡 |
|
|
一次性使用的针被意外的重复使用 |
表面氧化导电性差 |
治疗无效或疗效变差 |
|
|
发生断针 |
针的断体部分留在患者体内 |
||
|
输出短路或开路 |
电针的电刺激变强或者没有 |
造成刺激能量过大或者治疗无效 |
|
|
使用时未将所有输出幅度设定为最小值,输出幅度调节过快过大 |
突然的大能量输出(大脉冲幅度) |
造成刺激能量过大,患者不适,发生电击损伤。甚至引起患者肌肉强烈收缩,引发疼痛、弯针、断针或晕针等意外 |
|
|
不正确的产品贮存条件和产品维护保养。 |
器件老化、部件寿命降低 |
产品寿命降低 |
|
|
功能丧失或变坏 |
电极线老化 |
产品的输出无法加载至针上 |
无效治疗 |
|
电极针连接器老化 |
无法与针可靠导电连接 |
2.产品技术要求应包括的主要性能指标
不同的电针治疗仪产品其参数根据设计要求会有所区别。本指导原则列出此类产品可能涉及的重要性能参数,注册申请人可根据自身产品的技术特点制定性能指标的具体要求。若产品具有其他部件或功能,应符合相应国家标准和行业标准要求。
2.1产品技术指标应满足标准YY0780的要求。其中“4.12环境试验要求”无需在产品技术要求中载明,环境试验应在研究资料中提交。
2.2其他性能指标
2.2.1应给出波形形态描述;脉冲频率;脉冲宽度;脉冲组合模式;输出电压或电流的范围。
2.2.2应按照《医疗器械软件注册审查指导原则》明确软件的功能、使用限制、接口、访问控制、运行环境(若适用)、性能效率(若使用)等要求。
2.2.3如含有无菌附件,应明确无菌的要求。若采用环氧乙烷灭菌,应明确残留量要求。
2.2.4安全要求
应符合GB 9706.1和YY9706.210(YY0607)的要求。
2.2.5电磁兼容
应符合YY9706.102(YY0505)和YY9706.210(YY0607)的要求。
3. 检验用产品确定原则和实例
检验用产品应当能够代表申请注册产品的安全性和有效性,应充分考虑产品功能、结构组成、控制方式及其他风险等方面;代表产品应是功能最齐全、结构最复杂、风险最高的产品。
注册单元内各型号的主要安全指标、性能指标不能被代表型号全部涵盖时,则应选择涵盖安全指标、性能指标最多的产品作为代表产品,同时还应考虑其他型号中未被代表型号所涵盖的安全指标及性能指标。
与性能和安全项目关注点不同,电磁兼容方面的典型性产品应充分考虑注册单元内不同型号之间电磁兼容特点和差异。
表2 检验用产品确定实例
|
检验产品(典型型号) |
可覆盖的产品(型号) |
|
|
按输出波形 |
有连续波、断续波、疏密波、特定程序组合波、针刺手法多种输出波形的产品。 |
具备连续波、断续波、疏密波、特定程序组合波、针刺手法中的一种或数种任意组合的产品。 |
|
按输出通道 |
多通道输出的产品,通道数为N |
通道数在1到N-1之间的产品 |
|
按电源形式 |
具有网电源和内部电源两种供电模式的产品 |
单一网电源供电、单一内部电源供电的产品 |
4.研究资料
应按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》要求提交研究资料。
4.1化学和物理性能研究
应当提供产品化学/材料表征、物理和/或机械性能指标的确定依据、设计输入来源以及临床意义,所采用的标准或方法、采用的原因及理论基础。比如,应明确脉冲波形、频率、幅度等参数设计的依据。
如申报产品预期与普通针灸针联合使用,应当提供证明联合使用安全有效的研究资料。
该产品向患者提供电能,应提供量效关系和能量安全性研究资料,提供证明治疗参数设置的安全性、有效性、合理性,以及能量不会对正常组织造成不可接受的伤害的研究资料。
4.2电气系统安全性研究
应当提供电气安全性、机械和环境保护以及电磁兼容性的研究资料,说明适用的标准以及开展的研究。
4.3软件研究
软件安全级别应为至少为B级,按照《医疗器械软件注册技术审查指导原则》的要求提交软件研究资料。
对于具有网络连接功能以进行电子数据交换、远程监测或采用存储媒介以进行电子数据交换产品,还应当按照《医疗器械网络安全注册技术审查指导原则》的要求单独提交一份医疗器械网络安全研究报告。
4.4生物学特性研究
对于与患者直接或间接接触的产品附件,应当按GB/T 16886.1规定的原则进行生物相容性评价。
生物相容性评价研究资料应当包括:生物相容性评价的依据和方法;产品所用材料的描述及与人体接触的性质;实施或豁免生物学试验的理由和论证;对于现有数据或试验结果的评价。
电极针为短期接触患者组织,如需做生物学评价试验,应对其细胞毒性、致敏、皮内反应进行评价试验。
4.5清洁、消毒、灭菌研究
4.5.1使用者清洁和消毒:应当明确推荐的清洗和消毒工艺(方法和参数)、工艺的确定依据以及验证的相关研究资料。电极线和电极针连接器建议低水平消毒。
4.5.2电极针的灭菌研究
4.5.2.1生产企业灭菌:应当明确灭菌工艺(方法和参数)和无菌保证水平(SAL),并提供灭菌验证及确认的相关研究资料。
4.5.2.2使用者灭菌:应当明确推荐的灭菌工艺(方法和参数)、所推荐灭菌工艺的确定依据以及验证的相关研究资料;对可耐受两次或多次灭菌的产品,应当提供产品所推荐灭菌工艺耐受性的研究资料。
4.5.3 残留毒性:如灭菌使用的方法容易出现残留,应当明确残留物信息及采取的处理方法,并提供研究资料。
4.6稳定性研究
4.6.1有效期
产品主机的有效期参见《有源医疗器械使用期限技术审查指导原则》的相关要求。
无菌有效期验证试验可采用加速稳定性试验和实时稳定性试验,企业需在试验方案中设定检测项目、检测方法及判定标准。产品附件无菌有效期验证资料可包括以下内容:产品附件原材料/组件、包装材料、生产工艺、灭菌方法、储存运输条件等基本信息,有效期相关影响因素的说明,稳定性试验的试验方案及试验报告等。
鉴于不良事件历史记录中显示电极针的重复使用容易导致断针。注册申请人应对电极针重复使用次数进行严格限定和充分得研究。对于多次重复使用的电极针,有效期验证除了考虑灭菌影响外,还应考虑电流热效应、使用手法等多重因素的影响。
4.6.2 使用和运输稳定性
建议按照GB/T14710的规定执行。
医用电器环境要求是评价产品在各种工作环境和模拟贮存、运输环境下的适应性,一般认为属于稳定性评价项目。可以制定不同的气候环境条件和机械环境条件来进行试验,或通过对关键部件的试验来评价整机的情况,也可以通过已上市同类产品比对方式进行判断。
4.7一次性使用的医疗器械要求
对于一次性使用的电极针,还应当提供证明其无法重复使用的支持性资料。
(四)临床评价资料
电针治疗仪的临床评价应遵循该类产品研发的基本规律以及中医理论和实践,通过科学的过程来评估产品临床疗效和潜在风险,最终确定产品在预期用途下的安全性和有效性,并为产品使用说明书的撰写提供依据。
申请人可参考《医疗器械临床试验质量管理规范》《医疗器械临床评价技术指导原则》《医疗器械等同性论证技术指导原则》《决策是否开展医疗器械临床试验技术指导原则》等相关要求开展中医灸疗设备的临床评价。建议申请人结合中医灸疗设备的风险和受益,选择合理的临床评价路径,论证其临床应用的安全有效性。
若通过同品种临床评价路径进行临床评价,应当《医疗器械临床评价等同性论证技术指导原则》提交申报产品与同品种医疗器械在适用范围、技术特征、生物学特性方面的对比资料;技术特征重点关注工作原理、结构组成、波形的形态、频率、脉宽、幅度和组合模式的等同性。应当对同品种医疗器械的临床数据进行收集、评估和分析,形成临床证据。如适用,应当描述申报产品与同品种医疗器械的差异,提交充分的科学证据证明二者具有相同的安全有效性。
若通过临床试验路径进行临床评价,则需严格按照《医疗器械临床试验质量管理规范》进行临床试验,应当提交临床试验方案、临床试验机构伦理委员会同意开展临床试验的书面意见、临床试验报告、知情同意书样本,并附临床试验数据库(原始数据库、分析数据库、说明性文件和程序代码)。
(五)产品说明书和标签样稿
1.产品说明书
1.1应当提交产品说明书,内容应当符合《医疗器械说明书和标签管理规定》和相关法规、规章、规范性文件、强制性标准(如:GB 9706.1、YY 9706.102、YY 9706.210)的要求。
1.2关于电针治疗仪产品,使用说明书还应给出产品的适用范围/预期用途、禁忌证等以下内容:
1.2.1电针治疗仪产品说明书的特别要求
1.2.1.1明确电针治疗仪无直流分量输出。
1.2.1.2应有要求使用者特别注意的建议∶
1.2.1.2.1说明电针治疗仪的适用症和禁忌证,说明电针治疗应由专业针灸医师进行;
1.2.1.2.2应与专用电极针或经验证的可与该产品配用的针灸针配合使用;
1.2.1.2.3列出适合本产品使用的电极针规格型号清单,并警告使用者;当电极针有弯曲变形、表面氧化、锈蚀、污渍时,不得使用;
1.2.1.2.4警告使用者哪些误操作有可能造成引起肌肉强烈收缩,弯针、断针或晕针的现象;
1.2.1.2.5警告使用者应避免电流回路通过心脏;近延髓、脊髓区使用电针时,电流强度宜小,以免发生意外;靠近胸部使用电极针增加心脏纤颤的危险;
1.2.1.2.6如输出电流超过2 mA(r.m.s),应有要求使用者特别注意的建议。
1.2.1.2.7明确在整个负载阻抗范围上的最大输出电流有效值曲线,且应至少包括250Ω、500Ω和1000Ω时的数据。
1.2.1.2.8应严格按照说明书中电极针使用次数的限制规范使用,一次性使用电极针不可重复使用。
1.2.2使用说明书中的注意事项
1.2.2.1普通针灸的注意事项同样适合电针疗法,电针治疗时会产生肌肉收缩,事先应告诉患者,让其思想上有所准备;
1.2.2.2电针治疗时的输出强度应逐渐从小到大,不要突然增大,避免患者突然的强烈的应激反应而造成弯针、断针甚至是患者晕针或晕厥;
1.2.2.3电针治疗时应避免电流回路经过心脏,在临近延髓、脊髓等部位时,切不可做强刺激,以免意外;
1.2.2.4建议使用一次性电极针。同一位患者曾作为温针使用的针灸针,因其针柄可能氧化以致导电不良。
1.2.2.5无菌提供的“电极针”应当注明灭菌方式,以及“无菌”、“一次性使用”字样或符号,禁止重复使用。应有“使用前检查包装是否完好,如发现初包装破损,严禁使用”相关内容;应有“使用前应确认使用期限,禁止超期使用”相关内容。
1.2.3说明书中需明确禁忌证:
1.2.3.1有严重心脏病的患者应谨慎使用,使用前医生应评估电刺激对心脏可能造成的不利影响;
1.2.3.2对心脏周围禁止使用电针刺激;
1.2.3.3对安装有源植入物(如心脏起搏器)的患者禁止使用;
1.2.3.4皮肤破损处、肿瘤局部、妊娠妇女腹部、颈动脉窦附近禁止电针;
1.2.3.5普通针灸的禁忌证同样适合电针疗法。
2.标签样稿
应当提交最小销售单元标签样稿,内容应当符合《医疗器械说明书和标签管理规定》和相关法规、规章、规范性文件、强制性标准的要求。
3.其他资料
如适用,提交对产品信息进行补充说明的其他文件。
三、参考文献
[1].乔志恒,范维铭.物理治疗学全书[M].北京.科学技术文献出版社.2001.
[2]奚永江.针法灸法学[M].上海.上海科学技术出版社. 1985.
[3]医疗器械监督管理条例[Z].
[4]医疗器械注册与备案管理办法[Z].
[5]医疗器械说明书和标签管理规定[Z].
[6]医疗器械分类规则[Z].
[7]医疗器械通用名称命名规则[Z].
[8]医疗器械分类目录[Z].
[9]医疗器械注册单元划分指导原则[Z].
[10]有源医疗器械使用期限注册技术审查指导原则[Z].
[11]医疗器械网络安全注册技术审查指导原则[Z].
[12]医疗器械软件注册技术审查指导原则[Z].
[13]医疗器械临床评价技术指导原则[Z].
[14]医疗器械临床试验质量管理规范[Z].
[15]GB 9706.1,医用电气设备第1部分:安全通用要求[S].
[16]GB 9706.203,医用电气设备第2—3部分:短波治疗设备的基本安全和基本性能专用要求[S].
[17]GB/T 14710,医用电器环境要求及试验方法[S].
[18]GB/T 16886.1,医疗器械生物学评价第1部分:风险管理过程中的评价与试验[S].
[19]YY/T 0316,医疗器械风险管理对医疗器械的应用[S].
[20] YY 9706.102,医用电气设备 第1-2部分:基本安全和基本性能的通用要求 并列标准:电磁兼容 要求和试验[S].

来源:国家药监局


