您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-08-26 11:10
|
Section Number 章节 |
General overview 概述 |
|
1. Scope 范围 |
Includes additional areas (other than sterile products) where the general principles of the annex can be applied. 包括可适用本附录一般原则的其他领域(其他非无菌产品外)。 |
|
2. Principle 原则 |
General principles as applied to the manufacture of sterile products. 适用于无菌产品生产的一般原则。 |
|
3. Pharmaceutical Quality System (PQS) 药品质量体系(PQS) |
Highlights the specific requirements of the PQS when applied to sterile products. 重点介绍 PQS 在应用于无菌产品时的具体要求。 |
|
4. Premises 厂房 |
General guidance regarding the specific needs for premises design and also guidance on the qualification of premises including the use of Barrier Technology. 关于厂房设计的具体要求,以及关于厂房确认的指导,包括使用隔离技术。 |
|
5. Equipment 设备 |
General guidance on the design and operation of equipment. 关于设备设计和操作的一般指导。 |
|
6. Utilities 公用系统 |
Guidance regarding the special requirements of utilities such as water, gas and vacuum. 有关水,气和真空等公用系统特定要求的指南。 |
|
7. Personnel 人员 |
Guidance on the requirements for specific training, knowledge and skills. Also gives guidance regarding the qualification of personnel. 关于特定培训,知识和技能要求的指导。还就人员确认提供了指导。 |
|
8. Production and specific technologies 生产和特定技术 |
Guidance on the approaches to be taken regarding aseptic and terminal sterilization processes. Guidance on the approaches to sterilization of products, equipment and packaging components. Also guidance on different technologies such as lyophilization and Form-Fill-Seal where specific requirements apply. 关于无菌和终末灭菌工艺应采取的方法的指南。关于产品、设备和包装部件灭菌方法的指南。还不同技术,如冻干和成型-灌装-密封,的特定要求提供指导。 |
|
9. Environmental and process monitoring 环境和过程监测 |
This section differs from guidance given in section 4 in that the guidance here applies to ongoing routine monitoring regarding the design of systems and setting of action limits alert levels and reviewing trend data. The section also gives guidance on the requirements of Aseptic Process Simulations (APS). 本节与第 4 节中给出的指导不同,因为此处的指南适用于有关持续日常监测的系统设计和行动限/警戒限设置以及趋势数据回顾。 本节还就无菌工艺模拟(APS)的要求提供了指导。 |
|
10. Quality control (QC) 质量控制(QC) |
Guidance on some of the specific Quality Control requirements relating to sterile products. 关于无菌产品的一些具体质量控制要求的指南。 |
|
11. Glossary 术语 |
Explanation of specific terminology. 具体术语的解释。 |
Deadline for coming into operation:
生效时间:
25 August 2023 : one year from the date of publication in Eudralex Volume 4
2023 年 8 月 25 日:发布之日起一年后生效(除8.123节外)
25 August 2024 : two years from the date of publication in Eudralex Volume 4 for point 8.123
2024 年 8 月 25 日:发布之日起两年后第 8.123 节生效
解读:
关于隔离器的背景环境:对于开放式隔离器,要求背景环境至少达到C级,不再允许D级背景。
4.20 ...The background environment for open isolators should generally correspond to a minimum of grade C. The background for closed isolators should correspond to a minimum of grade D. The decision on the background classification should be based on risk assessment and justified in the CCS.
开放式隔离器的背景环境通常应符合C级的最低要求。密闭式隔离器的背景应与最低 D 级相对应。关于背景级别的决定应以风险评估为基础,并在CCS中说明理由。
要求A级(RABS)使用杀孢子剂:
4.22 ... For RABS:The sporicidal disinfection should include the routine application of a sporicidal agent using a method that has been validated and demonstrated to robustly include all areas of the interior surfaces and ensure a suitable environment for aseptic processing.
对于RABS:应包括杀孢剂的日常使用,使用经验证和证明可有效涵盖RABS内表面的所有区域,并确保用于无菌处理的合适环境的方法。
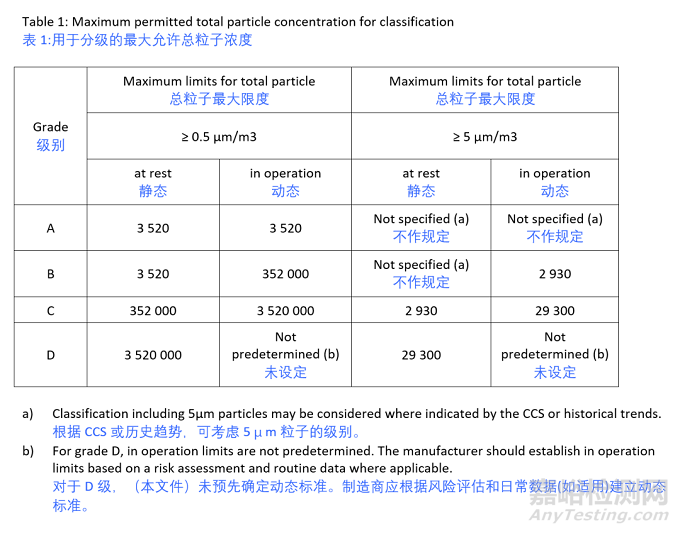
对于洁净室分级,对于A级动态、静态以及B级静态,正式确定对5 µm粒子不做规定,对于D级动态粒子标准,文件未设定标准,但要求制造商应根据风险评估和日常数据(如适用)建立D级的动态标准。

来源:GMP办公室学习平台


