您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-08-17 13:56
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》、国务院《关于改革药品医疗器械审评审批制度的意见》,鼓励医疗器械研发创新,促进医疗器械新技术的推广和应用,推动本市医疗器械产业高质量发展,《上海市第二类创新医疗器械特别审查程序》(沪药监规〔2020〕2号)自2020年2月4日发布实施。
申请人应当如何准备申请资料?审查程序是什么?
一、申请范围
本市第二类创新医疗器械特别审查仅适用于《医疗器械注册与备案管理办法》、《体外诊断试剂注册与备案管理办法》所明确的第二类医疗器械产品注册,不适用于变更注册或者延续注册。
二、申请条件
符合下列情形的拟在本市申请注册的第二类医疗器械:
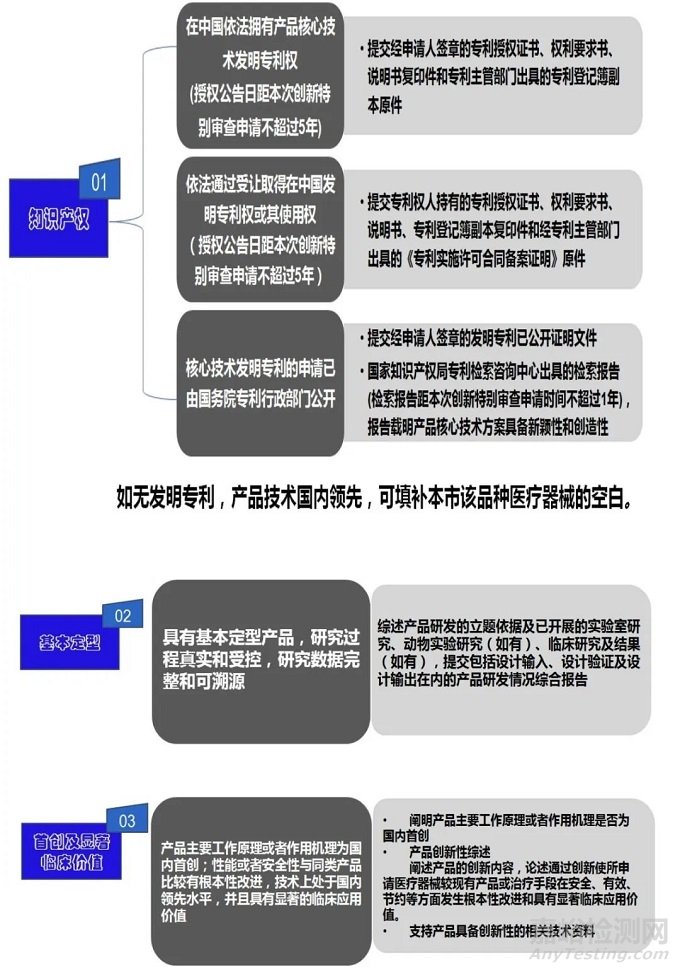
(一)产品主要工作原理或者作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国内领先水平,且具有显著的临床应用价值。
(二)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
(三)申请人通过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权,创新特别审查申请时间距专利授权公告日不超过5年;或者核心技术发明专利的申请已由国务院专利行政部门公开,并由国家知识产权局专利检索咨询中心出具检索报告,报告载明产品核心技术方案具备新颖性和创造性;或者产品技术国内领先,可填补本市该品种医疗器械的空白。
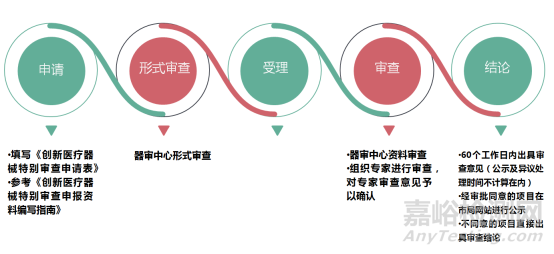
三申请与审查程序
四、申请资料
执行上海市药品监督管理局制定的《上海市第二类创新医疗器械特别审查申报资料编写指南(试行)》。

来源:上海器审


