您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-08 14:19
摘 要:在药品生产企业的质量管理中,产品质量回顾涉及质量控制、质量保证和质量改进。部分药品生产企业未能有效开展产品质量回顾,导致在药品异常质量趋势识别、药品质量的持续改进和质量管理水平的不断提升方面存在不足。通过对国内外关于药品质量回顾的法规进行梳理,明确了有效开展药品质量回顾的要点:程序文件规定、回顾频次、回顾内容、统计分析方法、回顾问题的识别与分析、回顾结论、质量回顾报告的审核与管理,并对产品质量回顾检查中常见问题进行了分析。
质量管理是在质量方面指挥和控制组织的协调的活动,包括制定质量方针和质量目标以及质量策划、质量控制、质量保证和质量改进。在药品生产企业的质量管理中,产品质量回顾涉及质量控制、质量保证和质量改进3 个方面。产品质量回顾是药品生产企业定期回顾分析与产品相关的一系列的生产和质量数据,评价产品生产工艺的一致性,分析相关物料和产品标准的适用性,以识别其趋势,并对不良趋势加以控制,进而确保产品工艺稳定可靠,符合质量标准规定,并为持续改进产品质量提供依据的质量活动[1]。产品质量回顾在识别并发现异常质量趋势、持续提升药品质量方面起着重要的作用[2],也是各国药品监管机构、国际组织颁发的《药品生产质量管理规范》(GMP)中规定必须开展的内容之一。然而,近年来在全球药品监管或检查机构对药品生产企业的检查中发现,产品质量回顾方面的问题仍较为集中[3-4]。部分药品生产企业未能有效开展产品质量回顾,导致在药品异常质量趋势识别、药品质量的持续改进和质量管理水平的不断提升方面存在不足,因此本文就如何有效开展产品质量回顾进行了分析和要点研究。
一产品质量回顾分析的法规要求
产品质量回顾是全球药品监管法律、法规中均规定在药品生产质量管理中必须开展的强制性质量活动。我国现行GMP正文(2010 年)第十章第8 节的名称即为“产品质量回顾分析”,其中明确了药品生产企业在开展产品质量回顾分析的基本要求、原则、内容和目的。世界卫生组织GMP 基本原则在药品质量管理体系章节中也明确规定了“产品质量回顾”的详细要求。美国联邦法令21CFR 第211部第180e(即CGMP)要求至少每年对药品进行质量回顾。欧盟GMP 第一部分药品基本要求中规定应定期或滚动式的开展质量回顾,并详细描述了回顾的内容、目的和基本要求。在人用药品注册技术要求国际协调会(ICH)和药品检查合作计划组织(PIC/S)等国际组织颁发的GMP(如ICH Q7a、PIC/S GMP 药品基本要求等)中也对产品质量回顾做出了明确、强制性的规定。整体上看,全球药品监管机构对产品质量回顾的要求是明确且基本一致的,要求药品生产企业必须定期进行产品质量回顾,且阐释了回顾的基本内容要求、拟达目的、要求。核心是评估确认当前生产工艺的一致性,物料与成品标准的适宜性,及时识别产品质量趋势和改进点,不断提升质量,保证持续质量改进。
二 产品质量回顾要点分析
在对产品质量回顾进行系统、详细的分析时,必须理解产品质量回顾是药品生产质量管理的一项活动,是在企业质量管理体系框架下开展的活动,是将多项药品质量管理关键数据、信息进行整合分析的活动,需要严格遵循质量管理体系中关于文件管理、数据可靠性的要求。通过对全球GMP规定和常见问题的梳理、分析,产品质量回顾的要点主要包括:程序文件规定、回顾频次、回顾内容、统计分析方法、回顾问题的识别与分析、回顾结论、质量回顾报告的审核与管理方面[5]。
2.1 产品质量回顾程序规定
产品质量回顾的程序文件必须详细规定目的、职责、依据、范围、分类原则(如按品种或品规)、频次、回顾内容、数据采集与审核流程、统计分析方法与标准、产品质量回顾报告的基本格式与审批时限要求、对当年未生产品种的质量回顾规定等。
回顾频次方面,至少每年对所有药品进行1次全面的质量回顾,建议每个季度进行1次监测性回顾,季度回顾与年度回顾相比,可以在回顾的内容和统计分析方式有所简化。此外,需要规定回顾的周期(如1~12 月)、界定要求(如是否应包括所有投料生产批次)。
回顾内容方面,可以从质量管理的质量实现、质量保证要素角度进行分类。质量实现要素中包括对产品基本情况、关键设备、设施及公用系统、物料(起始物料、辅料和包材)质量与供应商、生产工艺参数与过程控制、分析方法、成品检查结果、稳定性试验情况、与历史数据趋势对比情况等内容的回顾。质量保证要素中包括对应品种相关的各类偏差、变更控制、超标与超趋势结果、投诉、退货、不良反应、召回、委托协议等内容的回顾,见图1。
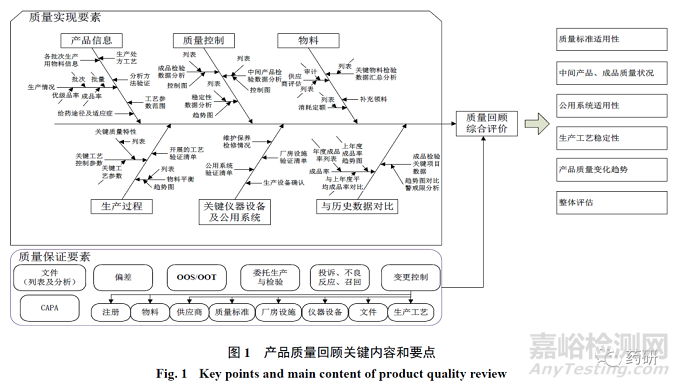
统计分析方法的有效应用是产品质量回顾的难点之一,需要基于实际生产情况、分析数据的类型选择有效的统计分析工具。产品质量回顾需要汇集大量的数据,但数据不等同于有用的信息,不对数据进行科学的分析,就不能保证分析结论的准确。目前在产品质量回顾分析中常见的分析方法和工具包括散点图、直方图、折线图、推移图、箱线图、控制图和过程能力分析。核心要点是明确不同统计分析方法和工具的适用情况(如正态分布要求)、应用方法(包括对应的统计分析软件的使用说明)、判定标准(如控制图判异原则、稳态的界定、统计控制状态的标准等)。
2.2 产品质量回顾的执行与回顾报告
在程序文件详细规定如何开展产品质量回顾的前提下,后续的重点就是程序的执行情况,确保按规定的频次采用适宜的统计分析方法对特定的内容进行回顾分析,其中重点关注问题的识别和分析、回顾结论、质量回顾报告的审核和管理。
问题识别分析、回顾结论必须与年度回顾的数据、统计分析中的显示情况一致,不能出现忽视异常趋势、弱化异常趋势的分析和处理的情况。基于统计分析得出明确的结论,为后续工作的开展提供指导,确认是否需要调整控制线或警戒限、是否需要开展工艺再验证、是否需要进行设施设备的维护和再确认等。
质量回顾报告的审核和管理中需要注意质量回顾报告必须作为受控的GMP 文件进行管理,必须做到有效的审核和审批,明确报告编写、审批的时限,保证报告内容的准确性,避免出现报告前后不一致、内容错误等问题。
三产品质量回顾检查常见问题
产品质量回顾直接显示了对应产品的质量状态,同时体现出该药品生产企业在文件与数据管理、质量保证各要素管理的情况,侧面反映出该企业质量管理能力和水平,有助于检查员在短时间内熟悉企业生产质量管理情况,是各类药品GMP 现场检查的重点和必查内容,也是世界卫生组织书面检查的重要评估文件[6]。通过对近年来国内外主要药品监管机构(包括国家药品监督管理局、世界卫生组织、美国食品药品监督管理局、欧洲药品监督管理局)在GMP 检查中关于产品质量回顾相关问题的研究,发现涉及产品质量回顾的缺陷约占5%,占质量保证部分缺陷的20%[3-4, 7-9],属于发现问题较多的环节。常见问题分析如下:
3.1 产品质量回顾的程序文件、执行情况方面
主要是规定不完善、未按程序规定开展产品质量回顾的问题。如未建立产品质量回顾文件、程序文件规定本年度未生产的产品不要求进行质量回顾(未考虑效期内产品质量变化、市场质量反馈),未规定质量回顾统计分析数据的采集、录入和审核程序,未对产品质量回顾起草、提交、批准的时限要求进行规定,未按程序规定进行趋势分析等。回顾过往检查情况,也发现个别企业存在尚未建立产品质量回顾程序文件的情况。如产品质量回顾程序文件规定过于简单,仅规定了产品质量回顾报告中需要的章节,但缺少细节信息,如需要回顾的产品批次是依据放行日期还是生产日期等。
3.2 回顾频次与周期方面
存在未按规定的频次(如每季度)进行回顾或后期进行了补回顾,对于流感疫苗等季节性品种回顾周期未考虑季节性因素,回顾频次未能及时发现风险信号等。如规定每年生产30 批及以上才进行产品年度质量回顾缺少合理依据。
3.3 回顾内容方面
主要是回顾内容不全面,如回顾内容未包括:种子批系统在内的上游工艺数据和总结、灯检等部分工序数据、生物负荷等部分中控数据、不合格半成品批和成品批、已生产但尚未放行的批次、个别超标事件、培养基模拟灌装试验、稳定性试验结果分析、产量和收率、种子批监测情况、关键起始物料情况、分析检测结果趋势、纠正和预防有效性评估、对技术协议有效性的审核(包括关键起始物料、稀释剂供应商)、对异常趋势(包括拒收率等)的详细分析和说明、未与上1 个年度回顾数据进行对比分析。此外,也存在质量回顾未基于风险原则识别关键质量参数与关键质量属性,未对制药用水系统、空调系统、纯蒸汽系统进行质量回顾等问题。如2016 年某产品的质量回顾报告存在以下不足:未评估中间产品除菌滤过前的生物负荷、未对全年发生的77 个偏差进行任何分析、未评估之前与供应商签订的质量协议的审查情况。
3.4 统计分析方法的应用方面
涉及使用的统计分析方法不科学、不合理,难以有效识别质量趋势、异常情况,如关键指标未进行过程能力指数分析、未规定过程能力指数的计算方式和标准;使用Excel 计算警戒限、行动限且计算情况未能记录、计算表格未经验证;使用的统计方法不适用于分析的数据(涉及数据量、数据分布情况);未按文件规定进行趋势分析等。如程序规定要求计算过程能力指数,但缺少如何计算过程能力指数的程序。
3.5 回顾问题识别分析与回顾结论方面
常见问题包括:(1)为了完成质量回顾而进行质量回顾,未将确认现有工艺的一致性和原材料、成品标准的适当性,以及突出任何趋势并确定产品和工艺改进方向作为质量回顾的目的。(2)通过对质量回顾报告的检查发现企业在部分偏差、投诉、纠正、预防措施的具体事例的处理存在不足。(3)质量回顾中对于异常情况、趋势未进行分析评估或分析评估不充分,包括关键质量属性的异常趋势(如超过警戒限或行动限、过程能力指数值小于1.33)、不同分包商产品质量数据的差异等。(4)质量回顾结论与实际数据不符,实际数据已显示出异常情况,评估结论却描述全面质量无异常情况。(5)未基于回顾情况调整限度标准(包括警戒限度、行动限度)。如2015 年某产品蛋白质含量中控分析显示为C 级(过程能力指数在0.67~1.00,表示加工能力差),未进行分析、调查。
3.6 产品质量回顾报告方面
存在负责产品质量回顾报告撰写、审核的资源不足(如多个报告审核人员在一天内完成审核并签字),难以保证关键信息的一致性,无法有效分析趋势,难以识别工艺、产品改进内容,产品质量回顾报告内容存在错误(如回顾报告内容前后存在冲突、结论与数据趋势不符、个别关键工艺参数、关键质量属性错误)。同时部分企业的产品质量回顾报告不属于受控文件,缺少报告编号和有效的管控方式。如某产品在2015 年度质量回顾中描述共发生了8 个超标结果,但是在附件24 里却列出了28个超标结果,报告中描述共发生6 个投诉,但是在附件18 中仅仅有5 个投诉。
四结语
产品质量回顾在识别产品趋势、持续提升药品质量方面起着重要作用,也体现出企业在数据管理、质量保证、文件管理、统计分析技术、资源匹配、质量文化等多个方面的能力和可能存在的问题,是企业质量保证系统中证实性、预防性和系统性的汇集点。美国食品药品监督管理局提出的质量量度的所有指标(批次接受率、无效OOS 率、产品质量投诉率)均包含或源自产品质量回顾[10],可以说产品质量回顾是企业保证产品质量、持续提高质量管理体系的重要手段。药品生产企业可以参照产品质量回顾要点,结合药品检查常见缺陷进行对照分析,进一步提升产品质量回顾工作,更好地保证产品质量。在药品检查中,可以从产品质量回顾作为切入点,整体掌握企业对应产品质量情况和趋势,同时对企业质量管理中可能存在的问题进行分析,确定后续检查的重点内容和方向,基于风险研判更有效地开展检查工作。

来源:Internet


