您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-28 15:42
膝关节骨性关节炎是一种以关节软骨进行性病变和关节疼痛为特征的慢性疾病,是世界范围内最常见的关节炎,其发病率逐年上升。膝关节骨性关节炎治疗的两个早期干预目标是减轻膝关节的疼痛和关节软骨的损害。目前用于治疗膝关节骨性关节炎的方法虽取得了一定疗效,但仍没有一种方法可达到全膝关节置换术的治疗效果。当前,结合生物材料学、干细胞科学、发育生物学和物理力学的创新性再生工程干预方法将有望用于治疗膝关节骨性关节炎。
中国工程院院刊《Engineering》2017年第1期刊发《膝关节骨性关节炎治疗的再生工程:生物材料以及基于细胞的技术》一文,讨论了膝关节骨性关节炎疼痛及软骨损害的发病机制,介绍了当前治疗该病的生物材料和细胞疗法的具体策略及面临的挑战。文章指出,针对膝关节骨性关节炎,应用生物材料和细胞的新治疗策略在临床前与临床研究中均显示出强大的潜力,针对面临的挑战,可通过再生工程开发创新性策略予以解决。
一、引言
骨性关节炎(OA)是一种以关节软骨进行性病变和关节疼痛为特征的慢性疾病,是世界范围内最常见的关节炎。OA是一种复杂的疾病,其病变累及包括关节软骨、滑膜和软骨下骨在内的整个滑膜关节。该病发病后,促炎因子的释放导致关节结构紊乱(图1)。重要的是,OA是关节炎患者由于疼痛致残的首要原因,约70%住院的关节炎患者和23%门诊就诊的关节炎患者患有膝关节OA。膝关节的解剖位置决定了它承受着身体大部分的重量,使得膝关节OA成为OA的最常见类型。50岁以上的老年人患膝关节OA的风险增高,其可能的原因是激素水平的改变或软骨细胞的老化。约1/3的美国成人存在肥胖问题,由于其膝关节负重增加或脂肪组织释放脂肪因子,因而这些人中的2/3在其一生中有患膝关节OA的可能。2008年,约有2700万的美国成人患有OA。2005年美国患有关节炎的成人数量为4780万,到2030年,预计这一数字将增长到6700万以上。由于《平价医疗法案》的实施,预计寻求医疗帮助的患者会进一步增多。每个膝关节OA患者每年的总治疗费用超过6000美元,终生治疗费用超过10万美元。这一数字只是官方统计结果,OA患者还有些额外的开销没有计算在内,如误工费和疼痛致残对生活质量的影响。因而OA是一个十分严重的健康问题,它不仅给患者带来了身体负担,也给患者和医疗保健系统带来了沉重的经济负担。
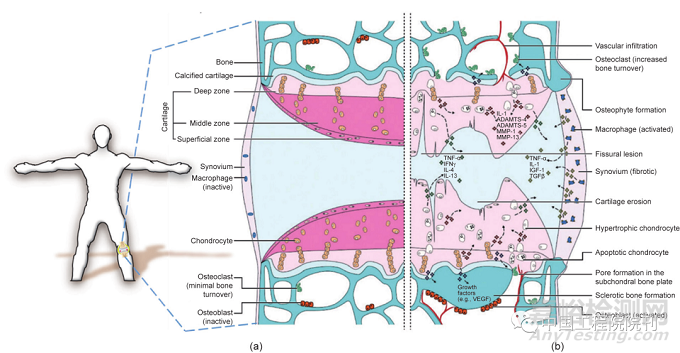
图1.健康关节与骨性关节炎(OA)关节间的结构差异。基质蛋白酶的表达在诱导OA中起重要作用。
膝关节OA的末期手术方案是全膝关节置换术(TKA)。TKA涉及由金属合金和聚合物制成的膝关节假体。对多数患者来说,该手术可以减轻疼痛,改善肢体功能和生活质量。然而,对于TKA失败的患者来说,翻修手术也十分常见。到2030年,预计TKA的需求量可达300万,这也使翻修手术的需求增加,这一数字在2005年时是45万。随着膝关节OA的患病率和治疗费用的增长,有必要探寻新的、侵袭性小的、性价比更高的治疗方法,从而减少或消除患者对TKA的需求。
在研究者的努力下,已经开发出具有不同成功率的手术干预方法。一个值得注意的创新方法是手术侵袭性较小的软骨下关节修复术,这一技术应用磷酸钙类骨替代材料治疗与末期膝关节OA进展相关的骨髓病变,从而预防严重的OA和代替TKA的应用。虽然该技术有这些益处,但仍有一些患者不愿接受这种治疗。此外,软骨下关节修复术仅能应用于治疗骨髓病变。因此,结合了生物材料学、干细胞科学、发育生物学和物理力学的创新性再生工程干预方法将有望用于治疗膝关节OA。“再生工程学”囊括了先进的材料科学、干细胞科学、物理学、发育生物学以及复杂组织和器官再生的临床转化。
在本综述中,我们旨在讨论膝关节OA的发病机制,以及当前治疗该病的基于生物材料和细胞的疗法。
二、骨性关节炎疼痛与治疗方法
疼痛是膝关节OA患者就诊的首要原因。这种疼痛在发生时可能并不伴有膝关节OA的影像学改变,是种钝痛,呈间歇性,以后逐渐加重。OA疼痛的发病机制复杂,包括一些可变和不可变因素。可变因素包括体重、结构破坏、生物因素(如炎症)和社会文化因素。不可变因素为患者遗传因素。我们在接下来的章节中讨论炎症、结构病理学(如软骨结构破坏)和其他因素对疼痛的影响。
(一)骨性关节炎疼痛
膝关节OA发病的生物机制尚不完全明了,且有个体差异。膝关节中的软骨细胞和其他类型细胞产生炎症介质和降解酶,导致细胞凋亡。如促炎性白细胞介素和肿瘤坏死因子α等细胞因子诱导炎症反应,这些细胞因子可被滑膜关节中的神经末梢受体识别,这一伤害性刺激可以激活高阈值(低敏感性)离子通道,导致疼痛信号从周围组织向中枢神经系统传播。骨关节炎关节中产生的细胞因子可作用于关节神经支配的伤害性感受器(有髓鞘或无髓鞘的感觉神经元,可将疼痛信号从周围组织传播至中枢神经系统),产生疼痛。虽然OA与疼痛频发有关,但其真正的作用机制尚未完全阐明。对疼痛机制的进一步研究有助于找到解决OA疼痛的新型治疗方法。
(二)骨性关节炎疼痛的治疗方法
膝关节疼痛是膝关节OA的主要症状,其治疗方法包括非药物和药物治疗。非药物治疗对于老年患者来说尤为重要,因其可以避免药物使用导致的并发症和较高的药物毒性反应的风险。非药物治疗包括物理治疗、休息、拐杖助行、冰支具和减重。美国风湿病学会和国际骨关节炎研究协会发布的膝关节OA管理指南强烈建议规律的运动锻炼减重是减轻OA疼痛的最佳方法。陆上和水中的运动训练是最主要的非药物治疗方法。陆上运动训练可暂时减轻疼痛、改善关节功能。一项纳入3537名参与者的44项随机对照试验的Meta分析显示,训练可立即减轻疼痛,且效果可持续2~6个月;另外针对这些随机对照试验的中等质量证据表明,患者的关节功能在训练后可即刻得到改善。水中运动训练对于有严重运动和功能受限的患者也大有裨益。一项涉及64名参与者的18周随访临床试验显示,在50英尺步行测试前后,水中运动训练较陆上运动训练减轻疼痛的效果更好。然而,最近一项随机对照试验的Meta分析认为,水中运动训练只对肌肉骨骼系统疾病患者的疼痛、关节功能和生活质量有中度改善作用,且效果与陆上运动训练相当。低强度的运动训练,如太极拳和瑜珈,逐渐受到OA患者的欢迎。一项基于6项随机对照试验的Meta分析结果表明,太极拳可控制膝关节OA患者的疼痛,改善其关节功能。宾夕法尼亚大学医学中心的一项初步研究显示,8周的瑜珈运动可减轻50岁以上肥胖患者的关节疼痛和功能障碍。虽然目前关于太极拳和瑜珈运动在膝关节OA治疗中应用的相关报道仍较少,但其结果对于膝关节OA患者来说是令人振奋的。
膝关节OA治疗的常用药物包括非甾体抗炎药、阿片类药、非甾体抗炎药与阿片类药物联合应用、激素类药物、软骨保护剂、钙和维生素以及关节内类固醇注射剂。一项III期临床试验评估了OA患者每日1次口服低剂量美洛昔康治疗疼痛,连续服用3个月的有效性和安全性。与使用安慰剂的患者相比,使用美洛昔康的患者在治疗12周时疼痛明显改善,但同时也出现了严重的不良反应,如头痛、腹泻、尿路感染和恶心。某些阿片类药物,如他喷他多和曲马多,在治疗中重度急性OA疼痛效果显著。III期临床试验结果显示,他喷他多的不良反应主要是胃肠道和中枢神经系统症状;曲马多最常见的不良反应是头晕、恶心和便秘。
最近,有临床研究证实了局部非甾体抗炎药治疗OA的有效性和安全性。局部与口服非甾体抗炎药在对膝关节疼痛超过1年的治疗中效果等同,且局部非甾体抗炎药治疗的不良反应更少;另外,相对于口服非甾体抗炎药,由于局部非甾体抗炎药的不良反应少,因此较少患者更换治疗药物。局部非甾体抗炎药治疗相对于口服非甾体抗炎药治疗不良反应少的原因可能是其峰值血药浓度更低。目前临床治疗中度OA的主要手段是关节内注射抗炎药物,如关节内注射皮质类固醇和醋氨酚常用于减轻疼痛。总体来讲,一些有效的治疗方法已被用于控制炎症和减轻疼痛,但也存在明显的不良反应。因而,有必要探寻一些替代治疗方法减轻膝关节OA患者的疼痛,如基于生物材料的黏弹性产品补充疗法。
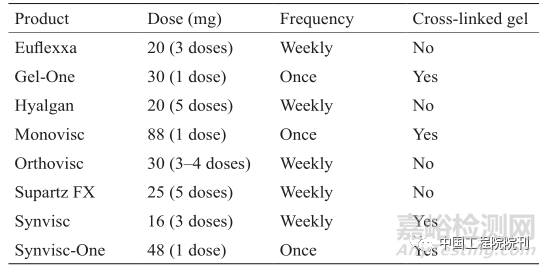
黏弹性产品补充疗法基于关节内透明质酸(HA)的注射,从而恢复关节腔滑液的黏弹性。HA是由滑膜成纤维细胞和B型滑膜细胞分泌的一种天然润滑剂,因而被广泛用于OA的治疗。HA也是细胞外基质(ECM)和大部分结缔组织、上皮细胞和神经组织的主要成分,是一种由D-葡糖醛酸和N-乙酰基-D-葡糖酰胺构成的非硫酸化二糖重复单元经β-1,4和β-1,3配糖键交互连接而成的带负电的线性多聚糖。天然HA的分子量约为1×106 Da,在滑液中的浓度约为4mg·mL–1,这一浓度在患OA后明显下降。现今,由一些国家食品和药物管理局批准的可注射的多种HA黏弹性产品已经面市(表1),如Hyalgan、Synvisc和Supartz,同时还有其他生物性状、分子量、生产程序和注射方案不同的相关产品诞生。近期的随机对照试验对比了关节内注射HA、安慰剂和皮质类固醇在OA治疗中的有效性,治疗8周后,关节内注射HA的患者,其膝关节OA疼痛和关节功能改善方面较关节内注射安慰剂或皮质类固醇者更为有效。
表1 食品和药物管理局批准的可注射透明质酸黏弹性产品
三、软骨损害与治疗方法
(一)软骨损害的发生机制
膝关节OA表现为关节软骨进行性病变,这一过程涉及关节软骨损害、软骨下骨增厚、骨赘形成与继发性滑膜炎。关节软骨是一种富含II型胶原蛋白、糖胺聚糖(如HA)和蛋白聚糖(如聚集蛋白聚糖)的无血管组织,分为3个区域。这3个区域在细胞形态和II型胶原蛋白纤维排列方面有所不同,且在控制关节机械性能方面有重要作用。
关节软骨的退变始于关节表面的纤维化和基质大分子框架的破裂。关节软骨浅层和中层表面下的胶原蛋白纤维开始排列紊乱、蛋白多糖含量下降。随着疾病的进展,纤维化蔓延至关节软骨下层(深层),达到软骨下骨;纤维化的软骨逐渐在其表面尖端开始撕裂,形成较多与表面垂直的裂隙。聚集蛋白聚糖随其核心蛋白的截断,发生快速、广泛的退变。核心蛋白裂成碎片,一些仍与HA结合,保留在组织中;而另一些则散落至关节滑液中,从而导致聚集蛋白聚糖中存在的净阴离子电荷减少,关节软骨的抗压力丧失,软骨受到侵蚀。聚集蛋白聚糖裂解存在个体差异,且在靠近软骨侵蚀部位裂解程度最高。随着聚集蛋白聚糖含量的下降,胶原蛋白成分由II型转变成I型,这种变化严重影响了骨组织的机械稳定性,因为II型胶原蛋白中羟赖氨酸、葡糖残基和半乳糖残基含量较高,有利于其与聚集蛋白聚糖相互作用。
基质退变由失衡的基质金属蛋白酶产物介导,包括可消溶软骨基质的基质金属蛋白酶(MMP)和蛋白聚糖酶。主要的基质金属蛋白酶包括基质溶素-1(MMP3)和胶原蛋白酶-3(MMP13),这种酶通过其前肽的蛋白水解移除被激活,之后在其短的球间结构域和硫酸软骨素(CS)富集结构域切割聚集蛋白聚糖。蛋白聚糖酶4和蛋白聚糖酶5,以及蛋白聚糖酶家族的其他成员是使聚集蛋白聚糖核心蛋白裂解的降解酶。研究已证实,胶原蛋白酶能够消化胶原蛋白纤维网络,从而使聚集蛋白聚糖含量下降。这些软骨基质结构和成分的改变使关节表面纤维化,从而使骨组织的机械性能降低。
ECM的改变是多种因子作用的结果,其中之一是由机械损害或组织破坏触发的炎症。软骨组织中的细胞通过参与分解代谢活动响应炎症反应,最终导致ECM降解。促发OA分解代谢过程的因子包括:肿瘤坏死因子α、白细胞介素1β、白细胞介素12、白细胞介素15和各种相关的趋化因子。这些因子使基质降解蛋白的表达明显升高,包括软骨细胞中的MMP和蛋白聚糖酶。基质破坏(由于蛋白聚糖损失)导致表面的孔隙度和通透率增加,引起组织间隙液的外流增多,最终导致组织退变和功能丧失。了解软骨退变机制有助于开发修复受损软骨组织的潜在治疗方法。
(二)软骨损害的治疗方法
软骨修复的方法包括非手术法和手术法。非手术法已在2.2节中讨论,其可缓解OA患者的早期症状,但无法重建组织的解剖形态和使损害恢复。手术方法旨在重建组织的结构和功能,达到修复损害软骨组织的目的。这些方法包括关节镜检查、软骨下骨钻孔术、软骨磨损关节成形术和微裂手术,目的在于利用来源于软骨下骨的间充质干细胞(MSC)促进软骨再生。这些方法的主要局限性在于纤维软骨的形成,因软骨吸收冲击的能力较差,原始软骨组织的功能会被损害。其他手术治疗方法包括自体软骨镶嵌成形术和自体软骨移植,这种方法通过获取自体组织或细胞修复软骨缺损。自体软骨细胞移植(ACI)是一项十分常用的治疗手段,其可在修复部位填充大量的透明组织。
在第一代ACI中,软骨细胞来源于健康软骨的活检组织,然后进行体外扩增,并于活检后的6周~18个月注射到患者体内。为了防止缺损部位软骨细胞泄漏,手术时将骨膜补片缝在或粘在手术区域,以覆盖并密封该区域。
为了减少骨膜补片带来的并发症、降低手术难度,发展了第二代ACI,也就是基质辅助的自体软骨细胞移植(MACI)。MACI所用组织工程材料为种植了自体软骨细胞的胶原蛋白或基于HA的基质,手术时,将其插入缺损部位,并用纤维蛋白胶固定。临床结果显示,MACI治疗软骨缺损的稳定性好,且手术的失败率低。ACI存在的主要问题是供体区病变、软骨细胞分布不均和软骨细胞丢失。同种异体移植作为自体移植的替代方法,存在软骨缺损边缘与供体移植物之间的整合问题,易导致移植失败。这些治疗方法均存在一个主要问题,那就是移植细胞的数量以及修复的组织的数量和质量不足,这个问题使得长期修复效果不佳。根据现有的临床试验结果,我们认为结合生物材料的细胞治疗方法可以作为关节软骨缺损修复的替代疗法。
修复关节软骨非常具有挑战性,因其具有无血管和无神经的性质以及稀疏的细胞群体。因此,选择合适的细胞来源非常关键。为此,研究者们已经对多种来源的细胞进行了鉴定,如软骨细胞和骨髓、脂肪和滑膜来源的MSC,以确定最佳的细胞来源。这些来源的细胞易分离和扩增,并且可以表达和合成具有或不具有生物材料支架的软骨特异性分子(如II型胶原蛋白和软骨聚集蛋白聚糖),成功用于软骨修复。
随着医学科学和技术领域的进步,再生医学的研究焦点已经转向使用生物材料的软骨再生。多种生物材料(包括天然和合成生物材料)已被用于递送细胞和其他信号分子,以有效地促进软骨组织再生。多种生物材料,如水凝胶、海绵/泡沫、纤维基质和层状结构,已被用于制备多种支架。图2为应用细胞–生物材料方法修复软骨损害。
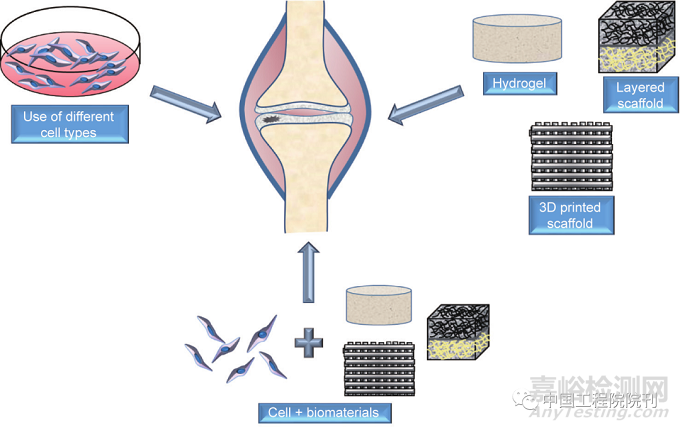
图2. 应用细胞–生物材料方法修复软骨损害。
1.水凝胶
水凝胶是高含水量的3D聚合物网络,可模拟天然ECM含水量。水凝胶通过物理或化学交联的方法形成,并且是控释细胞和生物活性分子至靶位点的有前景的递送载体。交联的类型和程度影响水凝胶的重要性质,如溶胀性质和弹性模量。水凝胶也可以以注射的形式使用,它可以很容易地填充任何尺寸和形状的软骨缺损,并且可以以微创的方式植入。
多种合成和天然的生物材料已被测试并用于促进软骨再生的水凝胶的开发。聚乙二醇(PEG)相对具有惰性和生物相容性,因而成为制备水凝胶的最常用的合成生物材料之一。然而,PEG不支持软骨特异性基质产生,且其在促进软骨形成方面达不到其他天然材料(如HA)的效果。因此,将HA掺入PEG水凝胶的方法已被证实可改善PEG水凝胶的生物活性。作为一种天然多肽,聚-L-赖氨酸(PLL)可刺激MSC早期分化为软骨细胞,因而已被用于促进软骨再生。PLL在体外可促进间充质凝集,从而模拟软骨发育过程。将PLL整合至基于寡聚(PEG富马酸酯)(OPF)的水凝胶中,可用于评估软骨再生的发育–生物学干预手段的有效性。这些水凝胶使II型胶原蛋白和软骨聚集蛋白聚糖基因以及凝集标记物N-钙黏蛋白基因在微囊化MSC中的表达早期上调。研究表明,阳离子聚合物PLL诱导早期软骨形成标志物的表达,从而复制软骨发育的凝集阶段。
海藻酸盐水凝胶也已被用于促进软骨再生、软骨ECM的合成及软骨形成。存在于藻酸盐化学结构上的负电荷诱导新合成的软骨聚集蛋白聚糖分子的保留特性。然而,这些材料的局限性在于机械稳定性差、降解速度慢和细胞黏附性差。为了克服细胞黏附性差这一问题,研究者将精氨酸–甘氨酸–天冬氨酸(RGD)肽序列(细胞黏附基序)固定在海藻酸盐支架中。RGD固定证实了局灶性细胞黏附的形成,因此改善了细胞黏附。胶原蛋白是软骨基质的重要组成部分;因此,有研究报道了胶原蛋白水凝胶对软骨再生的支持作用。胶原蛋白水凝胶在体外培养时会收缩,这为软骨细胞聚集和成软骨分化的开始提供了有利条件,该过程类似于胚胎软骨形成的过程。CS是软骨基质的另一个重要组分,因此已被广泛用于促进软骨再生。由于CS的机械性能差,已有研究者尝试通过结合另一种材料如PEG,来开发复合材料。使用N-羟基琥珀酰亚胺(NHS)修饰CS可以产生与形成化学交联的水凝胶的6个PEG-胺臂反应的CS-NHS大分子单体。改变PEG-胺前体的pH可使CS-PEG水凝胶的机械、溶胀和凝胶化性能更佳。降低pH会使凝胶时间、硬度和交联度增加,溶胀度降低。此外,通过评估CS-PEG水凝胶的黏合强度,发现其与纤维蛋白胶(临床常用的黏合剂)的黏合强度相当,这是由于其具有与ECM中含有伯胺基团的生物分子形成共价交联的能力。
因为软骨基质中富含HA,因而HA水凝胶常被用于促进软骨再生。其官能团–OH和–COOH的丰度允许其化学修饰和共价交联。如2.2节所述,HA被广泛用于OA的黏弹性补充治疗。具有高分子量的HA可产生高黏度溶液,但仅在短时间内保留在受损区域中。延长HA的体内存留时间、改善其机械性能的最常见方法是对其进行化学修饰。
水凝胶的机械和物理性能极大地取决于交联密度。已有研究应用不同的官能团对HA进行化学功能化(图3),从而实现在不用细胞毒性交联剂的情况下形成水凝胶。HA的共价交联可以通过应用–COOH和–OH官能团,经酯键和醚键连接而实现(图3)。例如,在碳二亚胺/1–羟基–苯并三唑(HOBt)存在的情况下,使用过量的己二酸二酰肼(ADH)合成二酰肼改性的HA(HA-ADH);通过高碘酸钠介导的氧化反应制备醛基修饰的HA(HA-CHO)。HA水凝胶的物理和机械性能(凝胶化时间、黏度、弹性模量和交联密度)可以通过改变进料混合物中HA-ADH和HA-CHO的比例来调节。HA-ADH与HA-CHO之间的反应导致腙键(C1=N1–N2H–(C=O)N3H)的形成,其在生理条件下不太稳定,易被溶酶体酶迅速切除。Oommen等设计了由HA-碳二酰肼(HA-CDH)和HA-醛组成的更稳定的HA系统,由此形成的腙键由于其化学结构中正电荷的非定域而稳定且不可逆。HA-CDH水凝胶在酸性条件下的稳定性是HA-ADH的15倍,两者的储能模量(G′)分别为1196Pa和297Pa。此外,高碘酸盐介导的氧化反应影响HA的生物学功能(缺乏细胞识别),限制了其应用。
为了保持HA的天然结构,Wang等设计了在温和条件下将醛基部分接枝到HA上的合成途径。或者,可以使用双官能亲电试剂如PEG二丙烯酸酯,通过硫醇–迈克尔加成反应制备HA水凝胶,该反应可以在生理条件下进行;其凝胶动力强,且可在无催化剂的情况下进行。基于硫醇反应的另一项研究应用巯基化的HA与PEG乙烯基砜,在可调节降解速率和凝胶化时间的生理条件下,形成3D水凝胶网络。这里,通过增加聚合物浓度[从0.02(w/v)到0.06(w/v)]和HA分子量(从45kDa到185kDa),使凝胶化时间从14min降低到小于1min。水凝胶的生物降解和机械强度取决于HA和PEG的分子量、聚合物浓度和巯基化HA的功能化程度。用于调节HA的化学和机械性能的另一种合成途径是应用丙烯酸酯和甲基丙烯酸酯基部分修饰HA的化学结构。甲基丙烯酸酯-HA水凝胶可以通过光交联将甲基丙烯酸酯基团连接到HA链,随后经暴露于紫外线(UV)辐射下的自由基聚合而获得。Leach等描述了HA和甲基丙烯酸缩水甘油酯之间的酯基转移作用。一系列甲基丙烯酸缩水甘油酯-HA(GMHA)共轭物产出具有不同和可控性质的GMHA水凝胶。高官能度的共轭物使水凝胶的交联密度增高,降解速率降低。
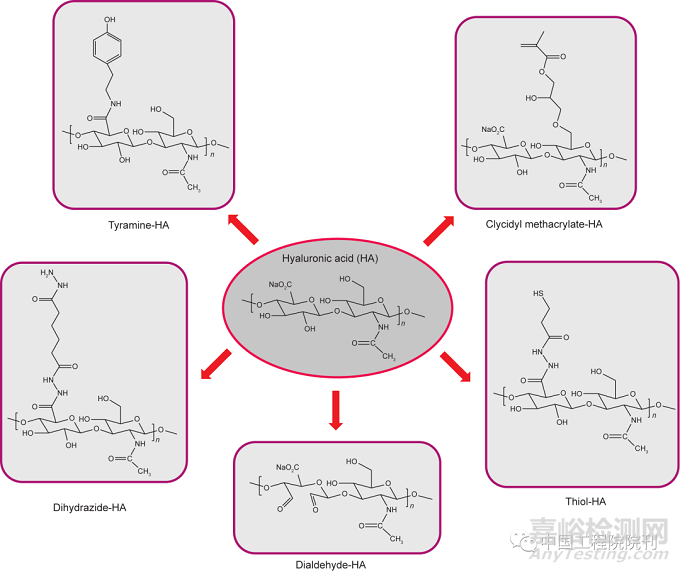
图3. 透明质酸的化学改性。
使用强化的水凝胶如填充材料或纤维的复合方法有望改善水凝胶的机械性能。因此,随着强化填充材料如纤维素或其他性质的纤维的使用,这些方法可用于改善水凝胶的机械性能。研究人员试图应用封装于纤维蛋白水凝胶中且接种了人脂肪干细胞的3D编织聚己内酯(PCL)纤维增强复合支架材料,复制天然软骨组织的复杂机械性能,该支架具备的功能性组织工程结构与天然软骨组织具有类似的生物力学特性。
上述水凝胶缺乏类似于天然软骨组织的区带组织。因此,新的策略正在被开发以复制区带组织的天然关节软骨样组织,以此来控制天然软骨的机械性能。一种包含CS和MMP-敏感型肽(表层,PEG∶CS∶MMP-pep)的顶层、包含CS(过度层,PEG∶CS)的中间层和包含HA的底层(深层,PEG∶HA)的三层基于PEG的水凝胶已被开发。这种分层的水凝胶可以促进区域特异性软骨形成和发展为具有空间变化的机械和生化特性的软骨样组织。
虽然已经开发了多种新技术用于增加水凝胶的机械性能,但是水凝胶仍然缺乏分层组织,使其成为与宿主组织有不同机械性能的各向同性组织。
2.海绵/泡沫
海绵为多孔支架,其性质受孔径、孔隙率和互连性影响。孔径是组织再生的重要因素;因此,控制孔结构非常重要。迄今为止,已经有各种方法被用于制备海绵,包括致孔剂浸出、冷冻干燥和用于软骨再生的气体发泡。已有研究制备了可使免疫反应最小化的纯化藻酸盐海绵,其可支持软骨形成。使用微流体装置制备多孔藻酸盐支架,可在凝胶化时产生藻酸盐液滴,并形成高度组织的多孔支架。该支架维持了软骨细胞表型,并促进了软骨样组织在小鼠背部皮下的形成。另一项研究使用以冰颗粒(150~250 μm、250~355 μm、355~425 μm和425~500 μm)作为致孔剂开发的具有梯度孔的多孔胶原蛋白支架,以研究该支架孔径对软骨再生的影响。该支架具有紧密填充的球形孔和良好的孔互连性,不同孔径的支架都具有98%孔隙度。该研究将构建体皮下植入6周龄小鼠的背部,结果表明,150~250 μm孔径的支架促进了II型胶原蛋白和软骨聚集蛋白聚糖的最高表达;并且与具有不同孔径的支架相比,其促进了机械性能更好的软骨样组织的形成。由于在150~250μm孔径的胶原蛋白支架中软骨形成基因的活性较高,该系统被用于递送胰岛素。装载含胰岛素的聚(乳酸–乙醇酸共聚物)(PLGA)微粒的多孔支架可持续释放胰岛素,支持软骨细胞的存活和增殖。已经用作软骨再生的其他多孔支架材料包括丝纤维、明胶、壳聚糖和HA。
然而,这些支架缺乏与天然软骨组织组成和性质相似的区带组织。因此,最近的研究重点是开发具有不同的机械性能和功能的、类似于天然软骨的多层3D支架。多层多孔支架通过堆叠与不同浓度的II型胶原蛋白混合的壳聚糖和PCL共聚物开发而成。为了复制软骨组织层状结构中的胶原蛋白成分,支架中的II型胶原蛋白含量从顶层到底层逐层减少。研究表明,这些支架在成分、多孔结构、含水量和压缩机械性能方面与天然软骨类似,从而证实了其在软骨组织工程中应用的可行性。另一项研究应用壳聚糖和CS,以逐层技术结合模板浸出,开发了具有多层3D构造的聚合电解质复合物,该构建体具有可控的孔径,吸水能力高达300%,具有黏弹性,且支持MSC的软骨分化。有研究应用沉积在颗粒浸出泡沫上的电纺PCL纤维模拟天然软骨的区带组织。双层3D支架包含上部定向纤维区域,以模拟关节软骨的表层形态,而本体多孔颗粒模板支架允许细胞浸润和广泛的ECM沉积。定向纤维的掺入也增强了拉伸性能,多孔区域促进了接种软骨细胞的浸润,从而使其增殖率和糖胺聚糖的产出率升高。合成聚合物通常缺乏诱导软骨形成的生化诱因,但其应用使双层支架显示出良好的机械性能。然而,这些支架的区带组织仍不能与天然软骨完全相同。
3.纤维网/支架
纤维网是具有多种纤维直径和空隙体积的非编织和编织的网络,能够影响细胞行为。将纤维支架用于软骨再生研究的原因在于:它具有可以使机械强度增加的高孔隙率和互连孔,但这种材料不能填充不规则缺损。微米级和纳米级纤维通常被用于模拟天然软骨组织的ECM组分。
许多研究已尝试开发具有仿生机械性能、且在植入后可维持生理负荷能力的3D纤维支架。研究者开发了由均质软骨来源的基质浸润的3D编织PCL支架,并用来源于人体脂肪的干细胞培养42d。这些编织支架有利于ECM积聚,且维持了软骨再生所需的机械性能。
电纺支架也被用于软骨再生的研究。静电纺丝产生的纳米级纤维具有作为软骨ECM模拟基质的巨大潜力。尽管纳米级纤维具有ECM模拟基质特性,但由于它的孔网络网格闭合,使细胞浸润受到限制。因此,为了克服这些限制,研究者开发了具有可变孔径的纤维(微纤维和纳米纤维)的支架。具有微纤维和纳米纤维两种不同孔径的电纺支架已被研究,它由两种不同材料(特别是纤维蛋白和PCL)组成。纳米纤维被整合至微纤维网,以被均匀地分布在整个支架结构中。与仅由微纤维构成的支架相比,该支架中的纳米纤维和微纤维促进了细胞增殖和GAG沉积,这种结果产生的原因在于由微纤维和纳米纤维共同维持的大孔径以及纳米纤维与天然ECM的组分十分相似,从而改善了细胞反应(分化和ECM的生产)。最近,以复制区域特定的组织和软骨性质为目标的软骨组织工程支架研究也取得了新进展。通过应用连续静电纺丝技术,开发了三层基于PCL的支架,其纤维尺寸和方向在连续构建体中有所变化。三层复合支架显示出的机械性能与天然软骨组织类似,且支持体外软骨的形成。纤维网用于软骨再生的主要局限性在于:①静电纺丝制成的2D网使软骨细胞变平,从而形成纤维软骨样组织;②纳米纤维电纺支架具有高刚度,导致工程化构建体与宿主组织之间的机械性能不匹配。
由于胶原蛋白纤维可控制软骨组织的机械行为,已有研究者将其以3D对齐模式加以编织,以产生大孔径;并将MSC接种于这些大孔内,以促进间充质浓缩形成软骨。纤维支架的骨架支持软骨形成和机械稳定性,因此具有促进软骨再生的重大潜力。
纤维支架已显示出了作为软骨ECM模拟物的潜力;然而,仍需对其结构进行进一步的改进,以复制天然软骨组织的结构–功能特性。
四、骨性关节炎的微创细胞疗法
限制软骨再生的外科治疗的主要因素是严重的术后感染和较长的住院时间。为了克服这些局限性,研究人员已经开始探索OA的微创治疗方法。
干细胞治疗是治疗OA的一种新方法,其中干细胞由不同组织(如骨髓、脂肪组织和滑膜)中分离,并在体外扩增,然后输回到患者体内。MSC是一种用于软骨损伤后修复的有应用前景的细胞来源,原因在于其易于体外扩增,有多向电位和免疫抑制特性,可促血管发生、抗纤维化、抗细胞凋亡和促进伤口愈合。MSC的免疫抑制特性有利于减轻促炎反应,从而促进组织修复。
在各种MSC来源中,来源于骨髓的MSC(BMSC)已被广泛用于软骨再生。关节内注射BMSC至存在前交叉韧带(ACL)、内侧半月板和股骨髁软骨等多重组织损伤的大鼠关节中的结果显示,BMSC迁移到受损部位,细胞周围发生ECM合成的组织再生。此外,有研究报道,与注射1×106个MSC相比,注射更多的MSC(1×107个细胞)可使其更有效地迁移至受损组织。然而,注射1×107个细胞会导致瘢痕组织的形成,这是应用更多MSC的不良反应,也是引起关节功能障碍的原因。因此,有必要优化移植细胞的数量。此外,适当的传递系统的应用可能有助于制定更好的MSC微创治疗OA的策略。
在另一项研究中,培养于组分为Ham’sF12/DMEM(FD比例为1﹕1)、1%胎牛血清(FBS)和5ng·mL–1转化生长因子β3(TGF-β3)、50ng·mL–1胰岛素生长因子-1(IGF-1)的软骨形成培养基(CM)或培养于含FD和10%FBS的基础培养基(BM)中的自体BMSC,以2×106个细胞的数量单次注射于OA绵羊模型关节内。通过内侧半月板全切除术和ACL切除术建立OA绵羊模型。注射后6周,与对照组相比,在CM和BM培养基中培养的BMSC的关节内注射可减轻OA膝关节中的软骨破坏和延缓OA进展。对照组损伤评分最高,为(3.44±0.38)分;其次为BM组,为(1.22±0.89)分;CM组损伤评分最低,为(0.8±0.35)分,且病变程度浅、边缘平滑。研究表明,CM组在软骨组织结构、厚度和质量,以及半月板修复方面均优于BM组和对照组,从而证明了关节内注射BMSC在微创治疗OA中的潜力。
在一些有价值的临床前研究的基础上,多个临床试验已于最近完成,进一步验证了关节内注射BMSC的临床应用潜力。Centeno等完成了一项将MSC直接注射至膝关节的临床试验。该试验先将MSC悬浮于PBS中,然后将其注射到患有退行性OA的患者膝关节中。在第2周给患者第2次注射1mL 10 ng·mL–1(促进软骨形成的小剂量)的地塞米松。3个月和6个月的随访结果显示,OA患者的软骨体积增加(高达28.64%),疼痛减轻。这项研究的局限性在于只有1例病例,且无长期随访结果。
另一项由Centeno等开展的研究纳入了更大样本量的患者人群,并对BMSC注射治疗的有效性进行了长达(10.6±7.3)个月的随访。结果显示,BMSC注射后,在膝关节中未发现肿瘤形成或其他并发症。为了进一步研究关节内注射BMSC的安全性,Davatchi等在向4例中重度OA患者膝关节注射了2×107~2.4×107个BMSC后,进行了6个月的随访;Emadedin等在向6例OA患者进行膝关节内注射8×106~9×106个BMSC后,进行了1年的随访。研究结果显示,注射BMSC后的6个月,患者疼痛明显减轻,行走能力明显改善。然而,这些改善在注射后的6个月后有所下降,表明这些患者还需要进行第2次注射。Orozco等观察到了有关关节内注射的更有价值的结果。他们使用了比以前的研究中使用的更多数量的自体BMSC(4×107个)治疗12例保守治疗无效的慢性膝关节疼痛患者。随访1年发现,患者疼痛明显减轻,软骨体积迅速、逐步增加。Soler等在一项I/II期临床试验中,给予15例膝关节OA患者单剂量关节内注射4.09×107±0.04×107个自体BMSC。在注射8天后,疼痛强度相对降低,且该效果保持至12个月后。在12个月后,患者身体和生理功能也有所改善,且有软骨再生现象。这些研究为BMSC在治疗膝关节OA中的显著潜力提供了临床证据。然而,这些研究中实施方案和细胞数量的差异表明,利用BMSC治疗膝关节OA的最佳方案仍需进一步明确。
与BMSC不同,来源于脂肪组织的MSC(ADSC)可以微创的方式分离,且可获得的细胞数量更多。在OA的动物模型中进行的ABSC关节内注射取得了振奋人心的结果。TerHuurne等研究了向胶原蛋白酶诱导的OA小鼠模型关节内注射ADSC的抗炎和软骨保护作用。ADSC抑制关节滑膜衬里增厚和软骨破坏,并保护其免受合成和分解代谢介质的联合破坏。有些研究者在兔OA模型中进行了类似研究,该研究向动物模型关节内注射1×106个ADSC。研究结果表明,动物对ADSC关节内注射的耐受度较高,且该注射在减轻OA的临床症状的同时,未引起免疫反应,这可能是由于ADSC的抗炎特性和低免疫原性。此外,关节内注射ADSC治疗可在不到3个月的时间内改善患有髋关节OA的狗的肢体功能。ADSC作为替代细胞来源,已被用于临床研究。Koh等将4.04×106个ADSC注射于30例老年患者的膝关节内。研究结果发现,ADSC注射可促进损害软骨的恢复、减轻疼痛、改善功能;同时ADSC注射还是一种简单、性价比高的方法,因为细胞的获取和再注射可以在同一天完成,且不需要住院。Jo等进行了另一项研究,他们向18例膝关节OA患者的膝关节内注射了不同剂量的ADSC[低剂量(1×107个细胞)、中剂量(5×107)和高剂量(1×108)]。低、中剂量组患者的关节功能和疼痛明显改善,但低剂量组软骨缺损的尺寸增加;中、高剂量组软骨缺损的尺寸减小。此外,高剂量组表现出厚的透明样软骨覆盖于缺损部位。这些研究证明,关节内ADSC注射可安全、有效地治疗OA。然而,这些研究的主要局限性在于注射的ADSC因未被鉴定而可能包含脂肪细胞。
来源于滑膜的MSC(SDSC)也已成为OA治疗的合适细胞来源,因其容易获取且软骨分化能力强。SDSC可以微创的方式从滑膜中提取,且供体部位并发症较少。虽然BMSC和ADSC对OA的治疗显示出振奋人心的结果,但利用在发育上更接近于软骨细胞的细胞(如祖细胞/干细胞)进行移植治疗OA可能更有效。在滑膜关节的发育过程中,软骨和滑膜起源于共同的细胞池,并且源自滑膜和滑液的SDSC具有软骨修复潜力。对猪模型关节内注射SDSC可修复损害软骨的表面,这一点从透明软骨标记物的强染色中可明显观察到。从两种不同的小鼠品系(MRL或C57BL6)中分离的SDSC也已被用于小鼠关节内注射治疗OA。研究结果发现,在这两种品系的小鼠模型中,软骨蛋白多糖水平得以维持,软骨修复效果得到增强,关节恶化程度得以抑制。在一项利用大鼠OA模型研究单次或重复关节内注射SDSC治疗效果的研究中,研究者通过横切ACL诱导OA,并在大鼠膝关节内注射1×106个SDSC。结果表明,单次关节内注射无效,而重复关节内注射SDSC具有显著保护软骨的作用,且效果维持12周。SDSC的周期性注射,不仅可在不引起MSC特性丢失的情况下维持细胞活力,还能通过促进营养因子的分泌抑制OA的进展。注射后,大多数SDSC迁移到滑膜,但未长期存活;剩余的几个细胞保持其特性,并产生用于维持软骨稳态的蛋白聚糖4(PRG-4)和骨形态发生蛋白(BMP),以及用于抗炎的TNF刺激的基因6蛋白(TSG-6),从而有助于软骨保护并减缓OA进展。这些研究表明,外源性递送SDSC可能是微创治疗OA的不错选择。
尽管这些研究结果展示出了微创细胞疗法治疗OA的有效性和安全性,但仍需解决几个影响治疗效果的问题,以便制定最佳治疗策略。这些因素包括:剂量大小、细胞数量(单次或多次注射)以及用于细胞递送(如果需要)的适当载体,以确保细胞灌输后迁移至靶组织。
五、未来展望和挑战
膝关节OA是一种表现为软骨缓慢降解,引发患者疼痛和残疾的慢性疾病,可降低患者的生活质量。应用生物材料和细胞的新治疗策略在临床前和临床研究中均显示出强大的潜力。细胞疗法的主要局限性在于靶组织中的细胞滞留性差,其原因可能是由于滑液的快速再循环导致细胞移动到身体其他部分。为了解决这个问题,需要设计先进的递送系统,以使细胞留存的时间延长、促进受损软骨组织的愈合。此外,虽然生物材料的使用已经在OA的治疗中表现出了振奋人心的结果,但这些生物材料的结构和功能特性仍需进一步改进。了解OA的病理生理学和这些治疗方法的作用机制将有助于我们改进当前的技术。再生工程涉及的多种治疗方法集合了先进的材料科学、干细胞科学、物理学、发育生物学和临床转化,具有开发创新性策略解决当前膝关节OA治疗局限性的潜力。

来源:中国工程院院刊


