您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-23 11:17
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
杭州嘉因SMA基因疗法获批临床。嘉因生物自主研发的基因疗法EXG001-307注射液获国家药监局临床试验默示许可,拟开发用于治疗1型脊髓性肌萎缩症(1型SMA ),伴有存活运动神经元1(SMN1)基因的双等位基因突变(缺失)。这是中国境内首个被批准进入注册临床试验的静脉注射治疗1型SMA的基因治疗产品。EXG001-307与诺华已获批Zolgensma的作用机制和用法相似,有望一次给药长期有效。
国内药讯
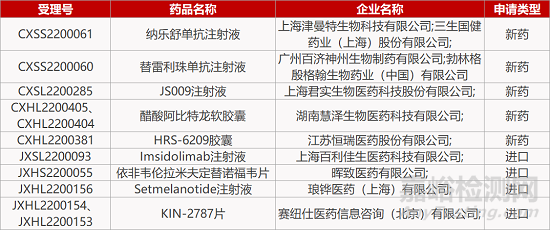
1.艾滋病三合一复方片剂在华报产。Mylan公司与晖致医药联合申报的5.1类新药依非韦伦拉米夫定替诺福韦片的上市申请获CDE受理。这是一款由依非韦伦、拉米夫定和替诺福韦组成的复方片剂,该三联组合疗法在美国已分别以商品名Symfi(依非韦伦600mg/拉米夫定300mg/富马酸替诺福韦二吡呋酯300mg)和Symfi Lo(依非韦伦400mg/拉米夫定300mg/富马酸替诺福韦二吡呋酯300mg)获批上市,用于治疗成人和儿童1型人免疫缺陷病毒(HIV-1)感染者。
2.百济神州PD-1单抗新适应症报产。CDE受理百济神州PD-1抗体替雷利珠单抗联合化疗一线治疗肿瘤表达PD-L1的晚期或转移性胃或胃食管结合部(G/GEJ)腺癌患者的新适应症上市许可申请。这是替雷利珠单抗第10个申报上市的适应症。在一项国际 RATIONALE 305(NCT03777657)研究中,与安慰剂联合化疗相比,替雷利珠单抗联合化疗显著延长PD-L1表达患者的总生存期(OS),而且临床中未出现新的安全性警示。
3.泽璟JAK抑制剂达III期临床主要终点。泽璟制药自主研发的JAK抑制剂1类新药盐酸杰克替尼片对照羟基脲片治疗中、高危骨髓纤维化的III期临床(ZGJAK016)期中分析结果积极。试验的主要疗效终点为24周时基于中心影像学评估的脾脏体积较基线缩小≥35%的患者比例。经独立数据监查委员会(IDMC)评估,判定杰克替尼片达到主要疗效终点。详细数据将在学术会议上公布。
4.强生EGFR/c-Met双抗皮下制剂报IND。CDE受理强生EGFR/c-Met双抗amivantamab皮下注射剂型的临床试验申请。Amivantamab是一种靶向作用于EGFR耐药突变、MET突变和扩增的双抗药物。amivantamab静脉注射液(Rybrevant)已于去年5月获FDA加速批准上市,用于治疗EGFR突变的转移性非小细胞肺癌。2020年7月,强生/杨森已向CDE申报amivantamab静脉注射剂型,并在同年9月获得CDE授予的突破性疗法资格。
5.信达PD-1/IL-2抗体获批肿瘤临床。信达生物1类新药IBI363获国家药监局临床试验默示许可,拟开发适应症为晚期肿瘤。IBI363是一款采取非对称二聚体设计的PD-1/IL-2抗体融合蛋白,通过将IL-2通路刺激与PD-1免疫检查点阻断相结合,从而治疗恶性肿瘤。目前该新药正在澳大利亚开展Ⅰ期临床试验,针对晚期恶性实体瘤和淋巴瘤受试者。
6.圆因融资推进环状RNA新冠疫苗项目。专注于利用环状RNA技术开发新型疫苗及创新疗法的圆因生物(Therorna)宣布完成超过2.8亿元人民币A轮融资。该公司成立于2021年4月,目前已建立了丰富的预防性及治疗性新药产品管线。与线性RNA相比,环状RNA在表达量、稳定性、免疫原性可控与生产方面有着突破性的优势。此轮融资将用于加快推进该公司的环状RNA新冠疫苗的临床应用。
国际药讯
1.艾伯维偏头痛新药在美报sNDA。艾伯维宣布已向FDA递交CGRP拮抗剂Qulipta(atogepant)的补充新药申请(sNDA),用于预防慢性偏头痛成人患者的偏头疼发作。如果获批,Qulipta将成为首款可用于预防包含发作性和慢性偏头痛的口服CGRP受体拮抗剂。在一项Ⅲ期临床PROGRESS中,与安慰组相比,60mg QD或30mg BID剂量的atogepant治疗组患者每月平均偏头痛天数较基线显著减少,试验达到主要终点和所有次要终点。atogepant的总安全性与已获批的发作性偏头痛患者治疗时所观察到的一致。
2.阿斯利康ASO疗法Ⅲ期临床成功。阿斯利康与Ionis联合开发的反义寡核苷酸(ASO)疗法eplontersen在治疗淀粉样变性多发性神经病(ATTRv-PN)的Ⅲ期临床达到共同主要终点。eplontersen在35周时显著降低患者血清内TTR浓度较基线改变的百分比;患者mNIS+7评分自基线的改变百分比与安慰剂组相比也具有显著性改善。ATTRv-PN是由遗传性转甲状腺素蛋白(TTR)介导的致命罕见病。两家公司预计今年递交新药申请。
3.GSK单剂量佐剂RSV疫苗Ⅲ期临床积极。葛兰素史克单剂量佐剂呼吸道合胞病毒(RSV)老年(OA)候选疫苗RSVPreF3 OA在Ⅲ期临床(AReSVi 006)中获阳性顶线结果。经独立数据监测委员会(IDMC)评估,该疫苗在60岁及以上老年人群中的有效性达到主要终点。此外,RSVPreF3 OA对RSV A型和B型、关键次要终点、70岁及以上老年人群中观察到的有效性显示出一致性。详细结果将在同行评议期刊和科学会议上公布。
4.诺华SMA基因疗法最新临床数据积极。诺华基因疗法Zolgensma治疗脊髓性肌萎缩症(SMA)的Ⅲ期SPR1NT试验最终结果发表在《自然-医学》(Nature Medicine)上。在双拷贝队列中,所有在症状前接受治疗的儿童(100%)均达到独立坐立≥30秒的主要终点,包括11/14(79%)的患者在WHO正常发育窗口内实现这一里程碑。在三拷贝队列中,所有15名儿童(100%)都达到独立站立≥3秒的主要终点,包括14/15(93%)在WHO正常发育窗口实现该里程碑。临床中未发现新的安全信号。
5.软骨发育不全新药幼龄患儿疗效显著。BioMarin公司在ENDO 2022年会上公布C型利钠肽类似物Voxzogo(伏索利肽)用于0-5岁软骨发育不全症患儿治疗的Ⅱ期临床积极数据。与安慰剂相比,Voxzogo治疗组第52周时患儿身高Z-评分增加0.30 SD(95%CI:0.07,0.54),年化生长速度增加0.92厘米/年(95%CI:0.24,1.59)。身高Z评分的改善与之前在5岁以上儿童治疗一年后观察到的改善一致。BioMarin计划向监管部门提交Voxzogo的补充上市申请。
6.默沙东21价肺炎球菌疫苗即将上Ⅲ期临床。默沙东21价肺炎球菌结合疫苗V116用于在18岁以上成人中预防球菌性肺炎的Ⅰ/Ⅱ期临床(V116-001)结果积极。与活性对照相比,V116在所有共同的血清型均达到非劣效免疫原性;在新增的8种血清型中,V116亦表现出良好的免疫反应。该疫苗总体安全性良好。详细结果发表在ISPPD2022会议上。默沙东计划7月启动Ⅲ期临床试验。
医药热点
1.上海率先推出三大健康科普影响力指数。为贯彻落实国家卫健委等九部门联合印发的《关于建立健全全媒体健康科普知识发布和传播机制的指导意见》,增加优质健康科普资源供给,持续加强防疫健康科普宣传,上海市在全国率先推出“医疗机构健康科普影响力指数”“社区卫生服务中心健康科普影响力指数”“医务人员个人健康科普影响力指数”,旨在通过“三个指数”引领、激励全市各级各类医疗机构及医务人员开展健康科普,使上海市民有更多健康获得感,并增强上海健康科普对长三角乃至全国的辐射力。
2.我国拟建设10个左右儿科类国家区域医疗中心。21日,国务院关于儿童健康促进工作情况的报告提请十三届全国人大常委会第三十五次会议审议。报告中提出,完善儿童用药监测预警机制,持续推动儿童药品集中生产基地建设,努力推动实现一批儿童国产药品上市;支持开展10个左右儿科类国家区域医疗中心建设项目,推进优质资源下沉;加强儿童健康全程服务,并促进公共资源向儿童适度倾斜。
3.猴痘病例输入亚洲。新加坡卫生部6月21日表示,在新加坡发现首例猴痘境外输入病例。该确诊病例为一名42岁英国籍男子,是一名空乘人员,目前在新加坡国家传染病中心接受治疗。卫生部已追踪到13名密切接触者,其将接受21天的隔离观察。据韩国SBS新闻报道,21日发现2例疑似感染猴痘病毒的病例。这是韩国首次报告境内出现猴痘疑似病例。其中1人初步检测结果呈阳性,是一名从德国入境韩国仁川机场的韩国人。
评审动态

来源:药研发


